
- •Оглавление
- •Раздел 1. Теоретическая часть 3
- •Раздел 2. Индивидуальное задание 17
- •Цели и задачи
- •Раздел 1. Теоретическая часть
- •1.1. Основные элементы диаграммы
- •1.2. Виды диаграмм двух компонентных систем в процессе охлаждения
- •Диаграмма состояния двухкомпонентной системы с химическими соединениями.
- •Диаграмма состояния двухкомпонентной системы с явлением ликвидации.
- •Диаграммы состояния двухкомпонентных систем с твердыми растворами.
- •1.2.1. Диаграмма двухкомпонентной системы с одной точкой эвтектики
- •1.2.2. Диаграмма состояния двухкомпонентной системы с химическими соединениями
- •1.2.3. Диаграмма состояния двухкомпонентной системы с явлением ликвидации
- •1.2.4. Диаграммы состояния двухкомпонентных систем с твердыми растворами
- •1.3. Правило рычага
- •Раздел 2. Индивидуальное задание
- •2.1. Диаграмма равновесия
- •2.2. Исходные данные и метод определения задания
- •2.3. Вывод
- •Список литературы
1.2.3. Диаграмма состояния двухкомпонентной системы с явлением ликвидации
Ликвация – расслоение жидкости на две, каждая из которых имеет свой состав и свои свойства. Внешний вид диаграммы показан на рисунке 3. Область концентраций, для которых наблюдается явление ликвации, ограничена кривой F – L1 – L2 – G. Пути кристаллизации составов данной диаграммы приведены в табл.7.
Кристаллизация компонента В при температуре Т2 идет из расплава, который содержит в себе большее количество этого компонента, то есть из расплава G, состав которого меняется по прямой GF к точке F. В точке F составы расплавов сравниваются и ликвация как явление пропадает.
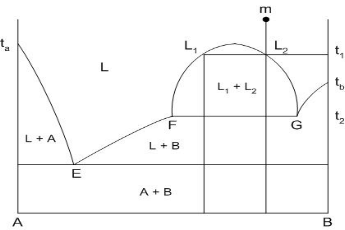
Рисунок 3. Диаграмма состояния двухкомпонентной системы с явлением ликвации
Таблица 3
Фазовые изменения в системах с ликвацией
|
Температура |
Равновесные фазы |
Примечание |
|
Состав m |
||
|
T = T1 |
L1 + L2 |
Расслоение жидкой фазы на две |
|
T2 < T < T1 |
L1→f + L2→g |
- |
|
T = T2 |
Lf + Lg + B |
Кристаллизация В идет из расплава Lg |
|
Te < T < T2 |
Lf→e + B |
- |
|
T = Te |
Le + B + A |
- |
|
T < Te |
B + A |
- |
1.2.4. Диаграммы состояния двухкомпонентных систем с твердыми растворами
Если содержащиеся в твердом растворе компоненты могут смешиваться в любых соотношениях, то данный процесс является с твердыми растворами неограниченной растворимости или непрерывным рядом твердых растворов. При наличии однофазного твердого раствора из двух компонентов, находящегося в равновесии с расплавом, состоящим их тех же компонентов, степень свободы системы будет равна единице, то есть каждой температуре соответствует строгая концентрация компонентов в твердом растворе и расплаве (рисунок 4). На диаграмме появляется кривая, показывающая изменение состава твердой фазы при изменении температуры (кривая Та – S1 – Тв).
Составы равновесного расплава и твердого раствора определяются концами конноды, проведенной при заданной температуре, например между точками L1 и S1. Когда точка М достигнет линии ликвидуса, начинается кристаллизация твердого раствора S1. При дальнейшем понижении температуры состав жидкости меняется по кривой ликвидуса, состав твердого раствора – по кривой солидуса.
При
температуре Т2,
когда состав твердого раствора совпадает
с исходным составом системы, кристаллизация
закончится. Изменение состава твердого
раствора в процессе кристаллизации
происходит за счет диффузии атомов или
ионов одного компонента в кристаллической
решетке.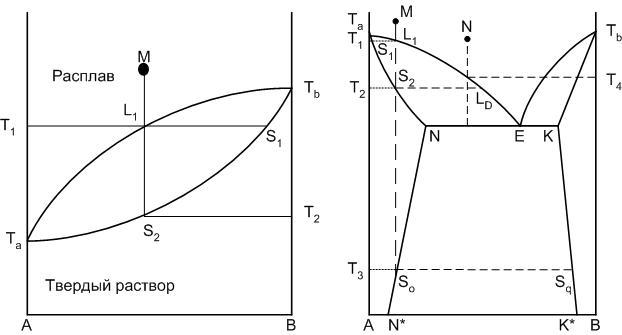
Рисунок 4. Диаграммы равновесия двухкомпонентных систем с твердыми растворами
Если смешиваемость компонентов происходит лишь до некоторых пределов концентраций, то такой твердый раствор называется твердым раствором с ограниченной растворимостью.
При эвтектической температуре в равновесии с расплавом находятся два твердых раствора: α и β. Точки N и К – точки предельной концентрации твердых растворов, которая изменяется при понижении температуры по линиям предельной растворимости.
На диаграмме исходных составов системы, пути кристаллизации которых отличаются друг от друга, можно выделить три интервала: А–N*, N*-N, N–E, если рассматривать точку эвтектики как точку симметрии диаграммы. Пути кристаллизации составов, находящихся в интервале A-N*, не отличаются от путей кристаллизации составов с твердыми растворами неограниченной растворимости.
Таблица 4
Пути кристаллизации составов системы
|
Температура |
Равновесные фазы |
Примечание |
|
Состав М |
||
|
Т = Т1 |
L1 + тв.р-рS1 |
- |
|
Т→Т2 |
L(1→D) + S(1→2) |
- |
|
Т = Т2 |
тв.р-р (S2) |
Кристаллизация закончилась |
|
Т = Т3 |
тв.р-р (So) + тв.р-р (Sq) |
Разделение в твердой фазе на два раствора |
|
Т < Т3 |
тв.р-р (So→n*) тв.р-р (Sq→ k*) |
Изменение концентрации твердых растворов по линиям предельной растворимости |
|
Состав N |
||
|
Т = Т4 |
тв.р-р (S4) + расплав L4 |
(составы условно не показаны) |
|
Т = Те |
тв.р-р (Sn) + тв.р-р (Sk) |
Кристаллизация закончилась |
|
Т < Те |
тв.р-р Sn→ n* + тв.р-р Sk→ k* |
Изменение составов твердых растворов |
