
- •Введение
- •Глава 1. Основные положения координационной теории
- •1.1. Определение комплексных соединений
- •1.2. Основные понятия
- •1.3. Номенклатура комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Изомерия комплексных соединений
- •Глава 2. Природа химической связи в комплексных соединениях
- •2.1. Электростатическая теория
- •2.2. Метод валентных связей
- •2.3. Теория кристаллического поля
- •2.4. Теория поля лигандов
- •Глава 3. Свойства комплексных соединений
- •3.1. Окраска комплексных соединений
- •Периода в водном растворе
- •3.2. Магнитные свойства комплексных соединений
- •3.3. Равновесия в растворах комплексных соединений
- •3.4. Устойчивость комплексных соединений
- •3.4.1. Природа центрального атома и лигандов
- •3.4.2. Хелатный эффект
- •3.4.3. Стерические факторы
- •3.5. Кинетика и механизм реакций обмена лигандов
- •3.6. Кислотно - основные свойства комплексных соединений
- •3.7. Окислительно-восстановительные свойства комплексных соединений
- •Глава 4. Координационные соединения металлов
- •4.1. Подгруппа железа
- •4.1.1. Железо
- •4.1.2. Кобальт
- •4.1.3. Никель
- •В комплексных соединениях металлов подгруппы железа
- •4.2. Платиновые металлы
- •В комплексных соединениях платиновых металлов
- •4.3. Подгруппа марганца
- •В комплексных соединениях металлов подгруппы марганца
- •4.4. Подгруппа хрома
- •Комплексных соединениях металлов подгруппы хрома
- •4.5. Подгруппа ванадия
- •В комплексных соединениях металлов подгруппы ванадия
- •4.6. Подгруппа титана
- •В комплексных соединениях металлов подгруппы титана
- •4.7. Подгруппа цинка
- •В комплексных соединениях металлов подгруппы цинка
- •4.8. Подгруппа меди
- •В комплексных соединениях металлов подгруппы меди
- •4.9. Подгруппа алюминия
- •4.10. Комплексные соединения s-элементов
- •Катионов подгрупп iАи iiа при 25оС
- •Глава 5. Координационные соединения и медицина
- •5.1.Основные биолиганды
- •5.2. Некоторые основные биометаллы
- •5.3. Избыток и недостаток металлов-микроэлементов
- •5.4. Хелатотерапия
- •5.5. Лекарственные препараты в качестве лигандов
- •5.6. Координационные соединения металлов как противоопухолевые средства
- •Приложение
- •Им окраски
- •Литература
- •Оглавление
- •Глава1.
- •Глава2.
- •Глава3.
- •Глава 4
- •Глава5. Координационные соединения
- •Учебное пособие
- •117997, Москва, ул. Островитянова, д.1.
1.4. Классификация комплексных соединений
Комплексные ионы могут входить в состав молекул различных классов химических соединений: кислот, оснований, солей и др. В зависимости от заряда комплексного иона различают катионные, анионные и нейтральные комплексы.
Катионные комплексы
В катионных комплексах центральным атомом-комплексо-образователем являются катионы или положительно поляризованные атомы комплексообразователя, а лигандами - нейтральные молекулы, чаще всего воды и аммиака. Комплексные соединения, в которых лигандом выступает вода, называются аквакомплексами. К таким соединениям относятся кристаллогидраты. Например: MgCl2 6H2O или [Mg(H2O)6]Cl2, CuSO4 5H2O или [Cu(H2O)4] SO4 Н2O, FeSO4 7H2O или [Fe(H2O)6]SO4 H2O
В кристаллическом состоянии некоторые аквакомплексы (например, медный купорос) удерживают и кристаллизационную воду, не входящую в состав внутренней сферы, которая связана менее прочно и легко отщепляется при нагревании.
Один из наиболее многочисленных классов комплексных соединений - амминокомплексы (аммиакаты) и аминаты. Лигандами в этих комплексах являются молекулы аммиака или амина. Например: [Cu(NH3)4]SO4, [Pt(NH3)6]Cl4,
[Cd(NH2CH2CH2NH2)3]Cl2.
Анионные комплексы
Лигандами в таких соединениях являются анионы или отрицательно поляризованные атомы и их группировки.
К анионным комплексам относятся:
а) комплексные кислоты H[BF4], H2[SiF6], H[Ag(CN)2].
б) двойные и комплексные соли PtCl4 2KCl или K2[PtCl6],
HgI2·2KI или K2[HgI4].
в) кислородсодержащие кислоты и их соли H2SO4, K2SO4, H5IO6, K2CrO4.
г) гидроксосоли K[Al(OH)4], Na2[Sn(OH)6].
д) полигалогениды: K[I(I)2], Cs[I(I2)4].
Нейтральные комплексы
К подобным соединениям относятся комплексные соединения, не имеющие внешней сферы и не дающие в водных растворах комплексных ионов: [Pt(NH3)2Cl4], [Co(NH3)3(NO2)3], карбонилкомплексы [Fe(CO)5], [W(CO)6].
Катионно-анионные комплексы
Соединения одновременно содержат как комплексный катион, так и комплексный анион:
[Pt(NH3)4][PtCl4], [Ni(NH3)6][Fe(CN)6].
Циклические комплексы (хелаты)
Координационные соединения, в которых центральный атом (или ион) связан одновременно с двумя или более донорными атомами лиганда, в результате чего замыкается один или несколько гетероциклов, называются хелатами. Лиганды, образующие хелатные циклы, называются хелатирующими (хелатообразующими) реагентами. Замыкание хелатного цикла такими лигандами называется хелатированием (хелатообразованием). Наиболее обширный и важный класс хелатов – хелатные комплексы металлов. Способность координировать лиганды присуща металлам всех степеней окисления. У элементов основных подгрупп центральный атом-комплексообразователь обычно находится в высшей степени окисления.
Хелатирующие реагенты содержат два основных типа электродонорных центров: а)группы, содержащие подвижный протон, например, -COOH, -OH, -SO3H; при их координации к центральному иону возможно замещение протона и б)нейтральные электронодонорные группы, например R2CO, R3N. Бидентатные лиганды занимают во внутренней координационной сфере хелата два места, как, например, этилендиамин (рис.3).
Согласно правилу циклов Чугаева, наиболее устойчивые хелатные комплексы образуются в том случае, когда в состав цикла входит пять или шесть атомов. Например, среди диаминов состава H2N-(CH2)n-NH2 наиболее устойчивые комплексы образуются для n=2 (пятичленный цикл) и n=3 (шестичленный цикл).
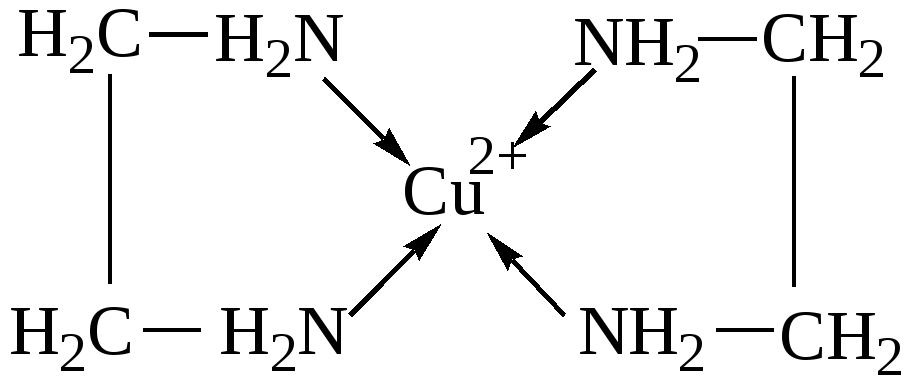
Рис.3. Катион бисэтилендиамин меди(II).
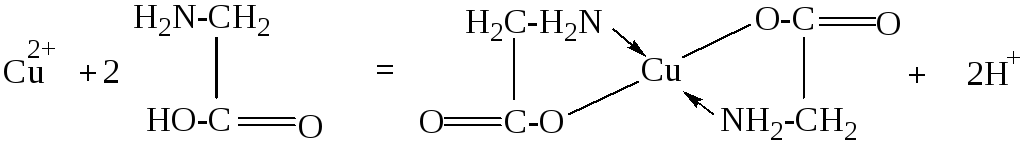
Хелаты, в которых при замыкании хелатного цикла лиганд использует протон-содержащую и нейтральную электронодонорные группы и формально связан с центральным атомом ковалентной и донорно-акцепторной связью, называются внутрикомплексными соединениями. Так, полидентатные лиганды с кислотными функциональными группами могут образовывать внутрикомплексные соединения. Внутрикомплексные соединения – это хелат, в котором замыкание цикла сопровождается вытеснением из кислотных функциональных групп одного или нескольких протонов ионом металла, в частности, внутрикомплексным соединением является глицинат меди(II):
8-Оксихинолин образует с двухзарядными ионами внутрикомплексные соединения тетраэдрической конфигурации, а с трёхзарядными – октаэдрической (рис.4).И те, и другие не заряжены и малорастворимы в воде. В качестве примера можно привести труднорастворимую в воде соль цинка (рис. 4):
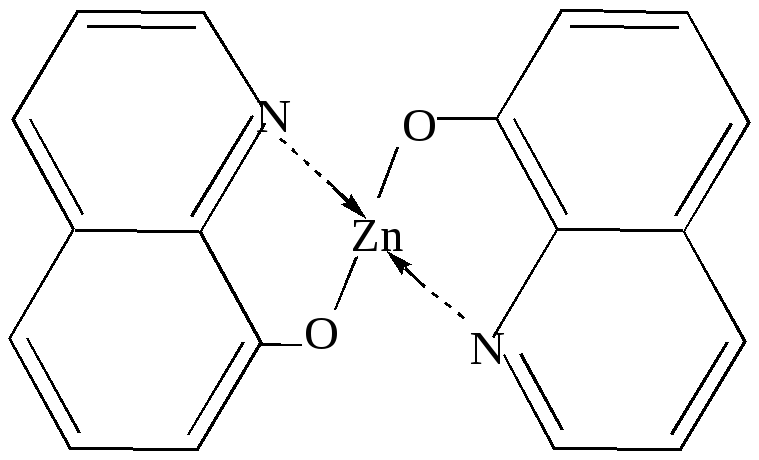
Рис.4. Внутрикомплексное соединение 8-оксихинолина с цинком.
Гемоглобин и хлорофилл также являются внутрикомплексными соединениями.
Важнейшая особенность хелатов – их повышенная устойчивость по сравнению с аналогично построенными нециклическими комплексами.
Следует выделить комплексы с макроцикличекими лигандами
Макроциклические лиганды - это гетероциклические соединения, содержащие несколько донорных атомов, связанных мостиками таким образом, что образуется полость определённого размера
Такие лиганды образуют ещё более устойчивые комплексы, в частности даже с ионами щелочных металлов (рис. 21).
Полиядерные комплексы
Комплексы, в которых лиганды связывают два или более центральных атомов, называются би - или полиядерными. В качестве примера можно привести биядерные комплексы кобальта(III): с
одной мостиковой гидроксогруппой - [(NH3)5Co-OH-Co(NH3)5]Cl5
и с двумя мостиковыми гидроксогруппами-
[(NH3)4Co -(OH)2-Co(NH3)4]Cl4 (рис.5):
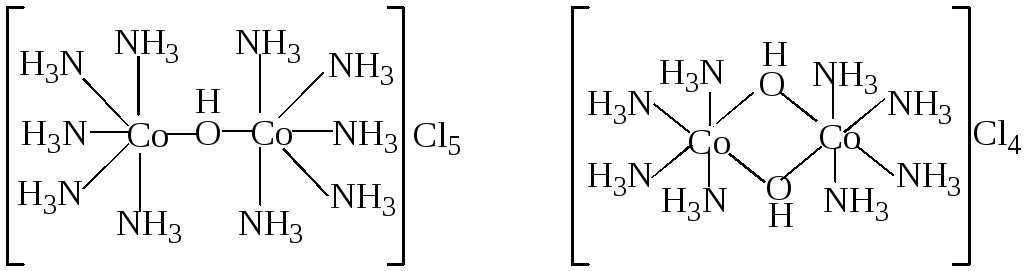
а) б)
Рис.5. Биядерные комплексы Co(III) :
а)с одной мостиковой гидроксогруппой
[(NH3)5Co-OH-Co(NH3)5]Cl5
б)с двумя мостиковыми гидроксогруппами
[(NH3)4Co -(OH)2-Co(NH3)4]Cl4.
Если полиядерные комплексы имеют химические связи между центральными атомами, такие комплексы называются кластерами. Например, октакарбонилдикобальт [Co2(CO)8](рис. 6):
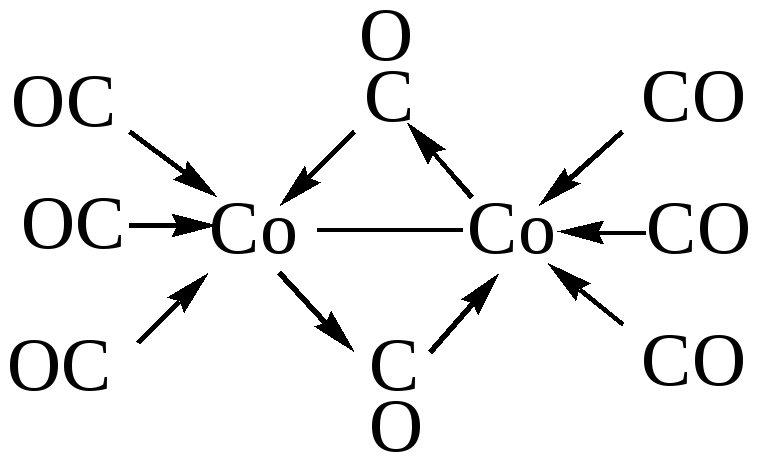
Рис.6. Октакарбонилдикобальт.
Внешнесферные комплексы
Многие комплексы могут присоединять дополнительные ионы или молекулы, не связанные непосредственно с центральным атомом. Такие комплексы называются внешнесферными. Лиганды, находящиеся во внешней сфере, удерживаются, главным образом, электростатическими силами. Помимо электростатических взаимодействий, дополнительная стабилизация может иметь место за счёт образования водородных связей, переноса заряда и донорно-акцепторных взаимодействий между лигандами внутренней и внешней сфер. Эти специфические взаимодействия лигандов проявляются, например, в изменении окраски при образовании внешнесферного комплекса. Так, комплекс серебра с бромпирогаллоловым красным окрашен в жёлтый цвет, а в присутствии фенантролина образуется голубой комплекс состава
[Ag(фенантролин)]+бромпирогаллоловый красный (рис.7):
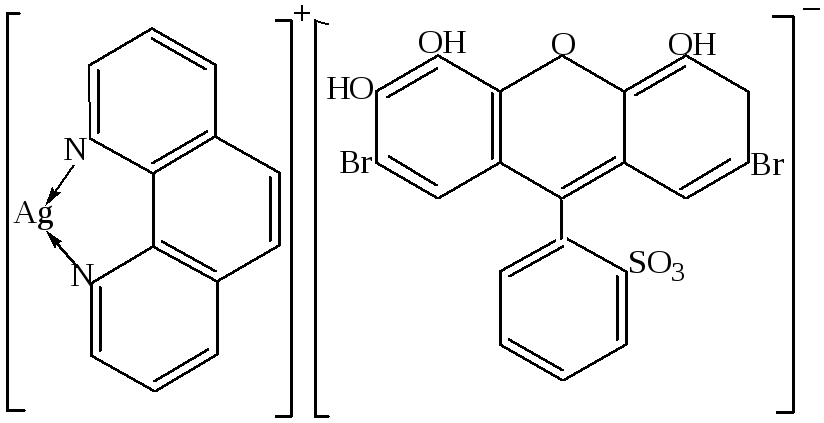
Рис.7. [Ag(фенантролин)]+бромпирогаллоловый красный.
