
- •Тема 11. Сплави кольорових металів
- •Питання 1.
- •Мідні сплави
- •Алюмінієві сплави
- •Ці сплави є пластичними, добре зварюються, стійкі проти дії агресивних середовищ. Вироби з цих сплавів отримують штампуванням, пресуванням, волочінням, рідше - різанням та литтям.
- •Ливарні алюмінієві сплави
- •Магнієві сплави
- •Нікелеві сплави
- •Питання 2. Корозія металів і сплавів, захист від корозії
- •Види корозії
- •Види корозійного руйнування
- •Корозієстійкість металів і сплавів
- •Способи захисту металів і сплавів від корозії
- •Легування
- •Покриття
- •Використання інгібіторів
Питання 2. Корозія металів і сплавів, захист від корозії
Метали та сплави на їх основі є основними конструкційними матеріалами. З них виготовляють найвідповідальніші деталі та механізми. Внаслідок взаємодії із зовнішнім середовищем деталі та механізми втрачають свою довговічність, що спричинює простоювання обладнання, втрату сировини, продукції, а часом навіть призводить до аварій з людськими жертвами.
Корозією називають руйнування виробів, виготовлених з металів і сплавів, під дією зовнішнього середовища.
Середовища, в яких руйнуються метали та сплави, називають агресивними або корозійними.
Прикладом цих середовищ є повітря, розчини солей, кислот, лугів, розплави металів, викидні та промислові гази, бензин, піт тощо. Ці середовища можуть розчинити метали та сплави або утворювати сполуки з ними: оксиди, нітриди тощо. Так, на поверхні виробів, виготовлених із сплавів на основі заліза (вугліцеві сталі, чавуни), утворюються оксиди у вигляді іржі бурого кольору.
На практиці мають місце випадки, коли на поверхні виробів неї утворюються продукти корозійного руйнування, тоді виявити пошкодження виробів дуже важко.
Корозійні середовища поділяють на:
-
електроліти;
-
неелектроліти.
Середовища-електроліти проводять електричний струм. До них належать розчини солей, кислот, лугів, морська вода тощо.
Середовища-неелектроліти не проводять електричного струму. Прикладом таких середовищ є викидні та промислові гази, спирт, бензин, мастила тощо.
Види корозії
У разі взаємодії корозійних середовищ з металами та сплавами спостерігається кілька видів корозії, які класифікують за такими ознаками як:
І.Механізм взаємодії,
ІІ.Умови взаємодії тощо.
І. За механізмом взаємодії. Залежно від механізму взаємодії зовнішнього середовища з металами та сплавами корозію поділяють на:
-
хімічну;
-
електрохімічну.
Хімічною корозією називають руйнування виробів, виготовлених, з металів і сплавів, у середовищах-неелектролітах.
Прикладом такого виду корозії є руйнування деталей нагрівних печей, казанів, турбін, двигунів внутрішнього згоряння, сопел реактивних
двигунів тощо. У разі взаємодії газового середовища (пічні та викидні гази) з металевими виробами на їх поверхні утворюються різні хімічні сполуки (наприклад, оксиди, сульфіди тощо) у вигляді плівок.
Чим вища температура середовища, тим інтенсивніше кородує метал, оскільки зростають швидкість дифузії газів через плівку до металу і зустрічна дифузія атомів металу. У разі утворення не дуже щільної та міцної плівки газове середовище може різко прискорити руйнування, виробів. Прикладом металів, на поверхні яких утворюється нещільна (крихка) оксидна плівка, є залізо, вуглецеві сталі та чавуни. Вони -надзвичайно швидко руйнуються під дією газових середовищ, оскільки їх оксидні плівки неміцні, а в разі незначної зміни температури або навантаження ці плівки відшаровуються. Поверхня виробу «оголюється» і кисень чи інший газ знову взаємодіє з металом виробу. З часом виріб тоншає, оскільки утворена плівка знову обсипається.
Отже, оксидні плівки, які утворюються на поверхні виробів, виготовлених з вуглецевих сталей і чавунів, не можуть захистити їх від корозійного руйнування. Те саме спостерігається з виробами, виготовленими з ніобію, молібдену, вольфраму тощо які працюють в атмосфері повітря чи кисню за температур 400-500°С.
Якщо на поверхні виробів утворюються міцні та щільні оксидні плівки, то корозійне руйнування сповільнюється. Прикладом таких металів є хром, алюміній та сплави на їх основі. Саме тому на практиці використовують леговані сталі, які витримують дію газових середовищ до 900°С, у той час як вуглецеві легко руйнуються за температур понад 500°С. Легування сталі хромом, алюмінієм, нікелем підвищує корозіє-стійкість сталей до температури 850-900°С.
Рідини-неелектроліти руйнують нафтогони й обладнання каталізного та термічного крекінгів нафтопродуктів та інші металеві вироби. Швидкість корозії в рідинах-неелектролітах (спирти, бензин, газ, нафта тощо) невелика, але зростає за наявності в них домішок, особливо сірки та кисню й підвищення температури середовища. Рідини неорганічного походження агресивні, тому важливо не помилитись у виборі матеріялу для виготовлення конструкцій або захисного покриття. Так, для рідин із вмістом брому придатне обладнання, виготовлене з танталу, а з вмістом сірки - з алюмінію.
Електрохемічною корозією називають руйнування виробів, виготовлених з металів і сплавів у середовищах-електролітах.
Це найпоширеніший вид корозії. Електрохемічна корозія характеризується протіканням електричного струму в електроліті, переходом атомів металу в йонізований стан та іншими електрохемічними процесами. Прикладом електрохемічної корозії є руйнування металевих конструкцій і виробів, які перебувають у середовищі вологого повітря, в морській та річковій воді тощо.
Якщо в контакті з електролітом перебувають два метали, то механізм корозії нагадує роботу гальванічного елемента, в якому метал із меншим електродним потенціалом (анод) безперервно розчиняється, а з більшим (катод) - відновлюється.
Запишемо ряд металів, розміщених у порядку зменшення їх електродних потенціалів:
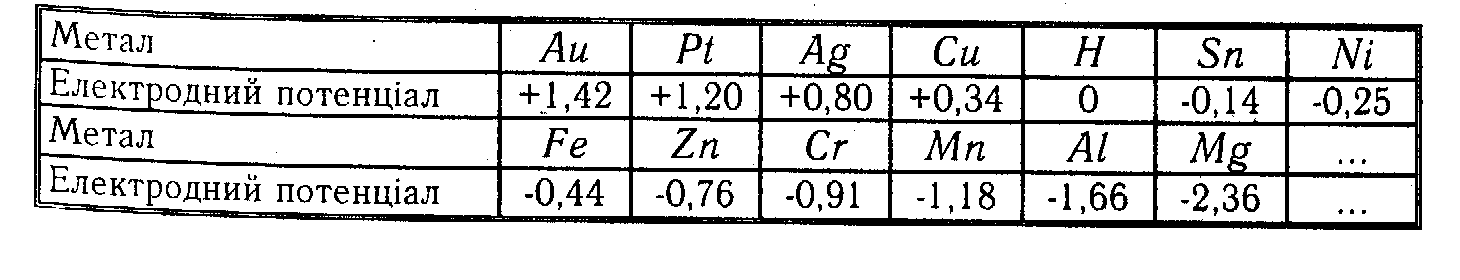
Якщо в розчин
сірчаної кислоти (середовище-електроліт)
помістити пластини, виготовлені з міді
та цинку і з'єднати їх зовнішні кінці
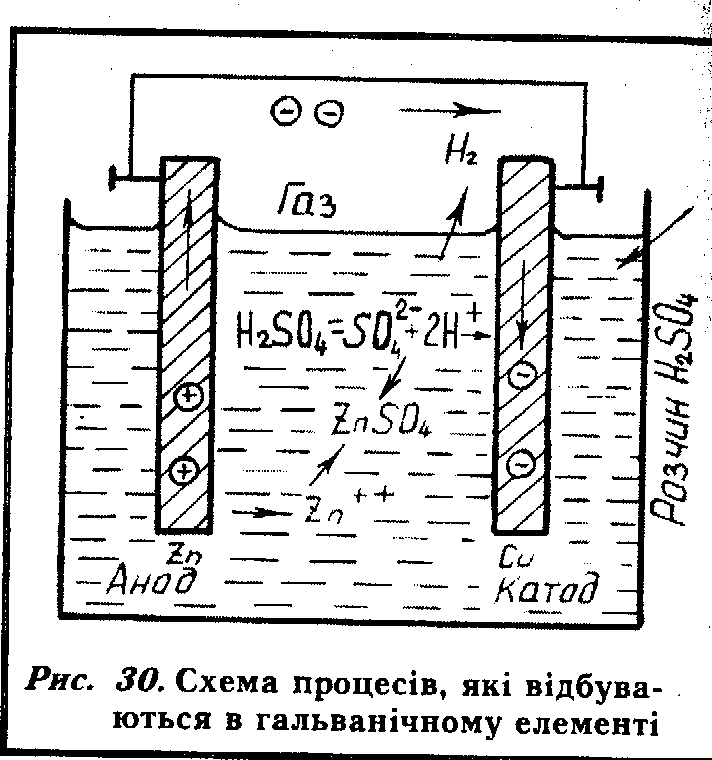
електричним привідником (рис. ЗО), то
утвориться гальванічна елемент, в якому
мідь, що має більший електродний потенціал
(+0.34), ніж цинк (-0,76), не
розчиняється, а є лише місцем
нейтралізації йонів електроліту.
Позитивно заряджені йони цинку (Zn![]() )
перейдуть в електроліт, а електрони
потечуть по зовнішньому електричному
провіднику до мідної пластинки, де
нейтралізують позитивно заряджені
йони водню (Н
)
перейдуть в електроліт, а електрони
потечуть по зовнішньому електричному
провіднику до мідної пластинки, де
нейтралізують позитивно заряджені
йони водню (Н![]() ).
Атоми водню з'єднуються в молекули
(Н
).
Атоми водню з'єднуються в молекули
(Н![]() )
і у вигляді бульбашок виходять з розчину
електроліту. Ця модель дає можливість
пояснити причину руйнування поверхні
металу, який має неоднорідну будову
(різні компоненти, фази, неметалеві
включення, зони з різними залишковими
напруженнями тощо).
)
і у вигляді бульбашок виходять з розчину
електроліту. Ця модель дає можливість
пояснити причину руйнування поверхні
металу, який має неоднорідну будову
(різні компоненти, фази, неметалеві
включення, зони з різними залишковими
напруженнями тощо).
Отже, поверхня металу - це множина мікроелементів (анодних і катодних ділянок), коротко замкнених через сам метал. Кожна ділянка має певний електродний потенціал.
Однофазні сплави стійкіші в середовищах-електролітах, ніж багатофазні, але менш стійкі, ніж чисті метали.
Швидкість корозійного руйнування тим більша, чим далі стоять один від одного метали у ряді електродних потенціалів.
II. За умовами взаємодії. Залежно від умов, в яких працюють машини, агрегати та перебувають металеві конструкції, розрізняють кілька видів корозії:
-
газову,
-
атмосферну,
-
підземну,
-
біологічну,
-
корозію під дією струмів тощо.
Газова корозія спричинюється дією на металеві вироби викидних і промислових газів та теплоти, оскільки ці гази завжди нагріті до високих температур.
У разі
атмосферної
корозії
агресивним середовищем є сконцентрована
на поверхні металевого виробу волога,
агресивність якої зростає із збільшенням
у ній газів:
О![]() ,
СО
,
СО![]() ,
SO
,
SO![]() тощо. Цей вид корозії найпоширеніший,
оскільки близько 80 % металовиробів і
конструкцій експлуатуються і зберігаються
під «відкритим небом».
тощо. Цей вид корозії найпоширеніший,
оскільки близько 80 % металовиробів і
конструкцій експлуатуються і зберігаються
під «відкритим небом».
У разі підземної (ґрунтової) корозії середовищем, яке руйнує металеві конструкції (труби, кабелі та інші підземні комунікації), є ґрунтова волога. Швидкість корозії зростає в торф'янистих і болотистих грунтах. Наявність мікроорганізмів і продуктів їх життєдіяльності руйнують навіть захисні покриття конструкцій.
Вивчення морських глибин, добування нафти з дна морів, створення потужного надводного та підводного морського флоту призводять до великих втрат металів у дуже агресивному середовищі, яким є морська вода. Вода крім хлоридів металів містить кисень та інші речовини, які спричинюють корозію.
Великих втрат завдає корозія під дією блукаючих струмів. Особливо небезпечним є постійний струм. Спостерігається цей вид корозії навколо трамвайних ліній і ліній електропоїздів. Під час руху трамваїв та електропоїздів частина електричного струму проникає в грунт, доходить до труб, якими транспортують нафту, воду, газ та інших підземних металевих конструкцій, анодні ділянки яких руйнуються. Це дуже небезпечний вид корозії: струм силою 1 А за рік «з'їдає» 9 кг заліза, 3 кг алюмінію, 11 кг цинку і міді, 34 кг свинцю. Радіус дії цього виду корозії досягає десятків кілометрів.
