
- •Лекция 10 Протолитическая теория кислот и оснований
- •1. Общая характеристика
- •2. Классификация кислот
- •3. Протолитические реакции
- •4. Вода как протонный растворитель
- •5. Сила кислот и оснований
- •Ионизация – реакция кислоты или основания с водой, сопровождающаяся увеличением абсолютной величины заряда:
- •Гидролиз – реакции заряженных кислот и оснований с водой, в ходе которых происходит понижение абсолютной величины заряда:
- •Нейтрализация – реакция переноса протона от кислоты к основанию, в ходе которой среда изменяется в направлении точки нейтральности.
4. Вода как протонный растворитель
Кислоты и основания проявляют свои свойства во взаимодействии. В растворах роль второго партнера играет растворитель. В качестве протонного растворителя особенно важна вода. Она играет роль основания по отношению к кислотам, и роль кислоты по отношению к основаниям.
При выводе констант равновесия понадобится знать концентрацию воды. Она в разбавленных водных растворах может считаться постоянной, благодаря большому избытку воды, и равной
с(Н2О)
=
![]() =
55,3 моль/л
=
55,3 моль/л
В воде устанавливается равновесие аутоионизации при концентрациях ионов с(Н3О+) = с(ОН) = 110–7 моль/л.
Н 2О
+ Н2О
Н3О+
+ ОН
или упрощенно
2О
+ Н2О
Н3О+
+ ОН
или упрощенно
 Н2О
Н+
+ ОН.
Н2О
Н+
+ ОН.
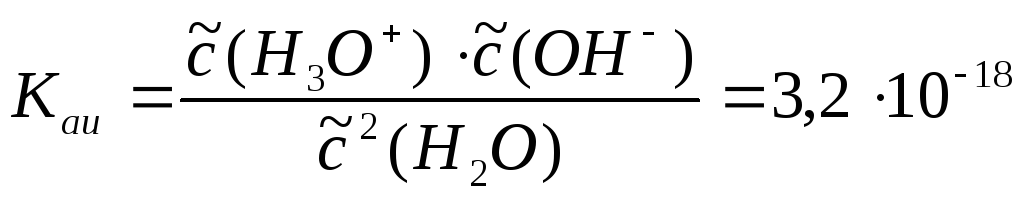
![]() (пояснение:
3,2·10–1855,3
= 1,810–16)
(пояснение:
3,2·10–1855,3
= 1,810–16)
![]() (298,15С)
(пояснение: 1,810–16
55,3
= 110–14)
(298,15С)
(пояснение: 1,810–16
55,3
= 110–14)
Последняя константа, называемая ионным произведением воды, используется наиболее часто. Приходится учитывать зависимость Kw от температуры:
-
Норм условия
Станд условия
Физиолог условия
T
273,15 К (0С)
298,15 К (25С)
310,15 К (37С)
Kw
1,110–15
110–14
2,410–14
pKw
14,96
14
13,62
Ионизацией воды обусловлено присутствие ионов гидроксония (ионов водорода, как говорят упрощенно) в водных растворах веществ любых классов, включая основания. Кислоты и основания смещают равновесие ионизации. В растворах кислот низка концентрация ОН–, в растворах оснований – низка концентрация Н3О+, но оба вида ионов всегда присутствуют одновременно, причем произведение их концентраций постоянно. Всякий раствор можно охарактеризовать как водородным показателем рН = –lgс(Н+), так и гидроксидным показателем рОН = = –lgс(ОН–).
рН + рОН = 14
Практически широко применяется только водородный показатель рН.
Вода хороший ионизирующий растворитель. Молекула воды легко связывает протон, но может и отдавать свой протон. Азотная кислота в вводом растворе ведет себя как сильная, а в уксусной кислоте – слабая.
5. Сила кислот и оснований
Вспомним, что в теории Аррениуса сила кислот характеризуется константами диссоциации. В протолитической теории константы диссоциации не имеют смысла, так как молекула НВ не может просто распадаться на протон Н+ и основание В–. Протон должен быть передан другой молекуле. Разные кислоты по силе следует сравнивать в одной и той же среде, в качестве которой логично взять воду. Поэтому сила кислоты оценивается относительно стандартной кислоты, сопряженной воде – гидроксония H3O+. Напишем гипотетические реакции отдачи протона какой-либо кислотой и гидроксонием:
Н В
В–
+ Н+
, K(HB)
В
В–
+ Н+
, K(HB)
H 3O+
H2O
+ Н+
, K(Н3О+)
3O+
H2O
+ Н+
, K(Н3О+)
Вычитая вторую реакцию из первой, получим уравнение реакции данной кислоты с растворителем:
Н В
+ H2O
H3O+
+ В–
В
+ H2O
H3O+
+ В–
При вычитании реакций их константы равновесия делятся одна на другую. Таким образом, константа равновесия этой реакции показывает, во сколько раз константа данной кислоты больше константы гидроксония:
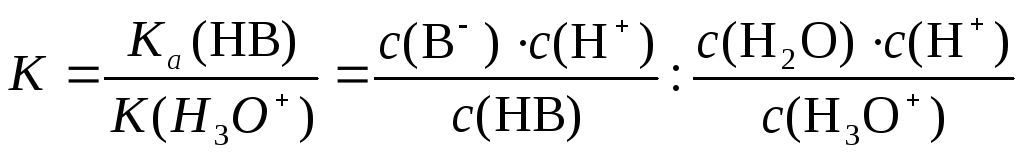
После преобразования получаем:
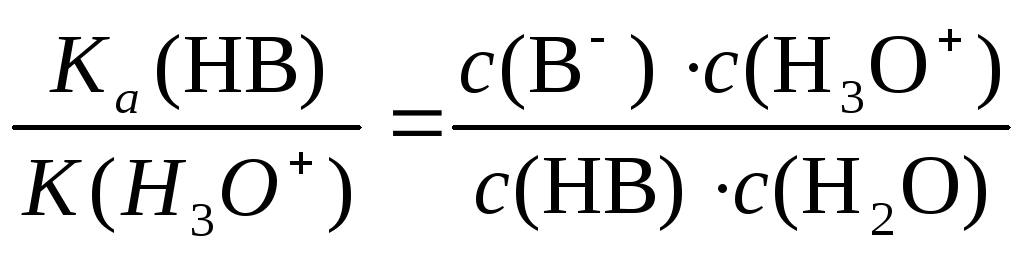
Константа отдачи протона гидроксонием непосредственно не определяется. Ее значение целесообразно принять равным 55,3. Это число совпадает с концентрацией растворителя H2O. После сокращения получаем
![]()
Константа Ka(HB) называется константой кислотности. Численно она совпадает с константой диссоциации Аррениуса, а математически показывает, во сколько раз константа данной кислоты отличается от константы гидроксония, то есть 55,3. При различных расчетах часто используется силовой показатель кислоты
![]()
Чем больше силовой показатель, тем слабее данная кислота. Константы кислотности и силовые показатели даются в таблицах в учебниках и справочниках. Обычно в таблице дается не только формула кислоты, но и сопряженного основания.
Принимая во внимание, что в растворе, содержащем только данную слабую кислоту НВ, c(H3O+) = c(B–), получим формулу для расчета концентрации ионов водорода (гидроксония) в растворе слабой кислоты:
![]() ;
;
![]() ,
,
где co(HB) – суммарная концентрация кислоты в протонированной и депротонированной форме. При наличии в растворе нескольких кислот эта формула не применима.
В случае сильной кислоты
![]() ;
;
![]()
Проводя такие же рассуждения для равновесий в растворах оснований В, получим аналогичные формулы:
В + H2O
НВ+
+ OH–
+ H2O
НВ+
+ OH–
![]()
Константа Kb называется константой основности. Соответственно,
![]() – силовой показатель
основания В.
– силовой показатель
основания В.
Концентрация гидроксид-ионов в растворе слабого основания рассчитывается по формуле
![]()
Между константой кислотности кислоты HB и константой основности ее сопряженного основания B– и их силовыми показателями имеется простая взаимосвязь:
Ka(HB)Kb(B–) = Kw = 10–14
pKa(HB) + pKb(B–) = 14
По этим формулам рассчитываются значения Kb и pKb, и поэтому нет необходимости приводить их в справочных таблицах.
Очевидно, что между силой кислоты и основания, составляющих сопряженную пару, имеется обратно пропорциональная зависимость – чем сильнее кислота, тем слабее сопряженное основание.
Зная константы кислотности и основности, можно рассчитать константу равновесия протолитической реакции, протекающей в водном растворе:
![]() или
или
![]()
Рассмотрим реакцию
1 2
 CH3COOH
+ NH3
NH4+
+ CH3COO–
CH3COOH
+ NH3
NH4+
+ CH3COO–
K 1,810–5 5,610–10
K = 1,810–5/5,610–10 = 3,2104 (степень превращения 99,5%, не зависит от начальных концентраций)
Можно рассмотреть шкалу кислот и оснований
Можно рассмотреть шкалу кислот и оснований
16 14
7 2 0 -2
pKa
оч. слабые слабые
ср. силы сильные

С2Н5ОН Н2РО4 HClO3 H3O+
С ила
кислот увеличивается
ила
кислот увеличивается
 Сила
сопряженных оснований увеличивается
Сила
сопряженных оснований увеличивается
pKb
-2 0
2
7
14 16

С2Н5О НРО42 ClO3 H2O
Типы протолитических реакций
