
- •Химическая кинетика и катализ Биомедицинская значимость темы
- •Основные понятия химической кинетики
- •Гомогенные и гетерогенные реакции
- •Скорость химической реакции
- •Измерение скорости реакции
- •Порядок реакции и константа скорости реакции.
- •Факторы, влияющие на скорость.
- •Молекулярность реакции
- •Определение порядка реакции
- •(В основе современной химической кинетики лежат две теории: теория активных соударений и теория активного комплекса.) Теория активных соударений
- •Теория активированного (переходного) комплекса (переходного состояния)
- •Катализ и катализаторы
- •Теории катализа
- •Ферменты как биологические катализаторы
- •Основные вопросы темы
Измерение скорости реакции
Прямые методы
К
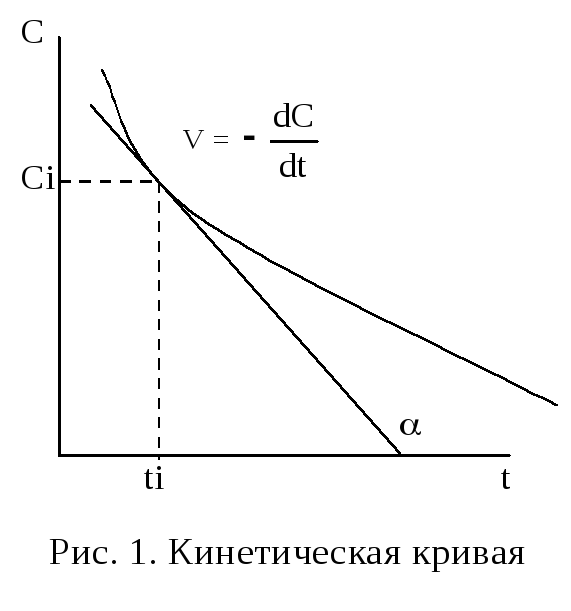
Крутизна кинетической кривой в каждый момент времени характеризует истинную скорость реакции в этот момент времени, так как наклон касательной в точке численно равен скорости:
V
=
![]() = tg
= tg
![]() α
(5)
α
(5)
Косвенные методы.
Наряду с изменением концентраций исходных веществ и продуктов реакции в ходе химического превращения меняются многие физические свойства системы: ее скорость, электропроводность, вязкость, давление, плотность и т.д.
За ходом химического превращения следят по изменению какого-либо из этих свойств системы (изменение рН раствора, электропроводности раствора, показателя преломления, оптической плотности раствора и т.д.). Например, при протекании реакции 2HI + H2O2 I2 + 2H2O
бесцв. бесцв. окраш. бесцв.
Меняется окраска раствора и её интенсивность, поэтому можно измерять оптическую плотность раствора. Другой пример. При гидролизе белков уменьшается вязкость, которую можно измерять. Следующий пример. При гидролизе АТФ выделяется H3PO4, при этом изменяется PH раствора, электропроводность (?).
Кривые, изображающие изменение какого-либо из этих свойств в ходе химического превращения, также принято называть кинетическими кривыми. Однако рассчитать скорость накопления или расходования какого-либо из компонентов реакции, исходя из такой кинетической кривой, можно лишь в случае, если существует и известна однозначная зависимость, связывающая концентрацию этого компонента с измеряемым свойством системы.
Порядок реакции и константа скорости реакции.
![]()
![]()
Факторы, влияющие на скорость.
Скорость химической реакции зависит от целого ряда факторов. При заданных внешних условиях (температура, давление, среда, в которой происходит процесс) скорость является функцией концентраций реагирующих веществ. Зависимость скорости реакции от концентраций реагирующих веществ описывается основным постулатом химической кинетики: скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени. Этот постулат вытекает из физически очевидного предположения о том, что реагируют те молекулы, которые сталкиваются. Как известно, число столкновений зависит от концентрации молекул, поэтому и скорость химической реакции должна определяться теми же факторами. Итак, для реакции А+ВС+Д можно записать:
V=k[A]m
[B]n
, (6)![]()
где величину m
принято называть порядком реакции по
веществу А, а n порядком реакции по
веществу В и т.д.
![]()
![]()
![]()
Сумму порядков реакции по всем реагирующим веществам (m+n) называют порядком реакции. Для простых реакций, протекающих в одну стадию, когда стехиометрическое уравнение отражает истинный ход процесса, показатели степени в кинетическом уравнении скорости реакции представляют собой стехиометрические коэффициенты. Например, скорость реакции
NO2
+ NO2
N2O4
согласно
опытным данным может быть записана
следующим образом V = k [NO2]
[NO2]
= k [NO2]2
, где порядок реакции в целом равен 1 +
1 = 2.
![]()
В этом случае стехиометрическое уравнение правильно отображает элементарный акт реакции. Для простых (одностадийных) реакций, как упоминалось ранее, показатели степеней в кинетических уравнениях равны коэффициентам в стехиометрических уравнениях. Эта закономерность находит свое отражение в законе действующих масс, сформулированном в 1867 году норвежскими учеными К.Гульдбергом и П.Вааге: скорость простой реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, имеющихся в данный момент времени, возведенных в степени, равные коэффициентам в стехиометрическом уравнении.
Таким образом, закон действующих масс является частным случаем основного постулата химической кинетики. Закон действующих масс является справедливым только для простых реакций.
В случае же сложных реакций, протекающих через несколько стадий, когда общее стехиометрическое уравнение не отражает действительного хода реакции, показатели степени в уравнении скорости реакции не будут соответствовать стехиометрическим коэффициентам.
Следует подчеркнуть, что величины m и n определяются только экспериментальным путем, так как для подавляющего большинства реакций порядки реакции по веществу не равнозначны стехиометрическим коэффициентам. Например, рассмотрим реакцию
А + В С + Д
Б ольшой
избыток
ольшой
избыток
При большом избытке вещества В изменением его концентрации можно пренебречь, тогда скорость реакции определяется только концентрацией вещества А. И порядок реакции определяется по веществу А следующим образом: [A] V
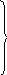 2[A]
4V
m = 2
2[A]
4V
m = 2
3[A] 9V
4[A] 16V
Аналогично, порядок реакции по веществу В определяется при большом избытке вещества А:
А + В
С + Д
+ В
С + Д
Большой избыток
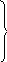 [В]
V
[В]
V
2[В] 2V n = 1
3[В] 3V
4[В]
4V![]()
Vмгн.
= k [A]2
[B]1
![]()
Порядок реакции играет существенную роль при изучении механизма реакции. Он в значительной степени зависит от механизма процесса. Поэтому факторы, влияющие на механизм процесса (температура, катализатор, концентрация веществ), могут влиять и на величину порядка реакции. Как было уже указано, порядок реакции определяется опытным путем и его нельзя предсказать заранее.
Порядок реакций – величина формальная. Он может быть положительным или отрицательным, целым или дробным, а также нулевым числом.
Классификация реакций по порядку
Множитель k в уравнении (6), показывающий, с какой скоростью идет химический процесс при концентрациях реагирующих веществ, равных 1 моль/л, называется константой скорости химического процесса. Она не зависит от концентрации и характеризует влияние природы реагирующих веществ на скорость их взаимодействия друг с другом. Из этого следует, что константа скорости реакции является мерой реакционной способности молекул.
Размерности констант скорости реакции различного порядка легко получить из выражения для скорости реакции:
нулевой
порядок V =
![]() =
k0,
где k0
= [C]
[t]–1
=
k0,
где k0
= [C]
[t]–1
![]()
![]() (7)
(7)
первый
порядок V =
![]() =
k1C,
где k1
= [t]–1
=
k1C,
где k1
= [t]–1
![]() (8)
(8)
второй
порядок V =
![]() =
k2C2,
где k2
= [C]–1
[t]–1
=
k2C2,
где k2
= [C]–1
[t]–1
![]() (9)
(9)
Константы скорости
реакций разных порядков имеют разные
размерности, и поэтому их сравнение не
имеет смысла. Скорости же реакций разного
порядка имеют одну и ту же размерность,
а поэтому их можно сопоставить.
![]()
![]()
![]()
