
- •7. Элементы релятивистской механики Лекция № 12
- •7.6. Импульс в релятивистской механике
- •7.7. Релятивистские законы Ньютона
- •7.8. Энергия релятивистской частицы. Закон взаимосвязи массы и энергии
- •7.9. Связь между энергией и импульсом частицы
- •8. Элементы квантовой механики Лекция № 13
- •8.1. Корпускулярно-волновой дуализм материи.
- •8.2. Волновые свойства микрочастиц. Опыт Дэвиссона и Джермера
- •8.3. Волновая функция и ее статистический смысл
- •8.4. Уравнение Шредингера
- •Лекция № 14
- •8.6. Волновая функция свободной частицы
- •8.7. Соотношение неопределенностей
- •8.8. Уровни энергии и волновая функция частицы, находящейся в прямоугольной потенциальной яме
- •9.1. Основное уравнение молекулярно-кинетической теории идеального газа
- •9.2. Внутренние степени свободы молекул
- •9.3. Закон распределения энергии молекулы по степеням свободы
- •9.4. Внутренняя энергия идеального газа
- •10. Статистические распределения в молекулярной физике Лекция №16
- •10.1. Понятие статистического распределения, функция распределения. Распределение Максвелла молекул газа по скоростям
- •10.2. Барометрическая формула
- •10.3. Распределение молекул идеального газа во внешнем силовом поле
- •11. Явления переноса Лекция № 17
- •11.1. Явления переноса: диффузия, теплопроводность, внутреннее трение
- •11.2. Длина свободного пробега и среднее число столкновений молекул идеального газа
- •11.3. Коэффициенты переноса для идеального газа
- •12. Основы термодинамики Лекция № 18
- •12.1. Теплота и работа. Первое начало термодинамики
- •12.2. Теплоемкость тела и вещества
- •12.3. Первое начало термодинамики при изохорическом, изобарическом и изотермическом процессах.
- •12.4. Адиабатический процесс. Уравнение Пуассона
- •12.5. Политропические процессы
- •Лекция № 19
- •12.6. Второе начало термодинамики
- •12.7. Обратимые и необратимые термодинамические процессы. Круговой процесс
- •12.8. Тепловые и холодильные машины
- •12.9. Идеальная тепловая машина Карно и ее кпд
- •Лекция № 20
- •12.10. Понятие об энтропии. Статистическое истолкование второго начала термодинамики. Энтропия идеального газа
- •12.11. Третье начало термодинамики
- •Реальные газы и жидкости Лекция № 21
- •13.1. Уравнение Ван-дер-Ваальса. Изотермы газа Ван-дер-Ваальса.
- •13.2. Экспериментальные изотермы реального газа
- •13.3. Критические параметры и их связь с поправками Ван-дер-Ваальса
- •Лекция № 22
- •13.4. Внутренняя энергия реального газа
- •13.5. Эффект Джоуля − Томпсона
Лекция № 20
12.10. Понятие об энтропии. Энтропия идеального газа. Статистическое истолкование второго начала термодинамики.
12.11. Третье начало термодинамики.
12.10. Понятие об энтропии. Статистическое истолкование второго начала термодинамики. Энтропия идеального газа
Кроме внутренней энергии U, которая является однозначной функцией параметров состояния системы T и V, в термодинамике широко используются и другие функции состояния (свободная энергия, энтальпия, энтропия и т. д.). Энтропия (от греч. entropia − поворот, превращение) как функция состояния выделяется среди других термодинамических функций тем, что имеет статистическую, т. е. вероятностную, природу.
В термодинамике понятие энтропия вводится с помощью приведенного количества теплоты Q*. В изотермическом процессе
Q* = Q/T. (12.10.1)
Если температура не постоянна (Т const), то произвольный процесс нужно разбить на бесконечно малые участки, где температуру можно считать постоянно, и ввести элементарное приведенное количество теплоты
Q* = Q/Т. (12.10.2)
Приведенная теплота на конечном участке 1−2 этого процесса будет определяться интегралом:
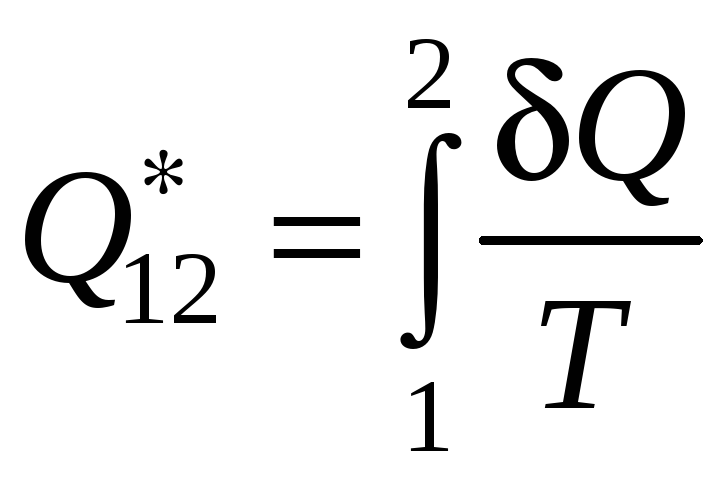 .
(12.10.3)
.
(12.10.3)
В качестве примера рассчитаем приведенную теплоту для идеального цикла Карно (рис. 12.9.1):
 .
(12.10.4)
.
(12.10.4)
Здесь учтено, что на изотермических участках 1−2 и 3−4 температура Т постоянна и равна Т1 и T2 соответственно, а в адиабатических процессах 2−3 и 4−1 величина Q = 0. Поскольку
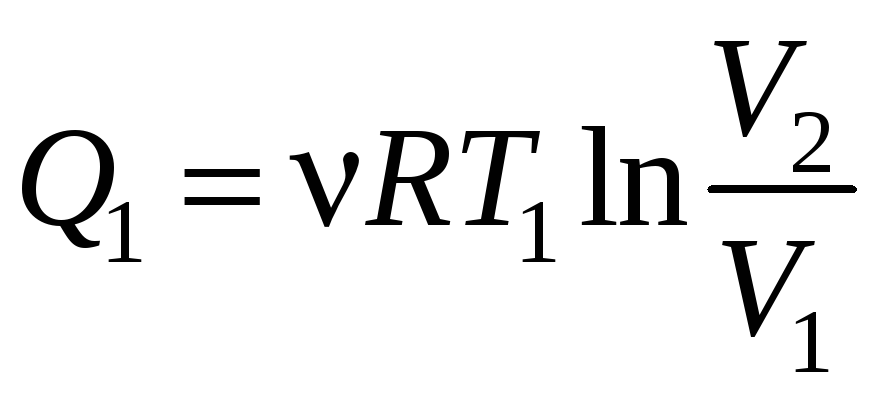

и
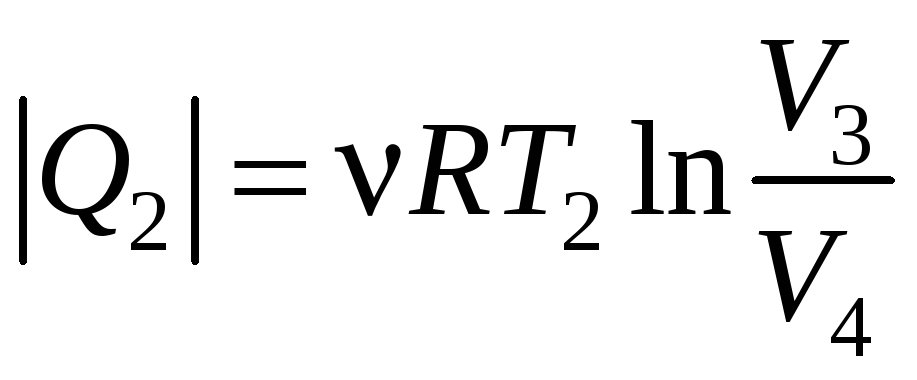
 .
(12.10.5)
.
(12.10.5)
Так как
 ,
то
приведенное количество теплоты Q*
=
= 0
цикла
равно нулю. Оказывается, что этот
результат является
общим свойством
приведенной теплоты для любого
обратимого
цикла:
,
то
приведенное количество теплоты Q*
=
= 0
цикла
равно нулю. Оказывается, что этот
результат является
общим свойством
приведенной теплоты для любого
обратимого
цикла:
![]()
 .
(12.10.6)
.
(12.10.6)
Отсюда следует, что подынтегральное выражение (Q/T)o6p является полным дифференциалом некоторой функции S, которую называют энтропией. Таким образом, для обратимого процесса изменение энтропии определяется выражениями
dS
=
![]()
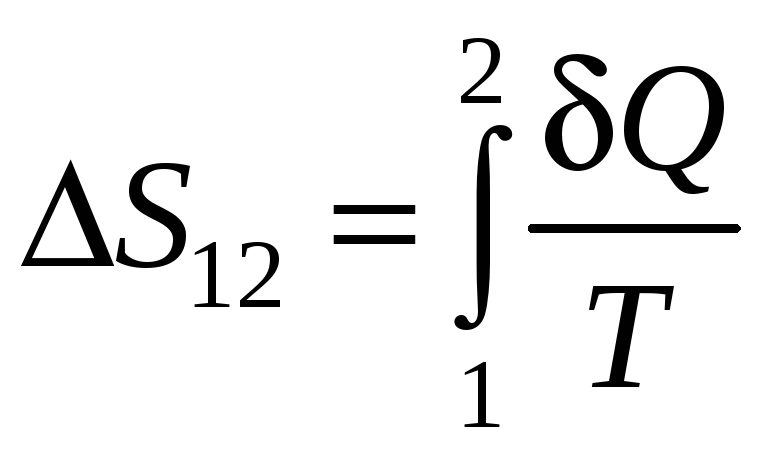 .
(12.10.7)
.
(12.10.7)
Энтропия как функция состояния системы обладает уникальным свойством: энтропия замкнутой системы при любых происходящих в ней процессах не может убывать. Она остается постоянной в обратимых процессах и возрастает в необратимых. Следовательно, имеет место закон возрастания энтропии:
S 0. (12.10.8)
− статистическая формулировка второго начала термодинамики.
Большинство явлений в природе сопровождается необратимыми процессами, поэтому все самопроизвольные процессы имеют такую направленность, при которой энтропия замкнутой системы возрастает и стремится к своему максимально возможному значению, соответствующему равновесному состоянию. Необратимый характер процессов связан с переходом от состояний менее вероятных к состояниям более вероятным. Поэтому энтропия, определяющая направление протекания необратимых процессов, должна быть связана с вероятностью. Больцман показал, что энтропия S пропорциональна логарифму вероятности состояния:
S = k lnW, (12.10.9)
где k – постоянная Больцмана; W – вероятность данного состояния.
Изменение энтропии идеального газа
Найдем изменение энтропии идеального газа при любом произвольном процессе

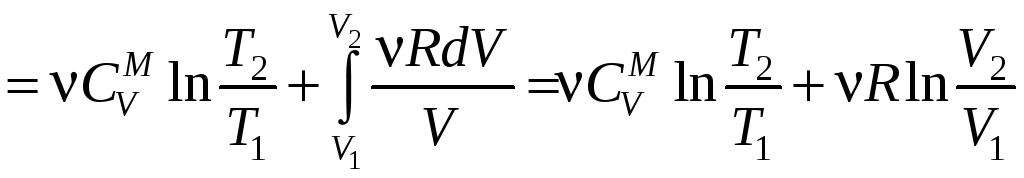 .
(12.10.10)
.
(12.10.10)
Изменение энтропия при нагревании тела
Найдем изменение энтропии тела при нагревании от температуры Т1 до Т2:
 .
(12.10.11)
.
(12.10.11)
Изменение энтропия при плавлении и парообразовании:
Найдем изменение энтропии тела при плавлении и парообразовании:
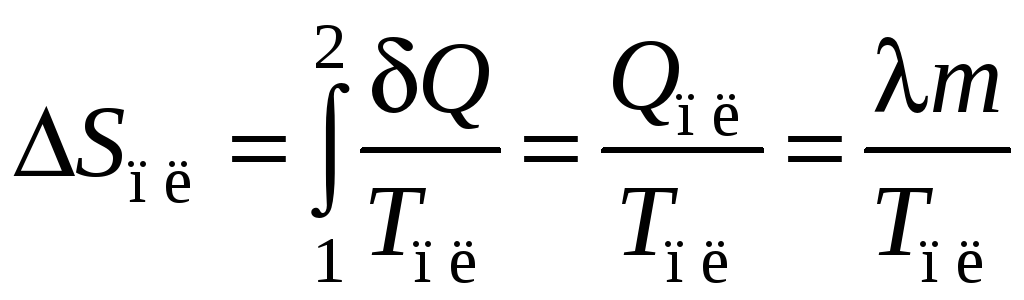 и
и
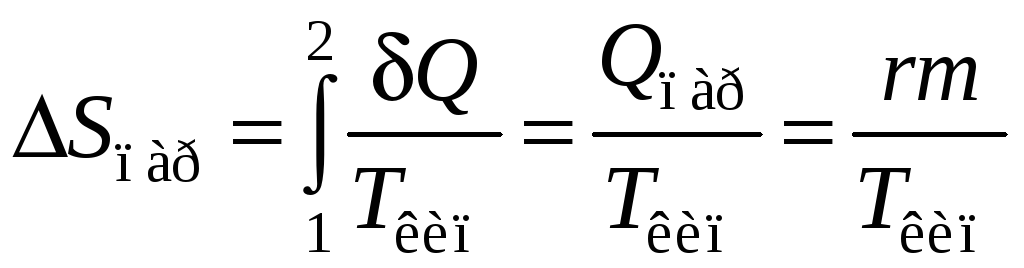 .
(12.10.12)
.
(12.10.12)
где
![]() ‑ удельная теплота плавления;
‑ удельная теплота плавления;
![]() ‑ температура плавления;
‑ температура плавления;
![]() ‑ удельная теплота парообразования;
‑ удельная теплота парообразования;
![]() ‑ температура кипения.
‑ температура кипения.
