
Кислоты
Кислотами называются сложные вещества, диссоциирующие в водных растворах с образованием гидратированных катионов водорода:
НСl + Н2О = Н3О+ + Сl-
НNО3 + Н2О = Н3О+ + NО-3
По своему составу кислоты делятся на бескислородные (НСl, Н2S, НСN, HI и др.) и кислородные (H2SО4, НNО3, H3PO4, H2SiO3 и др.)
Для названия кислот обычно используются русская номенклатура согласно которой названия бескислородных кислот производится от названия неметалла с прибавлением суффикса «исто» (реже «о») и слова водородная:
Н2S – сероводородная кислота;
НСl – хлористоводородная кислота;
НСN – цианистоводородная кислота.
В случае кислородосодержащих кислот их названия зависят от степени окисления элемента – кислотообразователя. Если элемент проявляет свою высшую степень окисления, то к его названию прибавляют окончание «ная» или «овая», например:
H2S6+О4 – серная кислота;
Н2W6+О4 – вольфрамовая кислота;
HMn7+O4 – марганцовая кислота;
HN5+O3 – азотная кислота.
Для кислот с более низкой степенью окисления к названию кислотообразователя добавляется окончание «истая».
H2S4+О3 – сернистая кислота;
HN3+O2 – азотистая кислота;
H2P3+O3 – фосфористая кислота.
При проявлении элементом еще более низкой степени окисления к его названию прибавляется окончание «оватистая»:
HBr1+O – бромноватистая кислота;
H3P1+O2 – фосфорноватистая кислота.
Наконец, для кислот, в которых кислотообразующий элемент проявляет промежуточную степень окисления по сравнению с соответствующими кислотами, имеющими названия с окончанием «ная» и «истая», к его названию добавляется окончание «оватая». Так четыре кислоты, которые могут образовать хлор в зависимости от проявляемой им степени окисления можно назвать так:
НСl1+О – хлорноватистая кислота;
НСl3+О2 – хлористая;
НСl5+О3 – хлорноватая кислота;
НСl7+О4 – хлорная кислота.
Название кислоты определяется и числом молекул воды, присоединенных к молекуле ангидрида кислоты. В этом случае перед названием наименее гидратированной формы кислоты ставится приставка – «мета», а перед названием более гидратированной кислоты приставка «орто». Так, при взаимодействии фосфорного ангидрида с водой могут быть получены мета - и ортофосфорные кислоты:
HPO3 – метафосфорная кислота;
H3PO4 – ортофосфорная кислота.
Кислоты, молекулы которых содержат более одного кислотного остатка, называются поликислотами. Их можно рассматривать как продукты присоединения к кислородосодержащей кислоте ангидрида той же или другой кислоты. Так, при растворении хромового ангидрида в воде получается хромовая кислота:
CrO3 + H2O = H2CrO4
Чем концентрированнее водный раствор CrO3, тем более конденсированные кислоты он содержит:
H2CrO4 * CrO3 – дихромовая кислота H2Cr2O7
трихромовая кислота H2Cr3O10
тетрахромовая кислота H2Cr4O13.
Существуют и другие разновидности кислот. Так, кислоты, в или все атомы кислорода замещены серой, называются (H2S2O3), а кислоты, содержащие в своем составе «перекисную цепочку» - надкислотами (H2S2O8). первая кислота называется тиосерной, а вторая – надсерной кислотой.
Названия наиболее распространенных в практической деятельности человека кислот и соответствующих им солей предоставлены в таблице 1.
При составлении графических формул всех перечисленных выше видов кислот следует учитывать, что в молекулах кислородосодержащих кислот атомы водорода, способные замещаться атомами металлов, связаны с элементом – кислотообразователем через атом кислорода. В молекулах бескислородных кислот атом водорода связан непосредственно с атомами неметалла:
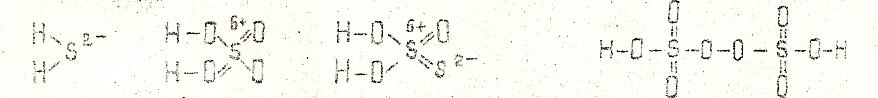
(H2S) (H2SO4) (H2S2O3) (H2S2O8)
Число атомов водорода, которые способны замещаться атомами металла, определяют основность кислот. Так,
НNО3, НСl, HI , НСlО4 – одноосновные
H2SiO3, H2CrO4, H2SO4 – двухосновные
Н3ВО3, H3PO4 – трехосновные кислоты.
У некоторых кислот их основность не совпадает с числом содержащихся в их молекулах атомов водорода. например, в фосфористой (H3PO4) кислоте основность равна двум, а в фосфорноватистой (H3PO2) – единице:
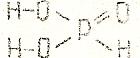

В первой кислоте два атома водорода (соединенные с атомами кислорода) способны замещаться на атомы металла, во второй только один.
Двух- и многоосновные кислоты диссоциируют ступенчато:
H3PO4
![]() Н+
+ H2PO-4
Н+
+ H2PO-4
H2PO-4
![]() Н+
+ HPO2-4
Н+
+ HPO2-4
HPO2-4
![]() Н+
+ PO3-4
Н+
+ PO3-4
В связи с этим валентность кислотного остатка (H2PO-4, HPO2-4, PO3-4) определяется количеством атомов водорода, посылаемых в раствор молекулой кислоты.
К важнейшим свойствам кислот относится их способность взаимодействовать с гидроксидами (реакция нейтрализации), основными и амфотерными оксидами с образованием солей:
3НСl + Fe (OH)3 = FeCl3 + 3H2O
H2SO4 + CuO = CuSO4 + H2O
6HCl + Al2O3 = 2AlCl3 + 3H2O
Помимо этого кислоты взаимодействуют с металлами. В зависимости от активности металла (его положения в ряду напряжений металлов) и природы кислоты в результате таких реакций выделяется либо водород, либо продукты восстановления окисляющей кислоты:
Zn
+ H2SO4
(разб)
= ZnSO4
+ H2
Mn
+ 2HCl = MnCl2
+ H2
Cu0 + H2SO4 (конц) = Cu2+SO4 + S4+O2 +2H2O
3CuO
+ 8HN5+O3
= Cu (NO3)2
+ 2N2+O
 +
4H2O
+
4H2O
Водные растворы кислот имеют кислый вкус и окрашивают индикаторы: лакмус в красный, метилоранж – в розовый цвет. Фенолфталеин в кислой среде не меняет окраски.
