
Тушение местных загораний и горящей одежды
-
При возникновении пожара немедленно выключить электроприборы. Уберите подальше от огня все горючие вещества и склянки с горючими жидкостями. Спокойно и быстро засыпайте очаг пожара песком.
-
Нельзя заливать водой загоревшийся эфир, бензол, бензин, металлический натрий – во всех этих случаях тушите пламя песком.
-
Большие очаги пожара ликвидируйте с помощью огнетушителей.
-
в случае загорания одежды не следует бегать по комнате. Надо немедленно набросить на себя Асбестовое одеяло (халат, пальто), чтобы прекратить доступ к загоревшей одежде. Тушите пламя водой из душа или шланга, присоединенного к водопроводному крану. Не допускайте растерянности и суеты при тушении одежды.
Порядок выполнения студентами экспериментальных работ
-
Перед началом выполнения каждой работы студент сдает коллоквиум преподавателю. После коллоквиума студент производит необходимые расчеты, собирает прибор (установку) и приступает к эксперименту.
-
Перед выполнением экспериментальной работы до занятия необходимо:
-
записать в рабочем журнале порядковый номер работы, название работы, дату, краткое описание теории процесса;
-
записать уравнения проводимых реакций, необходимые расчеты и зарисовать установку (электрическую схему).
-
Отчет должен содержать перечисленные в пункте 2 разделы и личные наблюдения с кратким обсуждением полученных результатов.
-
По окончании экспериментальной работы полученные результаты представляются преподавателю. После обсуждения результатов работы и в случае признания их удовлетворительными, работа принимается преподавателем.
Сборка приборов, нагревание, охлаждение,
взвешивание, перегонка
Сборка приборов для проведения синтеза производится очень тщательно, так как от этого зависит успех работы.
Пробка, соединяющая колбу или другую часть прибора с другими приборами (холодильник, термометр, газоотводные трубки и т.п.) должны быть хорошо подогнана и должна входить не менее чем на одну треть и не больше чем на две трети длины пробки. Чтобы трубки или другие части приборов легко входили в отверстия пробок или резиновых трубок их необходимо слегка смазать глицерином (при этом глицерин не должен попадать на внутренние стенки трубки).
Когда вставляется трубка или термометр, необходимо держать пальцы возможно ближе к тому концу, который вставляется в пробирку, в противном случае легко сломать трубку или термометр и сильно порезать руки.
При неполных соединениях возможна потеря веществ, что приводит зачастую к неверным результатам эксперимента.
При нагревании веществ в пробирках необходимо постоянно вращать пробирку в пламени горелки. Несоблюдение этого правила приводит к растрескиванию пробирки или неравномерному кипению и выбросу вещества. Часто при проведении экзотермических реакций в результате выделения тепла может произойти перегрев реакционной смеси, связанный или с потерей летучих веществ или с разложением соединения. В таких случаях применяют охлаждение.
Самое простое охлаждение – это периодическое погружение реакционного сосуда в холодную воду, а в некоторых случаях прибегают к охлаждению снегом.
Взвешивание необходимых количеств веществ, производится либо на технических лабораторных весах, либо для особо точных измерений, на электрических демпферных весах. При работе на технических весах нужно соблюдать следующие правила:
-
Установит весы на ровную поверхность и вращением ручек, регулирующих высоту ножек весов, установить строго горизонтальное положение по отвесу.
-
ставить взвешиваемый предмет и разновесы необходимо при закрытых весах. Гирьки разновесов брать только пинцетом.
К работе на электрических демпферных весах допускается студенты, изучившие инструкцию пользования весами, после разрешения преподавателя.
Процесс перегонки занимает важное место среди многочисленных методов очистки и выделения веществ.
Целью перегонки является разделение на компоненты смеси жидкостей, имеющих различные температуры кипения.
Перегонка (дистилляция) представляет собой процесс, при котором вещества, входящие в состав смеси, переводятся путем нагревания в парообразное состояние: гары конденсируются в холодильнике и жидкий дистиллят поступает в приемник.
Сущность перегонки состоит в том, что жидкость закипает, когда давление насыщенного пара становится равным внешнему виду давлению. При постоянном давлении температура жидкости больше не повышается.
температура кипения вещества – это температура, при которой давление насыщенного пара жидкости равно внешнему давлению.
Наиболее простым случаем перегонки является перегонка при атмосферном давлении. Для простой перегон обычно используют прибор, состоящий из колбы Вюрца (или круглодонной колбы с насадкой Вюрца), температура, водяного холодильника, аллонжа и приемников. Схема прибора приведена на рисунке 1.
За температурой кипения следят по термометру, вставленному в шейку колбы с таким расчетом, чтобы ртутный шарик термометра находился на 4-5 мм ниже отводной трубки. Размер колбы должен быть таким, чтобы перегоняемая жидкость занимала от половины до двух третей объема перегонной колбы. Чтобы жидкость кипела равномерно (не возникало толчков при кипении из-за перегрева), перед началом перегонки в перегоняемую жидкость бросают «кипятильники» - маленькие кусочки пористого материала (кусочки обожженной глины, кирпичик или запаянный с одного конца капилляр). «Кипятильники» вносят только в холодную жидкость. При внесении «кипятильников» в горячую жидкость происходит бурное вскипание и перегоняемую жидкость может выбросить из колбы.
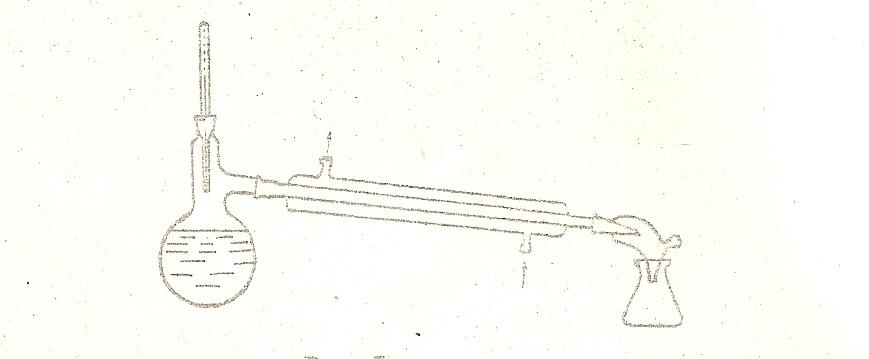
Рис.1
Зажимать части прибора для перегонки надо не сильно, так как при нагревании происходит расширение, что может привести к поломке прибора.
Если перегонке подвергают чистое вещество, то показания термометра остаются неизменными. Так, вода перегоняется при 100, этиловый спирт при 78,3 и ацетон при 56С.
Практически чистыми веществами являются вещества, перегоняющиеся в интервале 1-2С. Не следует перегревать вещество при перегонке, так как при этом температура паров будет повышаться на 2-3, что не даст возможности отобрать нужную фракцию. Скорость перегонки должна быть в среднем 1-2капли в секунду, конденсата, поступающего в приемник. Простая перегонка с помощью колбы Вюрца позволяет отделить лишь такие вещества, температура кипения которых значительно отличаются друг от друга (обычно не менее чем на 20С).
Поскольку при перегонке смеси веществ температура кипения постоянно повышается, используют фракционную перегонку. Для этого отбирают фракцию, обогащенную низкокипящим веществом, как и первую и обогащенную высококипящим веществом, как последнюю. Средняя, промежуточная, фракция состоит из смеси обоих веществ; её ещё несколько раз разделяют на низко- и высококипящие фракции, а затем проводят повторную перегонку низкокипящей и высококипящей фракций. Такая перегонка называется фракционной перегонкой.
ЛАБОРАТОРНАЯ РАБОТА
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Целью работы является ознакомление студентов с номенклатурой неорганических соединений и изучение способов получения и свойств оксидов, гидроксидов, кислот и солей.
Программа коллоквиума
Классификация неорганических соединений. Оксиды, получение, номенклатура, свойства. Основные, кислотные и амфотерные оксиды. Солеобразные оксиды, пероксиды. Графические формулы оксидов.
Гидроксиды, получение, классификация, свойства. Амфотерные гидроксиды. Графические формулы гидроксидов.
Кислоты, номенклатура, получение, свойства. Графические формулы кислот.
Соли, классификация. Средние соли, номенклатура, способы получения, свойства.
Кислые соли, номенклатура, свойства, получение.
Основные соли, способы получения, свойства, номенклатура.
Двойные и смешанные соли, галогенангидриды, карбиды, нитриды, силициды, бориды.
Графические формулы средних, основных и кислых солей.
К основным классам неорганических соединений относятся: оксиды, гидроксиды, кислоты, соли.
ОКСИДЫ
Оксидами называются сложные вещества, молекулы которых состоят из двух элементов, один из которых кислород: CuO, SO2, P2O5. Согласно современной международной номенклатуре название этих соединений складывается из термина «оксид» и названия элемента в родительном падеже с указанием римскими цифрами его степени окисления.
CuO – оксид меди (II), (оксид меди);
Cu2O – оксид меди (I), (закись меди);
P2O5 – оксид фосфора (V), (фосфорный ангидрид);
SO2 – оксид серы (IV), (двуокись серы).
В скобках приведены старые тривиальные русские названия оксидов.
Оксиды могут быть получены:
-
Непосредственным соединением элементов с кислородом:
S + O2 = SO2
2Mg + O2 = 2MgO
-
Термическим разложением кислот, гидроксидов, солей:
H2SiO3
 SiO2
+
H2O
SiO2
+
H2O
Zn(OH)2
 ZnO + H2O
ZnO + H2O
-
Обжигом руд и в других окислительно-восстановительных реакциях:
4 Fe2S + 11O2 = 2 Fe2O3 + 8 SO2
Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O
По своим химическим свойствам оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды (индифферентные, безразличные) ни прямым, ни косвенным путем не образуют ни солей, ни гидроксидов, ни кислот. К ним относятся N2O3 – оксид азота (I), NO- оксид азота (II), СО – оксид углерода (II) и др.
Название – солеобразующие – определяет суть оксидов, их способность образовывать соли. В зависимости от проявляемых химических свойств, эти оксиды делятся на основные, кислотные и амфотерные.
Основными оксидами называются те оксиды, которым соответствуют гидратные соединения – гидроксиды. Это оксиды металлов в их низших степенях окисления.
Например, оксиду свинца (II), соответствует гидроксид свинца (II) Pb(OH)2, оксиду натрия (I) – гидроксид натрия NаОН. Образование гидроксидов из оксидов металлов может происходить прямым или косвенным путем.
Nа2О + Н2О = 2 NаОН
Взаимодействуя с кислотами или с кислотными оксидами, основные оксиды образуют соли, например:
СаО + СО2 = СаСо3
СаО + 2HCl = CaCl2 + H2O
Кислотными оксидами называются оксиды, которым соответствуют гидратные соединения – кислоты. Это оксиды неметаллов и некоторых металлов, проявляющих высшую степень окисления. Например, оксиду серы (VI) SO3 соответствует серная кислота H2SO4, оксиду хрома (VI) CrO3 – хромовая кислота Н2CrO4.
Русское название кислотных оксидов – ангидриды, так как их можно рассматривать как продукты отнятия воды от кислот:
CrO3 – хромовый ангидрид;
SO3 – серный ангидрид.
Большинство кислотных оксидов образуют соответствующие им кислоты при непосредственном взаимодействии с водой, например:
Mn2O7 + H2O = 2HMnO4
N2O5 + H2O = 2HNO3
Гидраты других кислотных оксидов (SiO2, WO3) могут быть получены лишь косвенным путем, исходя из их солей.
Характерными свойствами кислотных оксидов являются их взаимодействие:
а) с основными оксидами: BaO + SO3 = BaSO4
б) с гидроксидами Ca(OH)2 + CO2 = CaCO3
Амфотерными оксидами называются такие оксиды, которые характеризуются двойственностью свойств, то есть в зависимости от условий проявляют и основные и кислотные свойства. Такие оксиды (ZnO, SnO2, PbO2, MnO2, Cr2O3, Al2O3, и др.) могут взаимодействовать как с кислотами, так и с основаниями, образуя при этом соли. Например, оксид цинка в реакции ZnO + Н2SO4 = Zn SO4 + Н2О проявляет свойства основного оксида, а в реакции ZnO + 2КОН = К2 ZnO2 + Н2О свойства кислотного оксида.
Кислотные и основные свойства амфотерных оксидов могут быть выражены не равнозначно. Так, у оксида свинца (IV) PbO2 преобладают кислотные свойства, у оксида железа (III) – основные, а у оксидов ZnO, Al2O3 и те, и другие свойства выражены одинаково.
К особым группам оксидов следует отнести солеобразные оксиды и пероксиды (перекиси). Первые по своим свойствам и строению могут быть причислены к солям. Например, смешанный оксид железа Fe3O4 (FeO * Fe2O3) следует рассматривать как феррит железа: соль Fe2+ и железистой кислоты (НFeO2). В связи с этим формула такого оксида может быть записана так: Fe2+(Fe3+O2)2. Кроме Fe3O4 солеобразными оксидами являются Pb2O3(Pb2+ Pb4+О3), Pb3O4(Pb22+ Pb4+О4), Mn3O4(Mn2+Mn4+O4) и др.
Пероксиды или перекиси лишь формально (по составу) можно отнести к классу оксидов, по существу же они являются солями двухосновной кислоты пероксида водорода (перекиси водорода) Н2О2: Nа2О2 – пероксид натрия, ВаО2 – пероксид бария , ZnO2 – пероксид цинка.
В пероксидах атомы кислорода соединяются между собой, образуя так называемый «кислородный мостик» – О – О –. Отличие пероксидов от остальных оксидов наглядно иллюстрируется графическими формулами, в которых каждая черточка соответствует валентности элемента:
Nа2О – оксид натрия (I) Nа – О – Nа
Nа2О2 – пероксид натрия Nа – О – О – Nа
ВаО – оксид бария (II) Ва=О
ВаО2
–
пероксид бария ![]()
Cr2O5
– пероксид хрома 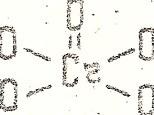
Cr2O3
– оксид хрома (VI) ![]()
Пероксиды образуют преимущественно щелочные и щелочноземельные металлы при непосредственном окислении их кислородом. В чистом виде пероксиды бесцветны, активно взаимодействуют с влагой, углекислым газом воздуха и поэтому их хранят в герметически закрытой таре.
