
- •П.Ф.Турчин
- •Опис предмета навчальної дисципліни „фізична та колоїдна хімія”
- •Іі. Розподіл балів, що присвоюються студентам
- •2.1. Таблиця розподілу балів, що присвоюються студентам
- •2.2. Шкала оцінювання в кмсонп та еcts
- •Ііі. Програма навчальної дисципліни
- •IV. Програмний матеріал блоків змістових модулів Блок 1. „Фізична хімія”
- •Блок 2. „Колоїдна хімія”
- •V. Методичні рекомендації до вивчення окремих модулів та тем дисципліни
- •Змістовий модуль 1 фізична хімія
- •Тема 1. Основи хімічної термодинаміки та практичне застосування її положень в хіміко-технологічних розрахунках
- •При врахуванні фазових перетворень застосовують рівняння у такому вигляді:
- •Запитання для самоконтролю
- •Тема 2. Розчини. Термодинаміка розчинів
- •Параметри системи при змішуванні розчинів
- •Запитання для самоконтролю
- •Тема 3. Хімічна кінетика
- •Кут нахилу її дорівнює:
- •Запитання для самоконтролю
- •Тема 4. Фазові рівноваги
- •Запитання для самоконтролю
- •Змістовий модуль 2 колоїдна хімія
- •Тема 5. Фізико-хімія поверхневих явищ. Адсорбція
- •Запитання для самоконтролю
- •Тема 6. Фізико-хімія дисперсних систем та розчинів високомолекулярних сполук
- •Запитання для самоконтролю
- •VI. Теми лабораторних робіт
- •Vіі. Контрольна тестова програма Тести поточного контролю Блок 1. „Фізична хімія”
- •1. Що є термодинамічною системою:
- •2. Який зв’язок встановлює перший закон термодинаміки?
- •3. Яка з наведених діаграм ілюструє зв’язок між основними термодинамічними функціями?
- •4. Який розчин є насичений?
- •5. В чому полягає сольовий ефект?
- •6. За якими рівняннями розраховують йонну силу розчину електроліту, що містить катіони і аніони?
- •7. За якими рівняннями на практиці визначають порядок реакції, користуючись методом Вант-Гоффа?
- •8. На які стадії поділяється кінетична дія ферментів?
- •9. Яке з наведених рівнянь відповідає рівнянню швидкості ферментативного процеса Міхаєліса і Ментена?
- •10. Який з наведених графіків використовують для визначення конкретного типу гальмування ферментативної реакції?
- •11. Яка складова частина системи називається незалежним компонентом?
- •12. Якій з наведених схем відповідає монотропне перетворення?
- •13. Як змінюється відносний вміст водяної пари у приземному шарі повітря в різних місцевостях і в різний час у холодному сухому повітрі і у теплому вологому повітрі?
- •14. У якому випадку формулювання відповідає першому закону Коновалова?
- •15. Що стверджує другий закон Коновалова?
- •Блок 2. „Колоїдна хімія”
- •Тести підсумкового контролю
- •VIII. Контрольні вправи і завдання
- •5. Розрахуйте товщину дифузного йонного шару на поверхні твердої пластинки, яка занурена у водний розчин 1 . 10-5 м kCl. Відносна діелектрична проникність розчину при 250 с дорівнює 78,5.
- •7. Розрахуйте об’ємну частку дисперсної фази розчину латексу з концентрацією 0,5 г/л і густиною 0,965 г/см3.
- •Іх. Тематика самостійної та індивідуальної роботи
- •Х. Термінологічний словник
- •Хі. Рекомендована література
- •Хіі. Методичне забезпечення
- •Турчин Петро Феофанович
- •Фізична та колоїдна хімія
- •Інтерактивний комплекс
- •Навчально-методичного забезпечення
- •Друкується в авторській редакції
Блок 2. „Колоїдна хімія”
Тема 5. Фізико-хімія поверхневих явищ. Адсорбція
Поверхневі явища і їх значення. Дисперсність. Питома поверхня і вільна поверхнева енергія. Когезія та адгезія. Змочування та розтікання. Капілярність. Адсорбція. Адсорбція на межі поділу рідина-газ. Адсорбція на межі поділу тверде тіло-газ. Адсорбція на межі поділу конденсованих фаз. Полімолекулярна адсорбція. Теорія БЕТ. Поверхневі явища на межі поділу тверде тіло-рідина.
Тема 6. Фізико-хімія дисперсних систем та розчинів високомолекулярних сполук
Основи термодинаміки дисперсних систем. Колоїдно-дисперсні системи. Класифікація дисперсних систем. Високомолекулярні сполуки та їх властивості. Синтетичні і природні ВМС. Будова ВМС. Властивості розчинів ВМС. Добування і властивості дисперсних систем і розчинів ВМС. Будова міцел. Електрокінетичні явища. Оптичні властивості дисперсних систем і розчинів ВМС. Стійкість дисперсних систем та розчинів ВМС. Коагуляція під дією електролітів. Теорія стійкості і коагуляції дисперсних систем. Кінетика коагуляції. Стійкість розчинів ВМС. Грубодисперсні системи. Піни. Емульсії. Драглі. Аерозолі. Колоїдні ПАР.
V. Методичні рекомендації до вивчення окремих модулів та тем дисципліни
Рекомендації до вивчення курсу за темами.
Вивчення курсу рекомендується по темах в такій послідовності:
1. Ознайомитись з вимогами програми з теми, яка вивчається.
2. Прочитати всі розділи посібника і підручників, що стосуються даної теми. При першому читанні не слід особливо затримуватись на математичних і хімічних формулах, рівняннях реакцій, намагаючись лише одержати загальне уявлення про викладені питання, а також відмітити особливо неясні місця.
3. Перейти до детального вивчення матеріалу, засвоїти теоретичні положення, математичні залежності, складання рівнянь реакцій.
Щоб полегшити собі запам’ятовування і засвоєння матеріалу, корисно завести робочий зошит і записувати формулювання законів і основних понять хімії, нові незнайомі терміни, назви, формули та рівняння реакцій одержання тих чи інших сполук тощо.
4. Засвоївши таким способом матеріал теми необхідно дати відповіді на тести для самоконтролю.
Змістовий модуль 1 фізична хімія
Тема 1. Основи хімічної термодинаміки та практичне застосування її положень в хіміко-технологічних розрахунках
Термодинаміка вивчає макросистеми в яких, без проведення експериментів, існує принципова можливість визначення проходження того чи іншого процесу і його напрямку.
Розрізняють різні напрямки термодинаміки. В нашому випадку ми розглядаємо хімічну термодинаміку, яка вивчає застосування її основних законів стосовно до фізико-хімічних і хімічних явищ. До цих явищ відносяться хімічні реакції і фазові перетворення (розчинення, випаровування, кристалізація чистих речовин і розчинів і зворотні їм процеси), адсорбція і ін.
Найважливішими напрямками розвитку хімічної термодинаміки є вчення про хімічні і фазові рівноваги, вчення про розчини (особливо про розчини електролітів), термодинаміка поверхневих явищ і ін.
В основі хімічної термодинаміки лежать загальні положення і висновки (закони) термодинаміки.
Вивчення законів термодинаміки дає змогу використовуючи термодинамічний аналіз визначати напрям процесу і оптимальні умови ведення технологічного режиму, встановлювати межі раціонального вилучення цільових продуктів, забезпечувати вихід шкідливих речовин і забруднення навколишнього середовища, тощо.
Термодинамічною системою називається сукупність тіл, що енергетично взаємодіють між собою і іншими тілами, а також обмінюються між ними речовиною. Взаємодія системи із навколишнім середовищем супроводжується передачею теплоти і виконанням роботи. Робота витрачається на переборення зовнішніх сил, які порушують рівновагу системи, або відбувається обмін енергією.
Повна енергія термодинамічної системи поділяється на зовнішню і внутрішню. Внутрішня енергія системи складається з енергії всіх видів руху і взаємодії частинок (енергії поступального і обертового руху молекул, коливального руху атомів, енергії міжмолекулярної взаємодії, внутрішньоатомної і внутрішньоядерної енергії тощо). Зовнішня енергія включає енергію руху в цілому і потенціальну енергію системи. Для систем, які вивчаються, повна енергія дорівнює внутрішній енергії.
Абсолютну енергію внутрішньої системи визначити неможливо, тому для термодинамічного аналізу достатньо знати зміну внутрішньої енергії системи U. Коли система під дією сил виконує роботу це відповідає відємному значенню U, а коли процеси відбуваються без обміну енергії зі зовнішнім середовищем - додатному значенню U. Зміна внутрішньої енергії, віднесена до одного моля, є функцією системи, її вимірюють у Дж/моль.
Робота процесу А являє собою кількість енергії, що передається від одного тіла до іншого. Для елементарного процесу при сталому тиску (ізобарний процес), вираз для кількості роботи має вигляд P · V. Її вимірюють у Дж.
У термодинаміці вважають роботу, яку виконує система над зовнішнім середовищем (розширення газу, пароутворення, дисоціація, тощо) додатною (+A), а роботу, що виконується над системою (наприклад, стискання газу) - відємною (-А).
Якщо між системою і зовнішнім середовищем, відбувається порушення теплової рівноваги система поглинає або виділяє теплоту Q. Теплоту, яку система поглинає, вважають додатною (+Q), а теплоту, що виділяє система - відємною (-Q). Теплоту як і роботу вимірюють в Дж. В той же час в термодинаміці тепловий ефект екзотермічної хімічної реакції є відємним, а ендотермічної - додатнім.
Якщо термодинамічна система не дістає і не віддає теплоту, то такий процес називається адіабатичним.
Ентальпія. У термодинаміці поряд з внутрішньою енергією використовують функцію стану ентальпію H.
Ентальпія - це енергія системи при сталому тиску. Вона чисельно дорівнює сумі внутрішньої енергії і потенціальної енергії (P · V):
![]() (1.1)
(1.1)
Зміна ентальпії як і зміна внутрішньої енергії не залежать від шляху процесу, а залежать тільки від початкового та кінцевого стану.
Тому в термодинаміці оперують зміною ентальпії H як і U відносять до одного моля речовини і вимірюють у Дж/моль.
Тепловий ефект хімічної реакції, що відбувається при сталому тиску QP, дорівнює зменшенню ентальпії - H:
![]() (1.2)
(1.2)
Зміна ентальпії для речовин залежить від температури (рис.1.1).
|
Рис.1.1. Якісна характеристика залежності зміни ентальпії від температури |
Теплоємність - це кількість теплоти, яка потрібна для підвищення температури певної кількості речовини на один градус за відсутності фазового переходу і зміни її складу.
![]()
(істинна теплоємність при заданій температурі).
Середню
теплоємність
![]() визначають
з виразу:
визначають
з виразу:
![]() (1.3)
(1.3)
Розрізняють ізобарну теплоємність CP:
![]() (1.4)
(1.4)
і ізохорну теплоємність CV:
![]() (1.5)
(1.5)
Оскільки при ізохорному процесі вся теплота витрачається тільки на збільшення внутрішньої енергії системи, а при ізобарному ще й на роботу розширення, тому CP завжди більше CV. Отже для 1 моля ідеального газу зв'язок між CP і CV виражається залежністю:
![]() (1.6)
(1.6)
де R - універсальна газова стала.
За рівнянням Менделєєва-Клапейрона за нормальних умов
-
R = P0V0 / T0 = (101325 Па · 22,4 · 10–3 м3/моль ) / 273 К
8,31 Дж / ( моль· К) або 0,082 ( л · атм) / К
У розрахунках застосовують питому (розраховану на 1 г речовини) і молярну ( на 1 моль) теплоємності, які мають відповідно розмірності: Дж/(г · к) і Дж/ (моль · К).
Приблизну теплоємність речовин можна обчислити за правилом Дюлонга і Пті: добуток атомної маси елемента МА на його питому теплоємність С є сталою величиною.
МА · С = n · ( 25,9 – 26,8) Дж/(моль · К).
Наприклад, для сполуки Аl2O3, що складається з 5 атомів, теплоємність дорівнює:
С = ((25,9 + 26,8 ) : 2) · 5 = 132 Дж/(моль · К).
Виняток з цього правила становлять Бор, Карбон і Силіцій.
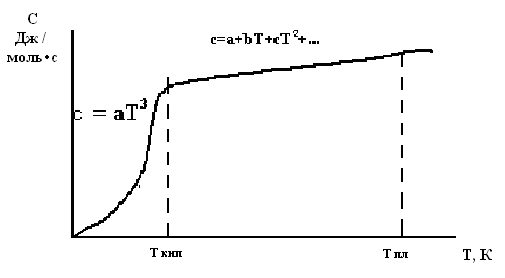
На величину теплоємності значною мірою впливає температура (рис.1.2).
|
|
|
Рис.1.2. Залежність теплоємності речовини від температури |
При низьких температурах (до кімнатної) ця залежність описується рівнянням Дебая:
, (1.7)
де a - коефіцієнт, що залежить від природи речовини.
Від кімнатної температури до температури плавлення теплоємність виражають у вигляді степеневих рядів:
![]() ,
(1.8)
,
(1.8)
![]() ,
(1.9)
,
(1.9)
де а, в, с..., а’, в’, с’.... – коефіцієнти, які визначають за експериментальними даними або за довідниками.
Перший закон термодинаміки. Згідно з Гельмгольцем, перший закон термодинаміки встановлює зв’язок між кількістю теплоти, що підводиться із зовнішнього середовища до системи Q, роботою, яку виконує система A, та зміною внутрішньої енергії U:
![]() (1.10)
(1.10)
Рівняння є математичним виразом першого закону термодинаміки, яке свідчить що підведена із зовнішнього середовища теплота витрачається на виконання роботи і на збільшення внутрішньої енергії системи.
Під час ізохорного процесу, коли об'єм системи сталий, тобто V = 0, робота розширення, яку виконує система, дорівнює нулю, тоді рівняння набуває вигляду:
![]() (1.11)
(1.11)
В цьому випадку вся теплота, яка надана системі, витрачається тільки на зміну її внутрішньої енергії.
При ізотермічному процесі (T = const) внутрішня енергія не змінюється і U = 0. Тоді рівняння буде мати вигляд:
![]() (1.12)
(1.12)
або
![]() (1.13)
(1.13)
тобто вся теплота, яка поглинається системою, перетворюється в роботу розширення. Для ізотермічного розширення 1 моля ідеального газу відповідатиме вираз:
![]() (1.14)
(1.14)
а при адіабатичному процесі
![]() (1.15)
(1.15)
або
![]()
Отже, зменшення внутрішньої енергії системи може виконувати роботу, а при стискуванні системи підвищується її температура і збільшується внутрішня енергія системи.
Оскільки при ізобарному процесі P = const
![]()
або
![]() (1.16)
(1.16)
де n - зміна числа молей газоподібних речовин, що приймають участь у процесі перетворення.
Теплова енергія перетворення системи при цьому дорівнює зміні ентальпії, тобто
![]() (1.17)
(1.17)
Теплові ефекти хімічних реакцій. Закон Гесса. Хімічні процеси завжди супроводжуються виділенням або поглинанням теплоти.
Кількість тепла, що виділяється чи поглинається при протіканні даної хімічної реакції, називається тепловим ефектом даної хімічної реакції. Так як більшість хімічних реакцій і практично всі біохімічні реакції протікають при постійному тиску, на основі першого закону термодинаміки теплові ефекти хімічних реакцій характеризуються зміною ентальпії.
Якщо для реакції утворення хлориду амоніаку зміна ентальпії від'ємна (екзотермічний процес) таке термохімічне рівняння має вигляд:
-
NH3 (Г) + HCl (Г) = NH4Cl (Г);
Н = - 176,89 кДж.
Для реакції утворення гідрогенхлориду (ендотермічний процес) реакція описується рівнянням:
|
½ Н2 (Г) + ½ Сl2 (Г) = НCl (Г); |
Н = 92,30 кДж. |
На величину теплових ефектів хімічних реакцій впливають наступні фактори: агрегатний стан реагуючих речовин, їх природа, кількість реагуючих речовин, умови проведення реакції (P = const, V = const).
Для
порівняння теплових ефектів їх приводять
до однакових умов. З цією метою введено
поняття стандартних ефектів, значення
яких вимірюють при T
= 298 K
і P
= 101,325 кПа. Стандартні
теплові ефекти
позначають
![]() .
.
Оскільки ентальпія залежить від стану речовин, то в термохімічних рівняннях обов'язково позначають їх стан: г - газ, т - тверде тіло, к - кристал тощо.
![]() відносять
до певної кількості речовини (до
1 моля). З термохімічними рівняннями
можна проводити всі операції, тобто
додавати і віднімати, множити або ділити
члени рівняння, міняти знаки і переводити
члени з однієї частини в другу.
відносять
до певної кількості речовини (до
1 моля). З термохімічними рівняннями
можна проводити всі операції, тобто
додавати і віднімати, множити або ділити
члени рівняння, міняти знаки і переводити
члени з однієї частини в другу.
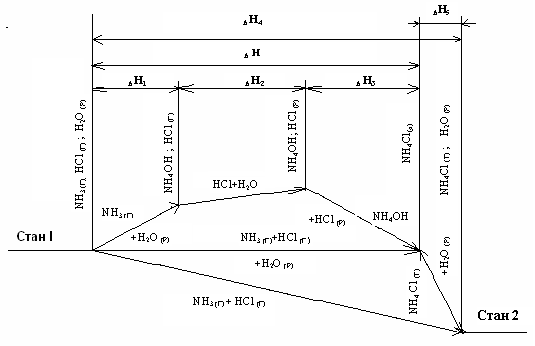
Для розрахунку теплових ефектів реакцій , які експериментально визначити немає можливості, застосовують закон Гесса: тепловий ефект процесу не залежить від шляхів переходу або проміжних стадій, а визначається лише початковим і кінцевим станами системи. Наприклад, водний розчин хлориду амоніаку може бути утворений з амоніаку, гідрогенхлориду і рідкої води за двома шляхами (рис.1.3).
|
|
|
Рис.1.3. Схема для розрахування теплового ефекту реакції за законом Гесса |
1)
![]()
2)
![]()
3)
![]()
4)
![]()
5)
![]()
Як видно з рис.1.3, на якому схематично представлені обидва процеси і показані відповідні теплові ефекти, сумарний тепловий ефект за I шляхом дорівнює – 90,77 кДж, а тепловий ефект другого процесу (II) складає – 90,74 кДж, тобто практично співпадають. Таким чином:
![]()
Закон
Гесса справедливий для ізохорних та
ізобарних процесів. На його основі
розраховують теплові ефекти більшості
біохімічних процесів (теплові ефекти
таких реакцій експериментально визначити
неможливо). Для таких підрахунків
використовують табличні дані теплот
утворення (![]() .)
і теплот згоряння (
.)
і теплот згоряння (![]() )
речовин.
)
речовин.
Теплота утворення хімічної сполуки – це кількість тепла, що поглинається або виділяється при утворенні одного моля цієї сполуки із простих речовин при стандартних умовах. Теплоту утворення простих речовин умовно приймають рівною нулю.
Якщо утворення сполук відбувається з виділенням тепла такі сполуки стійкі при звичайних умовах, а якщо речовини утворюються з поглинанням тепла – нестійкі.
Теплота згоряння хімічної речовини - це кількість тепла, що виділяється при згорянні одного моля даної речовини в чистому Оксигену (кисні) за даних умов (P, T), до вищих оксидів елементів, які входять до складу речовини.
Для виконання термохімічних розрахунків використовують наслідки із закону Гесса.
I – й наслідок. Тепловий ефект хімічної реакції рівний сумі теплот утворення продуктів реакції мінус сума теплот утворення вихідних речовин з врахуванням стехіометричних коефіцієнтів
![]() .
(1.18)
.
(1.18)
II – й наслідок. Тепловий ефект реакції рівний сумі теплот згоряння вихідних речовин мінус сума теплот згоряння продуктів реакції з врахуванням стехіометричних коефіцієнтів
![]() .
.![]() (1.19)
(1.19)
III – й наслідок. Тепловий ефект розкладу будь-якої речовини рівний за величиною і протилежний за знаком тепловому ефекту її утворення
![]() .
(1.20)
.
(1.20)
IV – й наслідок. Якщо здійснюються дві реакції, які приводять із різних початкових станів до однакових кінцевих, то різниця між тепловими ефектами першої і другої реакцій є тепловим ефектом переходу першого початкового стану в другий.
V – й наслідок. Якщо здійснювати дві реакції, які приводять із однакових початкових станів до різних кінцевих, то різниця між тепловим ефектом першої і другої реакцій є тепловим ефектом переходу другого кінцевого стану в перший.
Теплоти утворення більшості сполук отримують шляхом розрахунку за законом Гесса із інших термохімічних величин. Так, наприклад, теплота утворення бензену
|
6 С ( ГР.) + 3 Н2 ( Г) = С6 Н6 ( Р) ; |
H1 = ? |
може бути розрахована, якщо відомі теплоти згоряння бензену, Карбону (графіту), і Гідрогену
|
С6 Н6 (Р) +7 1/2 О2 (Г) = 6 СО2 (Г) + 3 Н2О (Р) ; |
Н2=-3269,96 кДж, |
|
С (ГР.) + О2 (Г) = СО2 (Г) ; |
Н3 = -393,78 кДж, |
|
Н2 (Г) + 1\2 О2 (Г) = Н2О (Р) ; |
Н4 = -285,84 кДж. |
За законом Гесса маємо:
![]()
В ряді випадків теплоту утворення хімічних сполук визначають не з простих речовин, а із атомів (атомна теплота утворення). Для розрахунку атомної теплоти утворення враховують теплоту сублімації твердої речовини і теплоту дисоціації молекул газоподібних речовин на атоми.
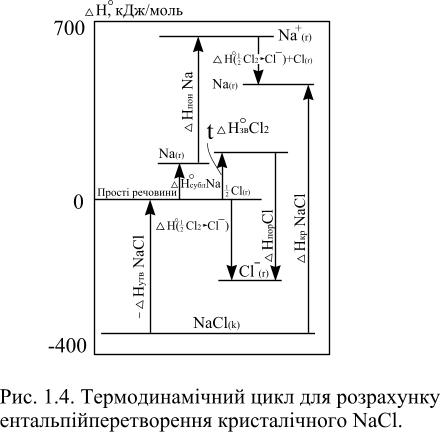
Як приклад розглянемо спосіб розрахунку енергії кристалічної решітки для кристалічного натрій хлориду. Кристалічний натрій хлорид при стандартних умовах може розкладатися на прості речовини і переходити в газоподібний стан (сублімація).
|
NaCl (K) = Na (K) + 1/2 Cl2 (Г) ; |
|
|
Na (K) = Na (Г) ; |
|
Також, відбувається дисоціація молекулярного газоподібного хлору
|
|
|
і йонізація атомів натрію і хлору
|
|
|
|
|
|
Таким чином з кристалічним NaCl відбувається процес:
|
|
|
|
|
|
Рис.1.4. Термодинамічний цикл для розрахунку ентальпій перетворення кристалічного NaCl |
Подальший перебіг газоподібних йонів натрію і хлору замикає термодинамічний цикл (рис.1.4) (цикл Борна-Габера). Виходячи з того, що сумарна зміна ентальпії в циклі дорівнює нулю, маємо:
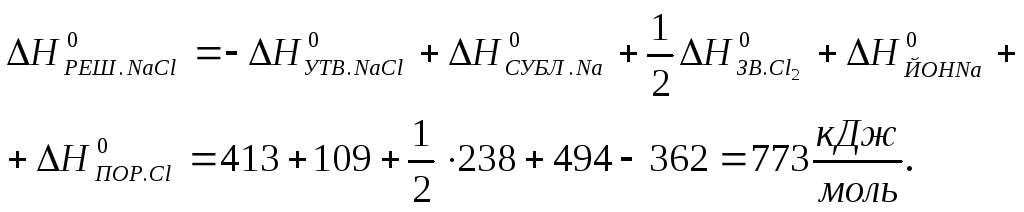
Енергію кристалічної решітки можна розрахувати за універсальним рівнянням А.Ф.Капустінського
![]()
де n – число йонів в молекулі, Z – валентність йонів, ra i rk – йонні радіуси аніона і катіона для координаційного числа 6.
Залежність теплових ефектів хімічних реакцій від температури. З врахуванням молярних ізохорних та ізобарних теплоємностей (СV, CP) температурна залежність теплових ефектів за законом Кірхгофа виражається рівняннями:
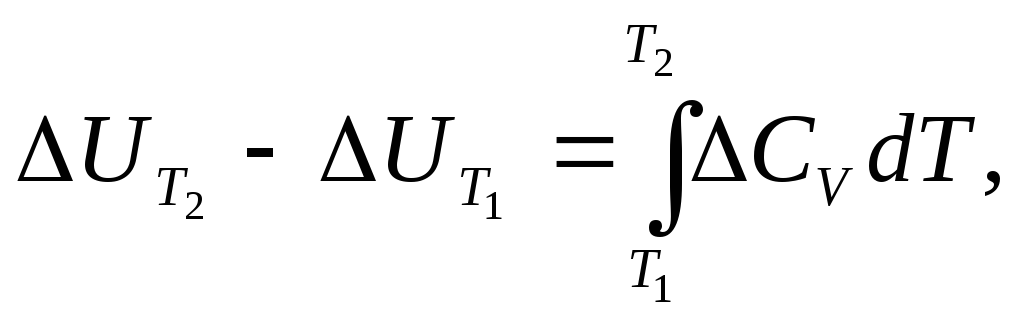 (1.22)
(1.22)
 (1.23)
(1.23)
де
![]() (1.24)
(1.24)
![]() .
(1.25)
.
(1.25)
Для точних розрахунків враховують температурну залежність теплоємності:
![]() (1.26)
(1.26)
Коефіцієнти а, в, с, d, с подаються в довідковій літературі. Оскільки в літературі подаються значення коефіцієнтів для СР, то якщо необхідно визначити значення теплового ефекту U при сталому обємі, враховують що для твердих тіл:
![]()
А для газів
![]() (1.27)
(1.27)
Тепловий ефект при будь-якої температурі розраховують користуючись тепловим ефектом реакції, виміряним за стандартних умов:
![]() (1.28)
(1.28)
Можливий розрахунок теплових ефектів з використанням середніх значень теплоємностей в інтервалі температури 298 – Т:
![]() .
(1.29)
.
(1.29)
Розрахунок теплових ефектів при наявності фазових перетворень в інтервалі температур 298 – Т проводять за рівнянням:
 (1.30)
(1.30)
де СР і СР - теплоємності фаз, стійких у даному інтервалі температур.
Фазові
перетворення
супроводжуються поглинанням або
виділенням прихованої теплоти перетворення
![]() .
.
Для визначення прихованих теплот перетворення необхідно враховувати вплив агрегатного стану компонентів реакції (рис.1.5).
В даному випадку реакція відбувається між речовинами, що перебувають у рідкому стані (процес 1- 4).
Враховуючи, що ентальпія є функція стану, маємо:
![]()
![]()
де
![]() –
загальний тепловий ефект, повязаний
з випаровуванням і конденсацією речовин,
що беруть участь у реакції.
–
загальний тепловий ефект, повязаний
з випаровуванням і конденсацією речовин,
що беруть участь у реакції.
|
Взаємодія між рідинами;
|
Випаровування
1 T = const; P = const;
4 3 Конденсування (Р, Т) |
Взаємодія
між газами (Т,Р);
|
|
|
|
|
|
Рис. 1.5. Теплові ефекти реакції в залежності від агрегатного стану компонентів реакції |
||


 2
2