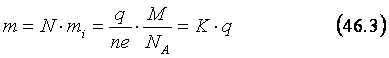- •Механическое движение. Системы отсчета.
- •2. Основные кинематические характеристики.
- •3. Равномерное прямолинейное движение.
- •4. Равнопеременное движение.
- •6. Угловые скорость и ускорение и их связь с параметрами поступательного движения.
- •9. Равновесие твердого тела.
- •10. Работа и кинетическая энергия.
- •11. Законы сохранения в механике
- •12. Упругие силы.
- •17. Уравнение состояния идеального газа.
- •18. Теплота и работа.
- •19. Внутренняя энергия идеального газа.
- •20. Теплоемкость.
- •22. Работа при основных изопроцессах.
- •23. Фазовые переходы.
- •25. Взаимодействие зарядов. Закон Кулона.
- •27. Закон Гаусса.
- •29. Связь потенциала с напряженностью электрического поля.
- •33. Электрический ток в жидкостях. Закон электролиза фарадея.
- •35. Индукция и напряженность магнитного поля. Закон Био-Савара-Лапласа.
- •38. Магнитное поле в вещ-ве. Понятие о диа-, пара- и ферромагнетизме.
- •39. Электромгнитные колебания.
- •43. Интерференция монохроматических волн. Когерентность.
- •48. Атом водорода.
- •49. Волновая функция и ее смысл.
- •51. Зонная теория электропроводности.
- •53. Естественная радиоактивность. Закон радиоактивного распада.
- •Законы радиоактивного распада ядер
- •55. Тепловые машины.
- •56. Переменный ток.
29. Связь потенциала с напряженностью электрического поля.
Для установления связи
между силовой характеристикой
электрического поля -напряжённостью и
его энергетической
характеристикой - потенциаломрассмотрим
элементарную работу сил электрического
поля на бесконечно малом перемещении
точечного заряда q:
dA = q E dl,
эта же работа равна убыли потенциальной
энергии заряда q:
dA = - dWп = - q d, где
d
- изменение потенциала
электрического поля на длине перемещения
dl.
Приравнивая правые части выражений,
получаем: E dl = -d
или
в декартовой системе координат
Ex dx
+ Ey dy +
Ez dz
= -d,
(1.8)
где Ex, Ey, Ez - проекции вектора напряженности на оси системы координат. Поскольку выражение (1.8) представляет собой полный дифференциал, то для проекций вектора напряженности имеем
![]()
откуда
![]() .
.
Стоящее в скобках выражение является градиентом потенциала j, т. е.
E = - grad ![]() = -N
= -N![]() .
.
Напряжённость в какой-либо точке электрического поля равна градиенту потенциала в этой точке, взятому с обратным знаком. Знак «минус» указывает, что напряженность E направлена в сторону убывания потенциала.
Рассмотрим электрическое
поле, создаваемое положительным точечным
зарядом q (рис.
1.6). Потенциал поля в точке М,
положение которой определяется
радиус-вектором r,
равен =q /
4pe0er.
Направление радиус-вектора r совпадает
с направлением вектора напряженности E,
а градиент потенциала направлен в
противоположную сторону. Проекция
градиента на направление радиус-вектора
![]() .
.
Проекция же градиента потенциала на направление вектора t, перпендикулярного вектору r, равна
![]() ,
,
т. е. в этом направлении
потенциал электрического поля
является постоянной
величиной (=const).
В рассмотренном случае
направление вектора r совпадает
с направлением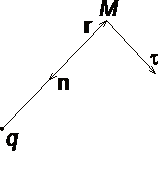 рис.
1.6
рис.
1.6
силовых линий. Обобщая полученный результат, можно утверждать, что во всех точках кривой, ортогональной к силовым линиям, потенциал электрического поля одинаков. Геометрическим местом точек с одинаковым потенциалом является эквипотенциальная поверхность, ортогональная к силовым линиям.
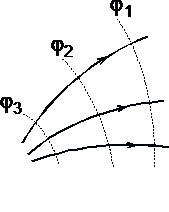 рис.
1.7
рис.
1.7
При графическом изображении электрических полей часто используют эквипотенциальные поверхности. Обычно эквипотенциали проводят таким образом, чтобы разность потенциалов между любыми двумя эквипотенциальными поверхностями была одинакова. На рис. 1.7 приведена двухмерная картина электрического поля. Силовые линии показаны сплошными линиями, эквипотенциали - штриховыми.
Подобное изображение позволяет сказать, в какую сторону направлен вектор напряжённости электрического поля; где напряжённость больше, где меньше; куда начнёт двигаться электрический заряд, помещённый в ту или иную точку поля. Так как все точки эквипотенциальной поверхности находятся при одинаковом потенциале, то перемещение заряда вдоль нее не требует работы. Это значит, что сила, действующая на заряд, все время перпендикулярна перемещению.
33. Электрический ток в жидкостях. Закон электролиза фарадея.
Прохождение тока через электролит сопровождается химическими реакциями на электродах, в результате которых выделяются элементы, входящие в состав электролита. Жидкости, как и твёрдые тела, могут проводить электрический ток. Если переносчиками тока в жидкости служат ионы, то её проводимость называют ионной, а такую жидкость – электролитом.
Ионы при растворении вещества появляются из-за того, что ещё до растворения у многих молекул одна часть обладает избыточным числом электронов, а в другой части их не хватает. Такая молекула, бывшая до растворения электрически нейтральной, при растворении распадается (диссоциирует) на два иона, заряженные равными по модулю, но противоположными по знаку зарядами. Способствуют этому процессу, названному электролитической диссоциацией, полярные молекулы растворителя (например, воды), разрывающие на части (ионы) молекулы растворённого вещества.
Одновременно с электролитической диссоциацией идёт процесс рекомбинации – образование из ионов нейтральных молекул растворённого вещества. Если условия, в которых находится электролит, остаются неизменны, то скоро наступает момент, когда число молекул, распадающихся на ионы в единицу времени, становится равным числу молекул, образовавшихся из ионов в процессе рекомбинации. Таким образом, наступает динамическое равновесие между диссоциацией и рекомбинацией, при котором концентрация ионов остаётся постоянной. При росте температуры динамическое равновесие смещается в сторону электролитической диссоциации и концентрация ионов в электролите растёт.
Положительные и отрицательные ионы в электролите способны перемещаться независимо друг от друга, участвуя, например, в тепловом движении (рис. 46а). Однако при таком беспорядочном движении ионов ток через электролит остаётся равным нулю. Для пропускания тока через электролит в него погружают проводники (рис. 46б), которые называют электродами, создавая с их помощью в электролите электрическое поле. При этом положительный электрод называютанодом, а отрицательный – катодом. Когда между электродами возникает разность потенциалов, движение ионов становится упорядоченным: отрицательные ионы движутся к аноду, а положительные – к катоду.
В отличие от электронной, ионная проводимость сопровождается, переносом вещества (ионов). Соприкасаясь с катодом, положительные ионы получают от него недостающие электроны и становятся электрически нейтральными. При соприкосновении отрицательных ионов с анодом они теряют лишние электроны и тоже становятся нейтральными атомами или молекулами. Таким образом, ток, проходя через электролит, приводит к выделению на электродах веществ, входящих в состав электролита. Это явление и сопровождающий его процесс разложения электролита при пропускании электрического тока называютэлектролизом.
Впервые электролиз исследовал М. Фарадей, который экспериментально доказал, что масса, выделяющегося на электроде вещества, пропорциональна величине заряда, протекающего через электролит. Это заключение называют законом электролиза Фарадея, который сейчас можно легко вывести теоретически. Пусть в электролите присутствуют положительные и отрицательные ионы с валентностью n. Тогда заряд каждого положительного иона будет равен ne (e – элементарный заряд). Если при электролизе через электролит прошёл заряд q, то очевидно, что число Nположительных ионов, достигших катода равно:
N=q/ne. (46.1)
Каждый из положительных ионов, соприкоснувшись с катодом, превращается в нейтральную молекулу (или атом). Если молярная масса вещества, выделяющегося на катоде равна M, то массаmi одной молекулы, ставшей нейтральной на катоде, равна:
mi =M/NA , (46.2)
где NA - постоянная Авогадро. Из (46.1) и (46.2) следует, что масса m вещества, выделившегося на катоде, равна:
|
| |
|
|
|
Очевидно, что (46.3) является математической формой записи закона электролиза Фарадея (K – электрохимический эквивалент вещества).
Электролиз широко применяется для очистки металлов от примесей. Таким образом очищают медь и получают алюминий. Кроме того, используя электролиз, можно покрыть металлические предметы тонким слоем другого металла (никелирование, хромирование и т.п.).
Вопросы для повторения:
· Что такое электролитическая диссоциация и электролиз?
· Сформулируйте закон электролиза Фарадея.
Рис. 46. Хаотичное (а) и упорядоченное движение ионов электролита в электрическом поле (б).