
- •Министерство образования и науки рф
- •Пояснительная записка
- •Бакалавр по физической культуре должен иметь представление:
- •Содержание программы
- •I Введение
- •II Строение атома и Периодический закон
- •III Химическая связь и строение молекул
- •IV Стехиометрические расчеты
- •V Элементы химической термодинамики
- •VI Растворы
- •VII Элементы химической кинетики
- •VIII Элементы коллоидной химии
- •IX Элементы органической химии
- •Календарно - тематический план Лекций, практических и лабораторных занятий по курсу «химия»
- •Основные требования к сдающим зачет по химии
- •I. Обязательные разделы собственноручного конспекта по химии, включенные в допуск к зачету
- •II. Представить решения задач для подготовки к зачету по химии и уметь устно обосновывать ход их решения Задачи для проведения практических занятий и подготовки к зачету по химии
- •Справочные материалы
- •III. Контрольные вопросы к зачету по химии, знание которых обязательно
- •Учебная программа по химии Для студентов заочного отделения
- •Выполнение контрольной работы
- •Варианты контрольной работы
- •Карта обеспеченности литературой
Выполнение контрольной работы
Перед выполнением контрольной работы следует сначала полностью прочитать в учебнике, записях лекций и других литературных источниках соответствующие разделы химии. Затем составить краткие конспекты и приступить к написанию контрольной работы.
Ответы на вопросы задания должны быть четкими, полными, проиллюстрированными химическими формулами и уравнениями. Нельзя переписывать текст из учебника и приводить односложные ответы типа «да», «нет» и т.п. При изложении материала допускаются лишь общепринятые сокращения (кг, г, м, см, с и т.п.). Работа должна быть написана разборчиво, чисто.
Варианты контрольной работы
Вариант 1.
1. Строение ядра атома. Внутриядерные силы. Взаимопревращения протонов и нейтронов.
2. Общая характеристика коллоидных растворов. Строение мицеллы. Факторы, определяющие устойчивость коллоидных растворов.
3. Описать различия в строении и химических свойствах предельных и непредельных углеводородов.
4. Написать формулы изомеров гептана и назвать их по международной номенклатуре.
5. Найти рН и молярную концентрацию 4% -ного раствора NaOH (α = l, плотность раствора принять 1 г/мл).
Вариант 2.
1. Общая характеристика периодического закона Д.И. Менделеева. Как и почему изменяются свойства элементов в пределах периода?
2. Общая характеристика буферных систем. Механизм буферного действия (на примере бикарбонатного буфера). Буферная ёмкость.
3. Общая характеристика спиртов. Классификация спиртов. Изомерия. Химические свойства спиртов.
4. Написать формулы соединений:
а) 2,3-диметил-3-этилгексан; б) 1.1-дихлорэтан; в) 2-метилбутанол-2.
5. В 100 мл раствора содержится 4,9 г серной кислоты. Найти рН, молярную концентрацию и массовую долю кислоты (α = l, плотность раствора принять 1 г/мл).
Вариант 3.
1. Строение молекулы. Типы химических связей в молекуле. Привес ти примеры.
2. Обязательные условия протекания химических реакций. Энергия активации. Зависимость между величиной энергии активации и скоростью реакции. Уравнение Аррениуса.
3. Общая характеристика ароматических соединений. Физико-химические свойства и химические свойства бензола.
4. Написать формулы изомеров гексена и назвать их по международной номенклатуре.
5. В 250 мл воды растворили 35,5 г сульфата натрия. Найти молярную концентрацию и массовую долю соли.
Вариант 4.
1. Характеристика электрона с использованием квантовых чисел. Правила составления электронных конфигураций атомов и одноатомных ионов. Найти квантовые числа для электронов внешнего слоя атома алюминия.
2. Обратимые химические реакции. Характеристика состояния равновесия. Принцип Ле-Шателье.
3. Общая характеристика органических соединений и их классификация.
4. Дать название по международной номенклатуре соединению:
С

 Н2
= СН - СН - СН2
- СН - СН - СН3
Н2
= СН - СН - СН2
- СН - СН - СН3
СН3 NH2 С1
5. Найти рН и массовую долю серной кислоты в ее 0,05 М растворе (α = l, плотность раствора принять 1 г/мл).
Вариант 5.
1. Классификация химических связей по положению связывающей электронной пары между ядрами - ковалентные, полярные, ионные. Привести примеры.
2. Концентрации ионов водорода и гидроксила в нейтральной, кислой и щелочной средах. Водородный показатель рН.
3. Строение и химические свойства фенолов.
4. Написать формулы соединений:
а) 2,3,3-триметил-4-этилгептан; б) пропанол-2; в)гексадиен-1,4.
5. При добавлении к 200 мл буферного раствора 0,4 г NaOH значение рН изменилось с 6,8 до 8,8. Найти буферную ёмкость раствора.
Вариант 6.
1. Описать химические связи в молекулах: N2, NH3, CH3C1, AI2O3
2. Общая характеристика буферных систем. Механизм буферного действия (на примере фосфатного буфера). Буферная ёмкость.
3. Строение, физико-химические и химические свойства непредельных углеводородов.
4. Написать формулы изомеров пентена и назвать их по международной номенклатуре.
5. Раствор соляной кислоты с рН = 0 разбавили водой в 100 раз. Найти рН, молярную концентрацию и массовую долю кислоты в растворе.
Вариант 7.
1. Строение ядра атома. Соотношение между протонами и нейтронами у атомов одного и разных химических элементов. Изотопы.
2. Характеристика процесса растворения. Механизм растворения электролитов и неэлектролитов. Гидратация.
3. Строение, физико-химические и химические свойства предельных углеводородов.
4. Написать формулы соединений:
а) 1,4-диметилбензол; б) бутин-2; в) 2,2-диметилпентен-3-ол-5.
5. К 200 мл раствора, содержащего 23,8 г бромида калия, прибавили 300 мл раствора, содержащего 51 г нитрата серебра. Осадок отфильтровали. Какие соли находятся в фильтрате и каковы их молярные концентрации?
Вариант 8.
1. Характеристика периодического закона Д. И. Менделеева на основании современных представлений об электронном строении атомов.
2. Общая характеристика катализа. Роль катализатора в изменении механизма реакции и уменьшении энергии активации; особенности ферментативного катализа биохимических процессов – высокая эффективность и специфичность, механизм взаимодействия катализатора и субстрата (“ключ в замке”). Гомогенный и гетерогенный катализ.
3. Общая характеристика органических соединений. Электронная конфигурация углерода, типы гибридизации с участием s и p – орбиталей, s, p - связи. Функциональные группы органических соединений.
4. Написать структурную формулу соединения: 2,2-диметилгептен-3-ол-7.
5. Найти рН, молярную концентрацию и массовую долю азотной кислоты в растворе, если в 200 мл его содержится 0,02 моля азотной кислоты.
Вариант 9.
1. Естественная радиоактивность. Виды радиоактивного излучения.
2. Концентрация ионов водорода и гидроксила в кислой, нейтральной и щелочной среде. Индикаторный метод определения рН.
3. Общая характеристика и классификация карбоновых кислот. Физико-химические и химические свойства карбоновых кислот.
4. Написать формулы соединений: а) 2-хлор-3-метилгексанол-5: б) пентандиаль.
5. При повышении температуры на 20°С скорость реакции увеличилась с 20 ммоль/л мин до 80 ммоль/л мин. Какова величина температурного коэффициента?
Вариант 10.
1. Характеристика электрона с использованием квантовых чисел. Правила составления электронных конфигураций атомов и одноатомных ионов. Найти квантовые числа для электронов внешнего слоя атома азота.
2. Факторы, влияющие на скорость химической реакции.
3. Общая характеристика гетероциклических соединений.
4. Написать формулу соединения: 2,2,3-триметилгексен-4-ол-6
5. В 500 мл раствора содержится 24,5 г серной кислоты. Найти молярную концентрацию, массовую долю кислоты и рН (α = l, плотность раствора принять 1 г/мл).
Вариант 11.
1. Составить электронные конфигурации атомов следующих химических элементов: натрия, аргона, скандия, стронция, а также одноатомных ионов : Al3+, S2–, Ba2+, F–.
2. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс.
3. Общая характеристика и классификация альдегидов. Физико-химические и химические свойства альдегидов.
4. Написать изомеры пентанола и назвать их по международной номенклатуре.
5. На сколько градусов следует увеличить температуру реакционной смеси, чтобы скорость реакции возросла в 27 раз? Температурный коэффициент данной реакции равен 3.
Вариант 12.
1. Провести классификацию химических связей в молекулах: СН3Вг, CaO, I2, NH4CI,
2. Обратимые химические реакции. Характеристика состояния равновесия. Константа равновесия. Принцип Ле-Шателье.
3. Общая характеристика полициклических ароматических соединений.
4. Дать названия по международной номенклатуре соединениям:
а
 )
СНз - СН - СН - СН2
- СН3
)
СНз - СН - СН - СН2
- СН3
СНз С2Н5
б) CCl4, в) СН2 = СН- СН2 - СНз
5. Найти концентрацию ионов водорода и гидроксила в растворе с рН=10.
Вариант 13.
1 Осмос, физическое содержание явления. Полупроницаемые мембраны. Осмотическое давление и его расчет по закону Вант-Гоффа. Понятие об изотонических растворах, гипертонических и гипотонических растворах, физиологических растворах. Состав плазмы крови человека, ее осмолярность и осмотическое давление. Расчет концентрации физиологических растворов на основе NaCl, CaCl2, глюкозы. Поведение эритроцитов крови в гипертонических, гипотонических и физиологических растворах. Гемолиз и плазмолиз, правила проведения внутривенных инъекций лекарств.
2. Механизм растворения электролитов и неэлектролитов. Гидратация.
3. Общая характеристика и классификация спиртов. Физико-химические и химические свойства спиртов.
4. Дать названия по международной номенклатуре соединениям:
а
 )
СН2 = СН-СН-СН2-СН~СН3
)
СН2 = СН-СН-СН2-СН~СН3
СНз ОН
б) СНз - СН - СН - СНз


СНз Сl
5. Определить скорость химической реакции, в ходе которой в 250 мл раствора за 5 минут содержание одного из реагирующих веществ снизилось с 0,4 моля до 0,3 моля.
Вариант 14.
1. Общая характеристика периодической системы элементов Д. И. Менделеева. Как и почему изменяются металлические свойства химических элементов в периодах и главных подгруппах ?
2. Скорость химической реакции. Константа скорости. Зависимость скорости реакции от температуры. Температурный коэффициент Вант-Гоффа, уравнение Аррениуса.
3. Общая характеристика альдегидов и кетонов. Физико-химические и химические свойства альдегидов.
4. Написать структурные формулы соединений:
а) 2-метил-3-хлоргексанол-4;
б) 2- хлор -3 -этил - 4-пропилгептан.
5. Найти массовую долю хлороводорода и рН в 0,1 М растворе соляной кислоты (α = l, плотность раствора принять 1 г/мл).
Вариант 15.
1. Строение электронной оболочки атомов. Написать электронные конфигурации следующих атомов и одноатомных ионов: углерода, неона, кальция и криптона, Cl–, Mg2+, Se2– , K+.
2. Общая характеристика водных растворов. Механизм растворения. Способы выражения состава раствора - весовые (массовая доля) и объемные (молярная (моль/л) и весовая (г/л)) концентрации. Уравнения пересчета между разными видами концентраций.
3. Описать различия в строении и химических свойствах предельных и непредельных углеводородов.
4. Написать структурные формулы изомеров пентена и назвать их по международной номенклатуре.
5. К 1 л воды прибавили 0.63 г азотной кислоты и 0.8 г едкого натра. Каков рН полученного раствора?
Вариант 16.
1 Провести классификацию химических связей в молекулах и ионе N2, HCl, BaBr2, NH4+.
2. Получение коллоидных растворов методами диспергирования малорастворимого вещества (суспензии) и химической конденсации в результате реакции обмена или гидролиза (гидрозоли). Размеры коллоидных частиц в суспензиях и золях. Строение мицеллы. Факторы устойчивости коллоидных растворов. Коагуляция золей электролитами. Правило Шульце-Гарди.
3. Общая характеристика ароматических соединений. Химические свойства бензола.
4. Написать структурные формулы соединений:
а) 2-метил-4-пропилгептен-1-ол-6; б) бутаналь.
5. Сравните поведение эритроцитов крови в 0,01М, 0,15М и 0,5М растворах поваренной соли при 310К (37оС). Рассчитайте осмотическое давление растворов и дайте обоснованный ответ.
Вариант 17.
1. В каком из перечисленных соединений имеется наиболее полярная ковалентная связь - HF, НС1, HBr, HJ? Дать необходимое обоснование.
2. Общая характеристика катализа. Гомогенный и гетерогенный катализ.
3. Общая характеристика органических соединений. Изомерия органических соединений. Привести примеры изомеров бутилового спирта.
4. Дать название по международной номенклатуре соединениям:
а


 )
СН3
- СН - СН2
- С =СН2
б) СН3
- СН - СН = СН2
в) СНз - СН2
– С = О
)
СН3
- СН - СН2
- С =СН2
б) СН3
- СН - СН = СН2
в) СНз - СН2
– С = О
СНз C2H5 СНз Н
5. Найти осмотическое давление, которое может выдержать эритроцит, если гемолиз начинается в 0,3% -ном растворе NaCl
Вариант 18
1. Написать электронные формулы химических элементов с порядковыми номерами: 6, 9,14,20,35.
2. Коллоидные ПАВ - особенности строения и поведения в водных растворах. Мицеллообразование, форма мицелл, явление солюбилизации. Механизм моющего действия коллоидных ПАВ (мыла, стиральные порошки).
.
3. Общая характеристика углеводородов. Физико-химические и химические свойства предельных углеводородов.
4. Написать структурные формулы соединений:
а) 2-метил-З-этилгексин -4-аль-6; б) пропанон.
5. 1,12 г КОН растворили в воде и довели объем раствора до 200 мл. Найти рН, молярную концентрацию и массовую долю щелочи растворе (α = l, плотность раствора принять 1 г/мл).
Вариант 19.
1. Искусственная радиоактивность. Заурановые элементы.
2. Скорость химической реакции. Константа скорости. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс.
3. Общая характеристика альдегидов и кетонов. Физико-химические и химические свойства альдегидов.
4. Написать изомеры гексанола и назвать их по международной номенклатуре.
5. Скорость химической реакции с температурным коэффициентом, равным 3, при 0°С составляет 1 моль/л-мин. Вычислить скорость этой реакции при 30°С.
Вариант 20.
1. Характеристика периодического закона Д.И. Менделеева на основании современных представлений об электронном строении атома.
2. Факторы, влияющие на скорость химической реакции.
3. Общая характеристика спиртов. Физико-химические и химические свойства спиртов.
4. Дать названия по международной номенклатуре соединениям:
О
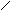
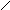
а) СНз - СН2 - СН - СН3 б) СН3 - СН2 - СН2 - СН2 – C

 H
H
СНз



 в)
О = С - СН2
- СН2
– C
= О г) СНз – С – СН2
-СН3
в)
О = С - СН2
- СН2
– C
= О г) СНз – С – СН2
-СН3
Н Н O
5. Три водных раствора разделены проницаемыми только для растворителя мембранами в следующей последовательности: 0,01М раствор хлорида натрия // 0,01М раствор сульфата натрия // 0,01М раствор мочевины. Укажите направление движения растворителя через мембраны. Как нужно изменить концентрации растворов, чтобы они были изотоничны.
Вариант 21.
1. Строение электронной оболочки атомов. Написать электронные конфигурации атомов и ионов: кислорода, неона, кальция, брома, Br–, Sr2+, Te2–, Li+.
2. Строение молекулы воды. Водородная связь в воде. Вода как слабый амфотерный электролит. Ионное произведение воды и водородный показатель среды рН. Шкала рН, кислые, нейтральные и щелочные растворы. Методы определения рН растворов - колориметрический и потенциометрический. Кислотно-основные индикаторы (фенолфталеин, лакмус, метилоранж) и их характеристики. Универсальные индикаторные бумаги.
3. Общая характеристика и классификация карбоновых кислот.
4. Написать формулы изомеров гептана и назвать их по международной номенклатуре.
5 Химическая реакция с температурным коэффициентом, равным 2, при 20°С протекает за 2 мин. За какое время завершится эта реакция при 50°С?
Вариант 22.
1 Провести классификацию химических связей в молекулах: N2, О2, H2О, H2S, CH3C1, AlCl3, MgO.
2. Обязательные условия протекания химических реакций. Зависимость скорости реакции от энергии активации. Уравнение Аррениуса для константы скорости и расчет энергии активации по экспериментальным данным.
3. Общая характеристика ароматических соединений. Физико-химические и химические свойства бензола.
4. Написать формулы соединений: а) 2-хлор-3-метилгептен-4-ол-7; б) 2,3,4-триметилгексадиол-5.6
5. На нейтрализацию 5 мл раствора NaOH пошло 10 мл 0,05 М раствора НС1. Найти рН, молярную концентрацию и массовую долю щелочи в исходном растворе.
Вариант 23.
1. Агрегатное состояние вещества. Строение твердого вещества. Типы кристаллических решеток.
2. Общая характеристика растворов. Основные различия между истинными и коллоидными растворами. Получение коллоидных растворов методами диспергирования малорастворимого вещества (суспензии) и химической конденсации в результате реакции обмена или гидролиза (гидрозоли). Строение мицеллы. Факторы устойчивости коллоидных растворов. Коагуляция золей электролитами. Правило Шульце-Гарди.
3. Общая характеристика углеводородов. Физико-химические и химические свойства непредельных углеводородов.
4. Написать формулы соединений: а) 2-метилбутаналь-4; б) 2,2-диметил-3-этилгексен-5.
5. Как и почему изменится равновесие при уменьшении давления в следующих реакциях:
a) N2O4 « 2NO2; б) 2NO + O2 « 2NO2.
Вариант 24.
1. Естественная радиоактивность. Виды радиоактивного излучения.
2. Буферные растворы – их химический состав (кислотно-основные сопряженные пары) и сущность буферного действия, буферная емкость. Соотношение кислотных и основных продуктов обмена веществ, образующихся в организме человека, их главные представители. Кислотность плазмы крови и границы изменения ее рН. Буферные системы крови, места их функционирования, состав и соотношение основного и кислотного компонентов. Буферное действие гидрокарбонатной буферной системы при поступлении в кровь молочной кислоты и аммиака. Метаболическое и респираторное происхождение явлений ацидоза и алкалоза.
3. Общая характеристика органических соединений. Электронная конфигурация углерода, типы гибридизации с участием s и p – орбиталей, s, p - связи. Функциональные группы органических соединений.
4. Описать с помощью химических реакций следующие превращения:
О


С2H4 —> СН3 – С = О —> СН3 – С – O – СН2-СН3

H
Дать названия реагирующим веществам и конечному продукту,
5. Как необходимо изменить температуру и давление для смещения равновесия в сторону продуктов разложения в реакции:
СаСОз « СаО + СO2 + Q (тепло)
Вопросы к зачету для студентов заочного отделения
1. Строение ядра атома. Изотопы.
2. Характеристика электронов с использованием квантовых чисел.
3. Периодический закон Д. И. Менделеева.
4. Образование ионной связи. Привести примеры.
5 Образование неполярной и полярной ковалентной связи. Привести примеры.
6. Агрегатное состояние вещества.
7. Строение твердого тела. Типы кристаллических решеток.
8. Сорбция на твердом теле. Хроматография и хемосорбция.
9. Способы количественной оценки концентрации растворов.
10. Характеристики процесса растворения.
11. Диффузия и осмос.
12. Молекула воды как электрический диполь. Образование водородных связей.
13. Концентрация ионов водорода и гидроксид-ионов в кислой, нейтральной
и щелочной среде. Водородный показатель.
14. Методы определения рН.
15. Буферные системы. Механизм буферного действия (на примере бикарбонатного буфера).
16. Отличие коллоидных растворов от истинных.
17. Методы получения и факторы устойчивости коллоидных растворов.
18. Коагуляция и седиментация коллоидных растворов.
19. Обязательные условия протекания химической реакции.
20. Скорость химической реакции. Способы измерения скорости. Константа скорости.
21 Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс.
22 Энергия активации. Зависимость между величиной энергии активации
и скоростью реакции. Уравнение Аррениуса.
23. Зависимость скорости реакции от температуры.
24. Обратимые химические реакции. Характеристика состояния равновесия. Константа равновесия.
25. Гомогенный и гетерогенный катализ.
26. Общая характеристика органических соединений. Изомерия.
27. Электронная формула атома углерода. Образование σ- и π -связей.
28. Классификация органических соединений. Функциональные группы
органических соединений.
29. Международная номенклатура органических соединений.
30. Строение и физико-химические свойства предельных углеводородов.
31. Химические свойства предельных углеводородов.
32. Строение и физико-химические свойства непредельных углеводородов.
33. Химические свойства непредельных углеводородов.
34. Классификация спиртов. Привести примеры представителей отдельных классов.
36. Строение и физико-химические свойства спиртов.
35. Химические свойства спиртов.
37. Строение и химические свойства альдегидов и кетонов.
38. Классификация карбоновых кислот. Привести примеры представителей отдельных классов.
39. Строение и физико-химические свойства карбоновых кислот.
40. Химические свойства карбоновых кислот.
41. Полифункциональные соединения.
42. Строение и физико-химические свойства бензола.
43. Производные бензола.
44. Фенолы и ароматические спирты.
45. Общая характеристика гетероциклических соединений.
47. Строение и классификация аминокислот.
