
- •Методические указания к лабораторным занятиям по дисциплине «Химия»
- •Сыктывкар, 2016
- •1 Техника безопасности при работе в лаборатории органической
- •1.1 Общие правила работы
- •1.2 Работа с взрывоопасными и горючими веществами
- •1.3 Общие методические советы
- •2 Методы очистки органических соединений
- •2.1 Очистка твердых органических соединений методом перекристаллизации
- •2.2 Очистка твердых органических соединений методом возгонки
- •2.3 Определение температуры плавления
- •2.4 Очистка жидких органических соединений
- •2.4.1. Простая перегонка
- •2.4.2. Дробная (фракционная) перегонка
- •2.4.3. Определение показателя преломления
- •3. Синтез органических соединений Иодоформ
- •Бромэтан
- •Уксусноэтиловый эфир
- •Углеводороды
- •Контрольные вопросы по теме «Углеводороды»
- •Галогенпроизводные углеводородов
- •Контрольные вопросы по теме «Галогенпроизводные углеводородов»
- •Оксисоединения: спирты, фенолы
- •Контрольные вопросы по теме «Оксисоединения: спирты, фенолы»
- •Карбонильные соединения: альдегиды, кетоны
- •Контрольные вопросы по теме «Карбонильные соединения»
- •Углеводы
- •Контрольные вопросы по теме
- •Карбоновые кислоты и их производные
- •Контрольные вопросы по теме «Карбоновые кислоты и их производные»
- •Ароматические амины
- •Контрольные вопросы по теме «Ароматические амины»
- •Рекомендуемая литература
Уксусноэтиловый эфир
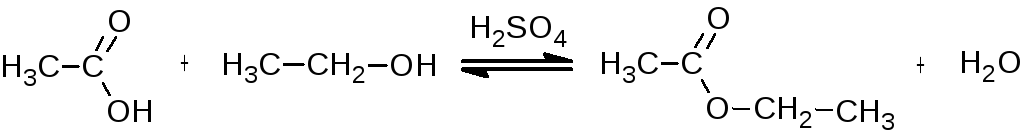
Реактивы: уксусная кислота (ледяная) – 20 мл; этанол -23 мл; конц. серная кислота (ρ = 1,84 г/см3) - 4,6 г; карбонат натрия; хлорид кальция, насыщенный раствор; хлорид кальция безводный.
В колбу Вюрца, снабженную капельной воронкой и соединенную с нисходящим водяным холодильником, помещают 3 мл этилового спирта и 2,5 мл концентрированной серной кислоты. Содержимое нагревают до 140 0C и после достижения этой температуры из капельной воронки начинают медленно приливать смесь 20 мл ледяной уксусной кислоты и 20 мл этилового спирта с такой скоростью, с какой отгоняется образующийся уксусноэтиловый эфир.
После окончания отгонки этилацетата его переносят в делительную воронку и промывают насыщенным раствором карбоната натрия для удаления непрореагировавшей уксусной кислоты, контролируя индикаторной бумагой. Эфирный слой отделяют и встряхивают его с насыщенным раствором хлорида кальция для удаления непрореагировавшего спирта (с первичными спиртами хлорид кальция образует кристаллическое молекулярное соединение СаСI2 · 2С2Н5ОН, не растворимое в этилацетате, но растворимое в воде). После разделения слоев в делительной воронке эфирный слой отделяют, сушат безводным хлоридом кальция и перегоняют, собирая фракцию с Ткип 75-79 0C . Выход 20 г.
Уксусноэтиловый эфир (этиловый
эфир уксусной кислоты, этилацетат) –
бесцветная жидкость с приятным запахом.
Смешивается со многими органическими
растворителями: этанолом, диэтиловым
эфиром, бензолом, хлороформом, ограниченно
растворяется в воде. Tкип.=
77,150C; ρ =
0,9010 г/см3;![]() = 1,3724.
= 1,3724.
2,4,6-Триброманилин
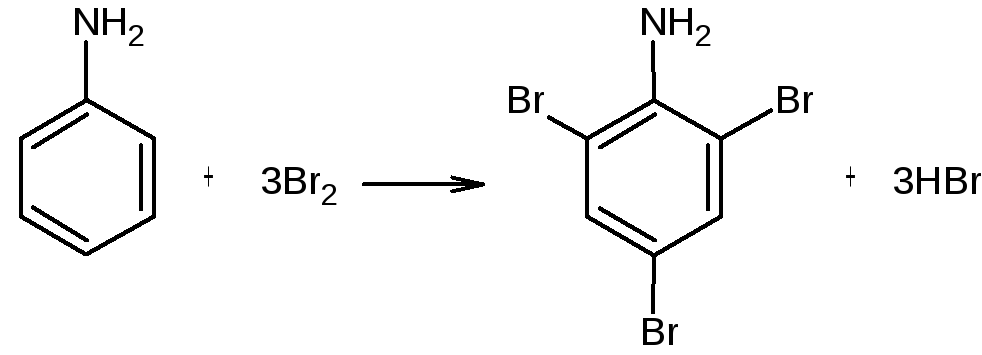
Реактивы: анилин (свержеперегнанный) – 2,5 мл; бром – 4,8 мл; бромид калия – 9 г; соляная кислота (конц.); гидроксид натрия (10%); этанол.
В широкогорлой плоскодонной колбе растворяют 2,5 мл анилина в 75 мл воды с 2,5 мл соляной кислоты. Отдельно в стакане растворяют в 50 мл воды 9 г бромида калия и 4,8 мл брома при перемешивании. Полученный прозрачный раствор выливают в капельную воронку, помещенную над реакционной колбой. Постепенно, по каплям приливают его в течение 30 мин в реакционную смесь при энергичном перемешивании. Реакция галогенирования должна проходить при комнатной температуре. По окончании реакции окраска брома исчезает и выпадает осадок триброманилина. Его отсасывают на воронке Бюхнера, промывают 10%-ным раствором гидроксида натрия, затем большим количеством воды. Влажный триброманилин очищают от примесей кристаллизацией из горячего спирита (около 150 мл). Спиртовой раствор помещают в ледяную баню на 1 час для кристаллизации. Затем осадок отсасывают на воронке Бюхнера и сушат на воздухе. Выход – 7 г.
2,4,6-Триброманилин – бесцветное кристаллическое вещество; растворим в эфире, хлороформе; не растворяется в воде; Tплав. = 119-1200C; Tкип.= 3000C.
Углеводороды
Опыт № 1. Получение и свойства метана
Нагревание солей карбоновых кислот с натронной известью является общим лабораторным способом получения предельных углевлодородов. Натронная известь (правильно натровая известь) – это смесь негашеной извести с гидроксидом натрия, белая пористая масса. Применение её удобнее потому, что она (в отличие от гидроксида натрия) не разъедает стекло, не плавится при нагревании, а благодаря ее пористости облегчается выделение метана.
t
СН3 CОООNa + NaOH → CH4 + Na2CO3
В сухую пробирку помещают на 1/3 ее объема тщательно растертую в ступке смесь одной части обезвоженного ацетата натрия с двумя частями предварительно прокаленной натронной извести. Укрепляют пробирку в лапке штатива почти горизонтально, присоединяют газоотводную трубку и нагревают смесь пламенем горелки сначала осторожно, затем сильно. Опуская газоотводную трубку в отдельные пробирки с бромной водой и раствором перманганата калия, устанавливают, изменяется ли окраска этих реактивов выделяющимися пузырьками газообразного углеводорода, т.е. Происходит ли бромирование или его окисление. Не прекращая нагревания, заменяют газоотводную трубку стеклянной трубкой с оттянутым концом и поджигают метан. Метан горит голубоватым пламенем. Дают прибору остыть, а затем разбирают его.
Напишите уравнение реакции горения метана, сделайте вывод о физических и химических свойствах метана как представителя предельных углеводородов.
Опыт № 2. Получение и свойства этилена
В сухую пробирку наливают 1 мл этилового спирта и 4 мл концентрированной серной кислоты. Для равномерного кипения жидкости опускают в пробирку со смесью 2-3 кусочка битого фарфора. После этого присоединяют газоотводную трубку и пробирку закрепляют в лапке штатива. Осторожно нагревают пробирку до начала равномерного выделения газа из реакционной смеси. Газоотводную трубку поочередно опускают в пробирку с раствором перманганата калия и бромной водой. Затем поджигают выделяющийся этилен.
Непредельный характер этилена проявляется в быстроте его бромирования и окисления, а также в несколько более ярком цвете пламени этилена по сравнению с цветом пламени горящего метана.
Химизм процесса получения этилена:
СН3-СН2- ОН + НО-SO3H → СН3-СН2- O- SO3H
этилсерная кислота
Этилсерная кислота – неполный сложный эфир серной кислоты – при нагревании разлагается:
170 OC
Н-СН2-СН2-О- SO3H → CH2 = CH2 + H2SO4
Таким образом, при взаимодействии этилового спирта с концентрированной серной кислотой происходит дегидратация спирта.
Напишите уравнения реакции горения этилена, взаимодействия его с бромом и перманганатом калия. Чем объяснить яркий цвет пламени этилена и появление сажи при его горении?
Смесь этилового спирта с серной кислотой, попадая на кожу, вызывает долго незаживающие ожоги, а попадая на одежду, разрушает ее. Поэтому нагревать смесь нужно очень осторожно, не допускать выброса смеси из пробирки. После окончания опыта дают пробирке остыть, выливают смесь в специальный сосуд.
Опыт № 3. Получение и свойства ацетилена
Небольшие количества ацетилена удобно получать в пробирке, имеющей в дне отверстие. Пробирку укрепляют вертикально за верхнюю часть в лапке штатива. На дно сухой пробирки помещают немного ваты, а на нее – 3 – 4 кусочка карбида кальция, поверх которых также кладут вату. Пробирку закрывают пробкой с газоотводной трубкой и винтовым зажимом. При закрытом зажиме подводят под пробирку стакан с водой так, чтобы уровень воды был значительно выше слоя карбида кальция в пробирке. При открывании зажима вода поступает в пробирку через нижнее отверстие, а образующийся ацетилен выделяется через газоотводную трубку; при закрывании зажима реакция в пробирке прекращается. Этим путем легко регулировать выделение ацетилена.
С газообразным ацетиленом проводят опыты, описанные в предыдущих опытах, т.е. Наблюдают его бромирование, окисление и горение. Кроме этого, проводят реакции образования металлических производных ацетилена, пропуская ацетилен через аммиачный раствор оксида серебра.
Аммиачный раствор оксида серебра готовят путем добавления к 1 мл раствора нитрата серебра гидроксида аммония по каплям до растворения первоначально образующегося осадка.
В результате этих реакций выделяется светло-желтый осадок, сереющий на воздухе ацетиленид серебра. В водных растворах ацетилениды серебра и меди устойчивы, в сухом состоянии при нагревании или при ударе они взрываются с большой силой. Поэтому после опытов ацетилениды уничтожают, для чего помещают их в стакан с водой и добавляют концентрированную соляную или азотную кислоту (1/4 – 1/5 от объема воды).
Напишите самостоятельно уравнения реакций получения, горения и взаимодействия с бромом ацетилена.
Ацетилен перманганатом калия окисляется труднее этилена. В условиях опыта образуется щавелевая кислота:
8СН ≡ СН + 8КMnO4 + 4H2O → 3COOH-COOH + 8 KOH + 8 MnO2
Ацетилен, в отличие от этилена, вступает в реакции замещения водорода при атомах углерода с тройной связью. При пропускании ацетилена через аммиачный раствор оксида серебра протекают следующие реакции:
AgNO3 + NH3 + H2O → [AgOH] + NH4NO3
2[AgOH] → Ag2O + H2O
Ag2O + 4NH3 + H2O → 2 [Ag(NH3)2]OH
СН ≡ СН + 2 [Ag(NH3)2]OH→ Ag-C ≡ С-Ag↓ + 4NH3 + 2H2O
ацетиленид серебра
Работу с ацетиленом следует проводить в вытяжном шкафу, так как неприятно пахнущие примеси в ацетилене (главным образом, фосфористый водород РН3), накапливаясь в помещении лаборатории, могут причинить вред здоровью работающих. Химически чистый ацетилен не имеет запаха.
Опыт № 4. Бромирование углеводородов
В сухую пробирку помещают 1 мл исследуемого вещества и добавляют по каплям при легком встряхивании раствор брома. Если желтая окраска не исчезает на холоде, то смесь слегка нагревают. Устанавливают, сопровождается ли исчезновение окраски, обусловленной присутствием свободного брома, образованием бромоводорода – газа, имеющего резкий запах, дымящегося на воздухе (особенно при внесении в пробирку палочки, смоченной аммиаком) и окрашивающего влажную синюю лакмусовую бумагу в красный цвет.
Характерное для непредельных углеводородов присоединение брома по кратным связям протекает быстро. Реакция бромирования жидких алканов сопровождается выделением бромоводорода. Этот процесс замещения также ведет к обесцвечиванию раствора, но протекает гораздо медленнее, чем присоединение, требует нагревания, освещения или присутствия катализатора.
Для реакций бромирования удобно применять растворы брома в органических растворителях, так как с углеводородами они дают гомогенную смесь. Поэтому протекают быстрее, а выделение нерастворимого в этой среде бромоводорода обнаруживается с полной определенностью, что ясно указывает на протекание реакции замещения. Применение бромной воды при работе с жидкими веществами в большинстве случаев менее удобно, так как бромирование идет медленнее, требует энергичного взбалтывания, а образование бромоводорода, хорошо растворимого в воде, качественно обнаружить не удается. Кроме того, бромная вода является не только бромирующим агентом, но и окислителем, что затрудняет истолкование причин исчезновения окраски реакционной смеси. Для опытов с газообразными углеводородами бромная вода более удобна.
Запишите все возможные реакции взаимодействия брома с исследуемыми соединениями.
Опыт № 5. Окисление углеводородов перманганатом калия
В сухую пробирку помещают 1 мл исследуемого вещества и добавляют сначала равный объем раствора карбоната натрия, а затем постепенно по каплям при сильном взбалтывании раствор перманганата калия.
Фиолетовая окраска водного раствора перманганата калия в присутствии насыщенных углеводородов не изменяется. Наличие непредельных соединений обнаруживается по исчезновению первоначальной окраски раствора перманганата калия и появлению бурого хлопьевидного осадка оксида марганца (IV).
Окисление углеводородов ряда этилена в условиях опыта идет по схеме:
│ │ │ │
С = C + КMnO4 + H2O → ─C ─ C─ + KOH + MnO2
│ │ │ │
OH OH
Запишите все возможные реакции взаимодействия брома с исследуемыми соединениями.
Опыт № 6. Бромирование ароматических углеводородов
В 2 сухие пробирки помещают по 1 мл бензола и толуола. В каждую пробирку добавляют по 1 мл раствора брома в четыреххлористом углероде и встряхивают. Затем делят каждую смесь на две части, отливая половину ее объема в чистую сухую пробирку. Одну часть каждой смеси с раствором брома оставляют стоять в штативе, другую часть нагревают до кипения.
Отмечают изменения, произошедшие во всех пробирках. Сравнивают скорость реакции бромирования различных ароматических углеводородов. Признаками реакции бромирования являются исчезновение окраски брома и выделение дымящего на воздухе бромоводорода.
При бромировании (хлорировании) ароматических углеводородов может протекать реакция замещения или присоединения. Строение углеводорода и условия проведения реакции в очень большой степени отражаются на ее течении.
Атомы водорода в бензоле и ароматическом ядре его гомологов не замещаются галогенами в отсутствие катализаторов даже при кипячении. Атомы же водорода в боковых цепях быстро замещаются галогенами. Из толуола в этих условиях получается бромистый бензил:
t
С6Н5СН3 + Br2 → С6Н5СН2Br + Hbr
бромистый бензил
Такие галогенпроизводные обладают резким запахом и вызывают слезотечение.
Опыт № 7. Окисление ароматических углеводородов
В две пробирки помещают по 1 мл раствора перманганата калия и по 1 мл разбавленной серной кислоты. Затем добавляют в одну пробирку несколько капель (около 0,5 мл) бензола, а в другую такое же количество толуола. Сильно встряхивают обе пробирки в течение нескольких минут. Изменяется ли цвет раствора перманганата калия?
Бензол весьма устойчив по отношению к окислителям и практически не окисляется перманганатом калия ни в кислой, ни в щелочной среде. Гомологи бензола окисляются сравнительно легко. Их окисление ведет к образованию ароматических кислот, причем каждая боковая цепь бензольного ядра независимо от ее длины превращается в карбрксильную группу.
В условиях опыта окисление толуола идет по уравнению:
5С6Н5СН3 + 6КMnO4 + 9H2SO4 → С6Н5COOH + 3К2SO4 + 6MnSO4 + 14H2O
Опыт № 8. Cульфирование ароматических углеводородов
В сухую пробирку помещают по 0,5-1 мл каждого из углеводородов и добавляют по 4 мл концентрированной серной кислоты. Затем все пробирки нагревают до 800С на водяной бане при частом встряхивании. Пробирку, содержащую бензол, нагревают более осторожно, чтобы не улетучился.
Углеводороды при встряхивании образуют с кислотой эмульсию и постепенно растворяются. Охлаждают все пробирки в стакане с водой. Затем выливают содержимое каждой пробирки в стакан с 10-15 мл холодной воды и отмечают, выделяется ли слой исходного углеводорода.
Ароматические углеводороды, в отличие от предельных углеводородов, легко сульфируются концентрированной кислотой, образуя сульфокислоты, хорошо растворимые в воде и обладающие сильными кислотными свойствами.
Химизм процесса:
С6Н6 + НО-SO3H → C6H5 -SO3H + H2O
бензолсульфо-
кислота
С6Н5СН3 + НО-SO3H → о-HO3S-С6Н4СН3 + п-HO3S-С6Н4СН3 + H2O
о-толуолсульфо- п-толуолсульфо-
кислота кислота
Каждая стадия реакции сульфирования обратима. Ароматические сульфокислоты подобно серной кислоте легко растворимы в воде из-за образования водородных связей.
Опыт № 9. Нитрование ароматических углеводородов
В две пробирки помещают по 2 мл нитрующей смеси, представляющей собой смесь концентрированных азотной и серной кислот в соотношении 2:1. Добавляют в них соответственно по 5-7 капель одного из углеводородов и сильно встряхивают в течение 5-10 минут. Отмечают различие хода процесса в разных пробирках. В конце опыта выливают содержимое пробирок в стаканы с 6-7 мл холодной воды.
Каким запахом обладают полученные вещества? Каковы их физические свойства? Как влияет метильный радикал на скорость реакции нитрования толуола? Составьте уравнения реакций нитрования бензола и толуола.
Опыт №10. Проба на ароматическую структуру
К 1 мл хлороформа, высушенного над СаCl2, прибавляют 2-3 капли бензола, тщательно перемешивают и пробирку слегка наклоняют, чтобы смочить стенки. Добавляют 0,5-0,6 г AlCl3 таким образом, чтобы часть порошка попала на стенки пробирки. Обращают внимание на окраску порошка на стенке и на цвет раствора.
Опыт можно повторить с другими ароматическими углеводородами – дифенилом, нафталином. В реакции с бензолом возникает красно-оранжевая окраска, дифенилом – синяя, нафталином – зеленая.
Чтобы отличить ароматические углеводороды от углеводородов жирного ряда, используют цветную реакцию углеводородов с хлороформом в присутствии хлорида аллюминия. Эта реакция сопровождается образованием окрашенных продуктов. Так, при взаимодействии бензола с хлороформом в присутствии хлорида аллюминия, кроме основного продукта реакции бесцветного трифенилметана, образуется также окрашенная комплексная соль трифенилхлорметана.
AlCl3
3С6Н6 + СНCl3 → (C6Н5)3СН + 3НСl
AlCl3
5С6Н6 + 2СНCl3 → (C6Н5)3СCl + (C6Н5)2СН2 + 5HCl
трифенилхлорметан
(C6Н5)3СCl + AlCl3 → [(C6Н5)3С)]+AlCl4
