- •Новосибирск
- •Лабораторная работа № 9. Макроскопический анализ сплавов…………..128 Лабораторная работа № 10. Микроскопический анализ сплавов…………135 Введение
- •Лабораторная работа № 1 определение твердости металлов и сплавов
- •1.1. Цель работы:
- •1.2. Теоретическое обоснование
- •Твердость по Бринеллю
- •1− Столик для центровки образца;2 − маховик; 3 − грузы; 4 − шарик; 5− электродвигатель
- •Метод Роквелла
- •Шкалы для определения твердости по Роквеллу
- •Метод Виккерса
- •1 − Столик для установки образца; 2 − маховик; 3 − шток с алмазной пирамидой;
- •4− Педаль пускового рычага;5− подвеска с призмой;6− микроскоп
- •Метод микротвердости − метод Хрущева-Берковича
- •12− Грузы;13− ручка нагружения
- •Твердомер тэмп-2
- •1.3. Оборудование и материалы для выполнения лабораторной работы
- •1.4. Порядок выполнения работы
- •1.5. Содержание отчета
- •1.6. Контрольные вопросы:
- •Литература
- •Диаграмма растяжения
- •Определение твердости материалов
- •Определение твердости по шкале Мооса
- •3.3. Порядок выполнения работы
- •3.4. Содержание отчета
- •2.3. Контрольные вопросы:
- •Лабораторная работа № 3 диаграммы состояния двойных сплавов
- •3.2. Теоретическое обоснование
- •Диаграмма с полной нерастворимостью компонентов в твердом состоянии
- •Диаграмма с полной растворимостью компонентов в твердом состоянии
- •Диаграмма состояния с ограниченной растворимостью компонентов в твердом состоянии
- •Диаграмма состояния с образованием химического соединения между компонентами
- •3.3. Порядок выполнения работы
- •3.4. Содержание отчета
- •3.5. Контрольные вопросы
- •Литература
- •Диаграмма состояния железо-углерод
- •4.3. Порядок выполнения работы
- •4.4. Содержание работы
- •4.5. Контрольные вопросы
- •Литература
- •1 Индивидуальное задание по теме «Диаграмма состояния Fe- Fe3c»
- •Контрольные вопросы для защиты задания
- •Литература
- •Классификация углеродистых сталей
- •Углеродистые конструкционные стали
- •Углеродистые инструментальные стали
- •Микроисследование углеродистой стали
- •Химический и фазовый состав сталей
- •5.3. Порядок выполнения работы:
- •5.4. Содержание отчета:
- •5.6. Контрольные вопросы:
- •Литература Лабораторная работа № 6 микроструктура и свойства чугунов
- •6.2. Теоретическое обоснование
- •Белый чугун
- •Серый чугун
- •Ковкий чугун
- •Высокопрочный чугун
- •Легированные чугуны
- •6.3. Порядок выполнения работы
- •6.4. Содержание отчета
- •6.5. Оборудование и материалы:
- •6.6. Контрольные вопросы
- •Литература
- •Лабораторная работа № 7 термическая обработка углеродистой стали
- •7.2. Теоретическое обоснование
- •7.3. Порядок выполнения работы:
- •Термообработка стали 50
- •Термообработка стали у12 (или стали у8)
- •9.4. Содержание отчета
- •9.5. Контрольные вопросы
- •Литература
- •Лабораторная работа № 8 исследование влияния термической обработки на механические свойства сплава на основе алюминия
- •8.2. Теоретическое обоснование
- •10.3. Порядок выполнения работы
- •Результаты проведенного эксперимента
- •8.4. Содержание отчета
- •8.5. Контрольные вопросы
- •Литература
- •Определение твердости по Бринеллю
- •Соотношение значений твердости, определяемых методами Бринелля и Роквелла
- •Соотношение значений твердости, определяемых разными методами
- •Химический состав (%) и некоторые свойства деформируемых и литейных сплавов на основе алюминия
- •Рекомендуемая литература Основная
- •Дополнительная и справочная
- •Лабораторная работа 9 макроскопический анализ сплавов
- •1.2. Теоретическое обоснование
- •Макроскопическое исследование металла, обработанного давлением
- •1.3. Порядок выполнения работы
- •1.4. Содержание отчета
- •1.5. Контрольные вопросы
- •Литература
- •Лабораторная работа № 10 микроскопический анализ (микроанализ)
- •2.2. Теоретическое обоснование
- •Основные характеристики полировальных алмазных паст
- •Последовательность работы на микроскопе
- •Определение величины зерна в стали
- •Характеристики структуры стали с разной величиной баллов
- •Пересчет номера зерна на стандартное увеличение (100×) при использовании увеличений от 25× до 800×
- •Изучение неметаллических включений
- •2.3. Порядок выполнения работы
- •2.4. Методические указания
- •2.5.Содержание отчета
- •2.6. Контрольные вопросы
- •Литература
- •Травление микрошлифов
3.3. Порядок выполнения работы
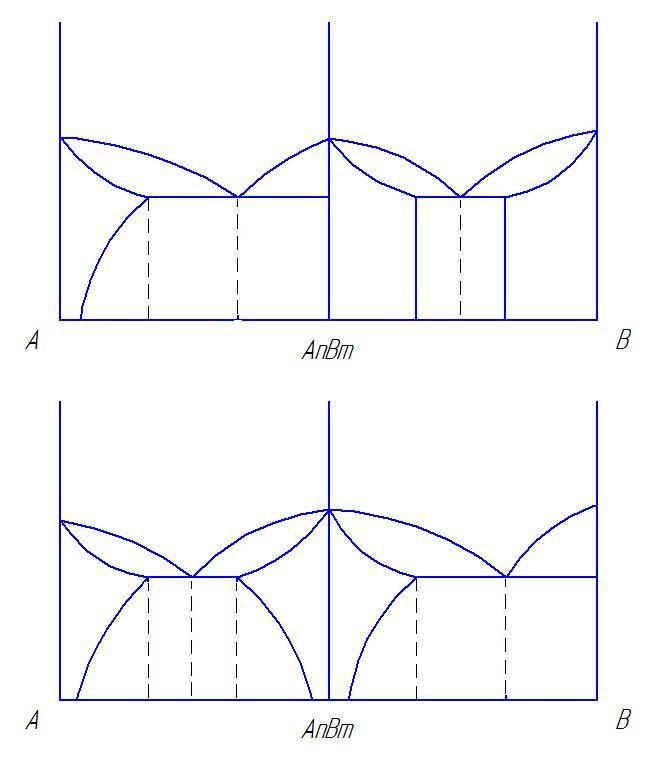
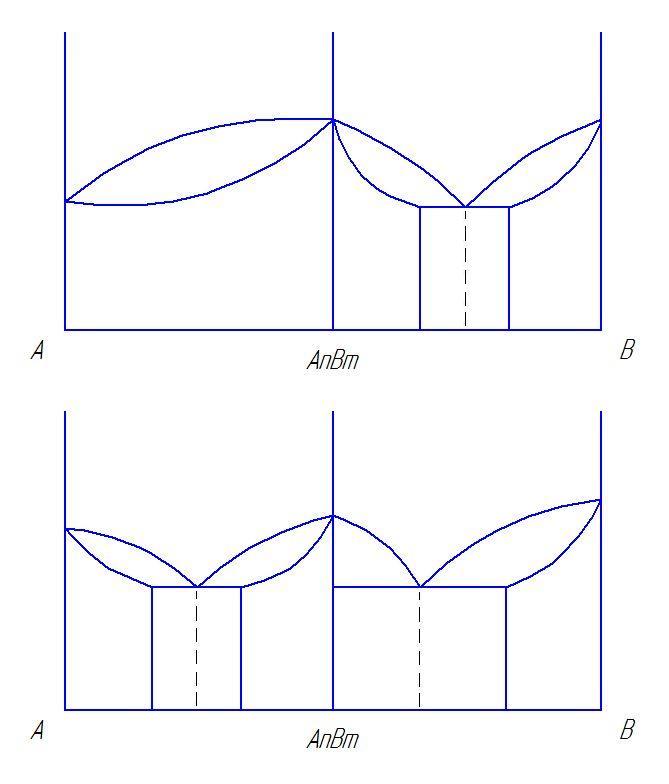
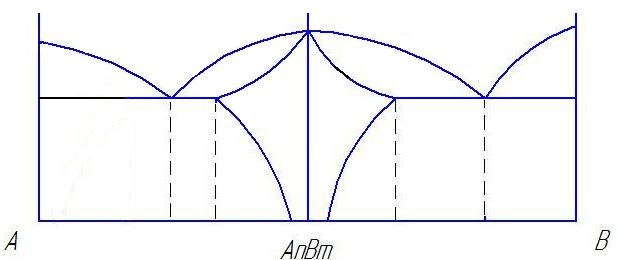
Вычертить предложенную преподавателем диаграмму состояния, оставив рядом место для построения кривых охлаждения. Расписать области диаграммы, т.е. в каждой области диаграммы состояния указать структуры, образующие в сплавах этой системы.
Определить тип представленной диаграммы?
Определить образующиеся структуры и значения линий диаграммы состояния (ликвидус, солидус, линии полимофных превращений, предельной растворимости избыточных фаз, эвтектического превращения).
Для заданного сплава построить кривую охлаждения и объяснить происходящие в ней структурные изменения. Для указанного сплава при данной температуре определить фазы, их химический состав и весовое количество.
Сравнить механические и технологические свойства сплавов с различной структурой.
Прочитайте внимательно основные сведения о диаграммах состояния сплавов.
Индивидуальный вопрос.
Составить отчет.
3.4. Содержание отчета
Название, цель работы, задание.
Диаграмма состояния.
Кривые охлаждения.
Ответы на вопросы, поставленные в задании.
Ответ на индивидуальный вопрос.
Литература.
3.5. Контрольные вопросы
Твердые растворы замещения, внедрения, упорядоченные.
Химические соединения и промежуточные фазы.
Линии и структуры в диаграмме состояния сплавов с неограниченной растворимостью компонентов.
Диаграмма состояния сплавов, кристаллизующихся с образованием механической смеси из чистых компонентов.
Диаграмма состояния с ограниченной растворимостью компонентов и с эвтектикой.
Диаграмма состояния с устойчивым химическим соединением.
Что такое эвтектическое превращение?
Правило отрезков.
Как определить химический состав (концентрацию) фаз, находящихся в равновесии в двухфазной области?
Варианты заданий
|
Вариант 1 |
|
Вариант 8 |
|
|
Вариант 2 |
|
Вариант 9 |
|
|
Вариант 3 |
|
Вариант 10 |
|
|
Вариант 4 |
|
Вариант 11 |
|
|
Вариант 5 |
|
Вариант 12 |
|
|
Вариант 6 |
|
Вариант 13 |
|
|
Вариант 7 |
|
Вариант 14 |
|
|
Вариант 15 |
|
Вариант 21 |
|
|
Вариант 16 |
|
Вариант 22 |
|
|
Вариант 17 |
|
Вариант 23 |
|
|
Вариант 18 |
|
Вариант 24 |
|
|
Вариант 19 |
|
Вариант 25 |
|
|
Вариант 20 |
|
Вариант 26 |
|
|
Вариант 21 |
|
Вариант 27 |
|
Литература
Гуляев А.П. Металловедение. М.,1977.
Лахтин Ю.И. Металловедение и термическая обработка металлов. М.,1976.
2. Основы материаловедения под ред.И.Й. Сидорина. М.,1976.
3. Мозберг Р.К. Материаловедение. Таллин. 1976.
Лабораторная работа № 4
ДИАГРАММА СОСТОЯНИЯ ЖЕЛЕЗО–УГЛЕРОД
4.1. Цель работы:
− изучить диаграмму состояния железо-углерод;
− изучить микроструктуры углеродистых сталей в равновесном (отожженном) состоянии. Установить зависимость между структурами и механическими свойствами углеродистых сталей.
− изучить микроструктуры белых, серых, высокопрочных и ковких чугунов.
− установить зависимость между составом, условиями получения, структурами и механическими свойствами чугунов.
4.2 Теоретическое обоснование
Компоненты и фазы в сплавах железа с углеродом
Железо − металл сероватого цвета, плотность 7,86 г/см3. Температура плавления − 1539 °С. Чистое лабораторное железо содержит не более 10-4 % примесей, технически чистое железо − 0,15 % примесей.
Полиморфизм − свойство вещества или материла изменять свою кристаллическую решетку при изменении температуры.
Железо имеет три полиморфные модификации α, γ и δ.
Модификация α существует при температурах ниже 911 °С. Кристаллическая решетка Feα – объемно-центрированный куб (ОЦК) с периодом решетки 0,28606 нм. Плотность Feα 7,68 мг/м3.
Вторая модификация Feγ существует при температуре 911-1392 °С. Кристаллическая решетка − гранецентрированная кубическая (ГЦК) с периодом 0,3645 нм.
В интервале 1392-1539 °С существует третья модификация − Feδ с кристаллической решеткой объемно-центрированного куба (ОЦК) с периодом решетки 0,293 нм.
Кристаллические формы Feα и Feγ существуют при нормальном атмосферном давлении. Появление третьей Feδ возможно лишь при действии значительных давлений и повышенных температур.
Углерод − неметаллический элемент II периода IV группы периодической системы, атомный номер 6, плотность 2,5 мг/м3 , температура плавления 3500 °С, атомный радиус 0,077 нм. Углерод, как и железо, обладает полиморфизмом. В обычных условиях он находится в виде модификации графита с гексагональной слоистой решеткой. Модификацию углерода в виде алмаза при обычных температурах и давлениях получить невозможно.
В системе железо-углерод различают следующие фазы:
− жидкий расплав;
− твердые растворы: α-феррит, β-феррит и аустенит, а также цементит и графит.
Феррит (Ф) − твердый раствор углерода и других примесей в ОЦК-решетке железа. Атом углерода располагается в решетке феррита в центре грани куба, где помещается сфера радиусом 0,031 нм, а также в дефектах кристаллической решетки. Предельная растворимость углерода в Feα − 0,02 % при температуре 727 оС и менее 0,01 % при комнатной температуре, растворимость Feδ − 0,1 %. Под микроскопом феррит выявляется в виде однородных полиэдрических (многогранных) зерен. Твердость и прочность феррита невысоки (σв=250 МПа, НВ 800 МПа).
Аустенит (А) − твердый раствор углерода и других примесей в Feγ. Атом углерода располагается в центре куба, где может размещаться сфера радиусом 0,051 нм, и в дефектных областях кристалла. Предельная растворимость углерода в Feγ составляет 2,14 % при температуре 1147 оС и 0,8 % при 727 оС.
Цементит (Ц) − химическое соединение железа с углеродом − карбид железа Fe3C, содержащий 6,67 % С. Цементит имеет сложную ромбическую решетку с плотной упаковкой атомов. Температура плавления цементита точно не определена (≈ 1260 °С). Цементит имеет высокую твердость (НВ 8000 МПа) и очень малую пластичность (δ ≈ 0 %).
Графит (Г) имеет гексагональную слоистую кристаллическую решетку.
Межатомные расстояния в слоях небольшие (0,142 нм), расстояние между плоскостями − 0,340 нм. Графит мягок, обладает низкой прочностью.