
- •Предисловие
- •Глава 1. Аминокислоты и белки
- •1.1 Общая характеристика
- •1.2 Классификация аминокислот
- •1.3 Модификация аминокислот
- •1.4 Ионизация аминокислот
- •1.5 Пептидная связь
- •1.6 Пептиды и белки
- •1.7 Функции белков
- •1.8 Уровни структурной организации белков
- •А Первичная структура белка
- •Б Вторичная структура белка
- •В Третичная структура белка
- •Д Четвертичная структура белка
- •1.9 Глобулярные и фибриллярные белки
- •А Кератин
- •1.10 Простые и сложные белки
- •1.11 Денатурация и ренатурация белков
- •1.12 Методы работы с белками
- •А Очистка и выделение белка
- •Б Высаливание
- •В Диализ
- •Д Аналитические методы работы с белками
- •Термины
- •Вопросы к семинарскому занятию (1-я часть)
- •Вопросы к семинарскому занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- • Аминокислоты
- •Вопросы для самопроверки
- •Глава 2. Ферменты
- •2.1 Общая характеристика
- •2.2 Номенклатура ферментов
- •2.3 Свойства ферментов
- •2.4 Строение фермента
- •2.5 Специфичность ферментов
- •А Модель «ключ-замок»
- •Б Модель индуцированного соответствия
- •2.7 Термодинамика ферментативных реакций
- •2.8 Кинетика ферментативных реакций
- •А Вывод уравнения Михаэлиса-Ментен (по Бергу)
- •В Уравнение Лайнуивера-Берка
- •2.9 Механизмы ферментативного катализа
- •2.10 Влияние факторов среды на скорость протекания ферментативной реакции
- •А Концентрация субстрата
- •2.12 Мультисубстратные реакции
- •А Последовательный механизм
- •2.13 Ингибирование ферментов
- •Б Бесконкурентные ингибиторы
- •В Неконкурентные ингибиторы
- •2.14 Кооперативные взаимодействия внутри молекул ферментов
- •А Параллельная модель
- •2.15 Аллостерическая регуляция активности ферментов
- •2.16 Регуляция активности ферментов с помощью ковалентной модификации
- •2.17 Анти-, мульти- и изоферменты
- •2.18 Ферменты в медицине
- •А Энзимодиагностика
- •Термины
- •Вопросы к занятию (1-я часть)
- •Вопросы к занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 3. Нуклеиновые кислоты
- •3.1 Общая характеристика
- •3.2 Строение нуклеотида
- •3.3 Первичная структура ДНК
- •3.4 Вторичная структура ДНК
- •3.5 Денатурация и ренатурация ДНК
- •3.6 Третичная структура ДНК
- •3.7 Четвертичная структура ДНК
- •3.8 Виды РНК и их функции
- •3.9 Первичная структура РНК
- •3.10 Вторичная структура РНК
- •3.11 Третичная структура РНК
- •3.12 Четвертичная структура РНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 4. Репликация
- •4.1 Общая характеристика
- •4.2 Инициация репликации у прокариот
- •4.3 Элонгация репликации у прокариот
- •Б Механизм ферментативной реакции
- •4.4 Терминация репликации у прокариот
- •4.5 Репликация у эукариот
- •4.6 Проблемы репликации
- •Б Проблема высокой точности процесса
- •4.7 Плазмиды
- •В Типы плазмид
- •Д Механизмы репликации кольцевых плазмид
- •4.8 Репликация вирусов
- •Б Репликация генома РНК-вирусов
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 5. Транскрипция
- •5.1 Организация генетической информации
- •5.2 Общая характеристика транскрипции
- •5.3 Гипотеза Жакоба и Моно
- •5.4 Строение РНК-полимераз
- •5.5 Инициация транскрипции у прокариот
- •5.6 Элонгация транскрипции у прокариот
- •5.7 Терминация транскрипции у прокариот
- •5.8 Инициация транскрипции у эукариот
- •5.9 Элонгация транскрипции у эукариот
- •5.10 Терминация транскрипции у эукариот
- •А Кэпирование
- •Б Полиаденилирование
- •В Сплайсинг
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 6. Трансляция
- •6.1 Общая характеристика
- •6.2 Свойства генетического кода
- •6.3 Основные этапы биосинтеза белка
- •А Этап 1. Активация аминокислот
- •Д Этап 5. Фолдинг и посттрансляционная модификация
- •6.4 Рибосомы
- •6.5 Инициация у прокариот
- •6.6 Инициация у эукариот
- •6.7 Элонгация у прокариот
- •6.8 Элонгация у эукариот
- •6.9 Терминация у прокариот
- •6.10 Терминация у эукариот
- •6.11 Гипотеза «качания»
- •6.12 Фолдинг и посттрансляционная модификация белков
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 7. Регуляция биосинтеза белка
- •7.1 Регуляция экспрессии генов у прокариот
- •В Катаболическая репрессия. Лактозный оперон
- •Д Аттенуация. Триптофановый оперон
- •Е «Сильные» и «слабые» промоторы
- •Ж σ-Субъединица РНК-полимеразы
- •7.2 Регуляция экспрессии генов у эукариот
- •Хроматин-перестраивающие комплексы
- •Архитектурные белки высокомобильной группы
- •Ковалентная модификация гистонов
- •Метилирование ДНК
- •В Регуляция с помощью факторов транскрипции
- •7.3 Регуляция на уровне трансляции у про- и эукариот
- •А Дискриминация мРНК
- •Б Трансляционная репрессия
- •7.4 Другие механизмы регуляции у эукариот
- •Б РНК-интерференция
- •Интерференция с помощью малых интерферирующих РНК
- •Интерференция с помощью микроРНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Регуляция на уровне транскрипции (прокариоты)
- •Вопросы для самопроверки
- •Глава 8. Мутации и репарация
- •8.1 Мутации
- •8.2 Классификация мутаций по вызвавшим их причинам
- •8.3 Классификация мутаций по степени изменений генома
- •8.4 Классическая классификация
- •8.5 Репарация
- •А Прямая репарация
- •8.6 Эксцизионная репарация оснований (BER)
- •8.7 Эксцизионная репарация нуклеотидов (NER)
- •8.8 Мисметч репарация
- •8.9 Репарация двунитевых разрывов
- •8.10 Негомологичное соединение цепей ДНК при двунитевых разрывах
- •8.11 SOS-репарация (SOS-ответ)
- •8.12 Рекомбинационная репарация
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 9. Иммунитет и антитела
- •9.1 Иммунитет: его виды и элементы
- •9.2 Врожденный (неспецифический) иммунитет
- •В Химические медиаторы врожденного иимунитета
- •Е Классический путь активации комплемента
- •Ж Альтернативный путь активации комплемента
- •З Активация терминальных компонентов комплемента
- •И Как фагоциты отличают чужеродные клетки от «своих»?
- •9.3 Приобретенный (специфический) иммунитет
- •А T-лимфоциты
- •В Антитела
- •Е Вторичный иммунный ответ
- •Ж Активация гуморального иммунитета
- •9.4 Группы крови
- •9.5 Трансфузионные реакции
- •9.6 Правила переливания
- •9.7 Резус-фактор (Rh)
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 10. Биологические мембраны
- •10.1 Строение биомембран
- •В Липиды биомембран
- •10.2 Функции мембран
- •10.3 Мембранный транспорт
- •10.4 Эндо- и экзоцитоз
- •10.5 Трансмембранная передача сигнала
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 11. Энергетический обмен
- •11.1 Энергия в клетке
- •11.2 Дыхательная цепь митохондрий
- •11.3 Сопряжение дыхания и окислительного фосфорилирования
- •11.4 Разобщение дыхания и окислительного фосфорилирования
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 12. Введение в метаболизм
- •12.1 Общая характеристика
- •А Метаболические пути
- •Б Метаболиты
- •В Гомеостаз
- •12.2 Функции метаболических путей
- •А Образование энергии
- •Б Катаболизм органических соединений
- •Переваривание
- •Гликолиз
- •Окисление жирных кислот
- •Катаболизм аминокислот
- •В Синтез органических соединений и предшественников макромолекул
- •Глюконеогенез: синтез глюкозы
- •Синтез жирных кислот
- •Синтез гема
- •Креатинфосфат
- •Гликоген
- •Жиры или триацилглицеролы
- •Д Выведение потенциально опасных соединений
- •Цикл мочевины
- •Синтез желчных кислот
- •Катаболизм гема
- •Е Образование регуляторных молекул
- •12.3 Ключевые положения всех метаболических путей
- •А АТФ — донор энергии для синтеза
- •В Эссенциальные органические соединения
- •Д Взаимосвязи метаболических путей
- •Е Нелинейность метаболических путей
- •Ж Локализация метаболических путей в клетке
- •З Тканеспецифичность метаболических путей
- •И Метаболизм при голодании
- •12.4 Интеграция метаболизма
- •А Основные физиологические состояния организма и роль различных органов в интеграции метаболизма
- •Состояние насыщения
- •Состояние голодания
- •Б Интеграция метаболизма в различных физиологических состояниях
- •Состояние голодания
- •Продолжительное голодание
- •Состояние насыщения
- •Физические нагрузки
- •В Регуляция метаболизма
- •Инсулин
- •Глюкагон
- •Адреналин
- •Гидрокортизон
- •Адипоцитокины
- •Рекомендуемая литература
- •Приложение 1. Аминокислоты и белки
- •Классификация аминокислот
- •Приложение 2. Ферменты
- •Строение химотрипсина
- •Приложение 3. Нуклеиновые кислоты
- •Приложение 4. Репликация
- •Приложение 5. Транскрипция
- •Приложение 6. Трансляция
- •Приложение 7. Регуляция биосинтеза белка
- •Приложение 8. Мутации и репарация
- •Приложение 9. Иммунитет и антитела
- •Приложение 10. Биологические мембраны
- •Приложение 11. Энергетический обмен
- •Оглавление

133
Глава 7. Регуляция биосинтеза белка
7.1Регуляция экспрессии генов у прокариот
АОбщая характеристика
Регуляция экспрессии генов у прокариот осуществляется в основном на уровне транскрипции. Возможно, это связано с тем, что прокариотические мРНК имеют короткий «срок жизни» — всего несколько минут.
В большинстве случаев прокариоты используют негативную регуляцию с помощью ген-специфичных репрессоров, которые связываются с промоторами структурных генов. Все белки прокариот (в т.ч. и ферменты) можно разделить на конститу-
тивные и регулируемого синтеза.
Конститутивные белки синтезируются постоянно в любых условиях. Их количество не изменяется в процессе жизнедеятельности клетки или при изменении условий окружающей среды. Клетка «считает», что эти ферменты будут нужны ей всегда, поэтому кодирующие их гены постоянно экспрессируются («включены»). Пример: ферменты, метаболизирующие глюкозу.
Клетка затрачивает значительные ресурсы на синтез белков, поэтому ей не выгодно синтезировать белок, если в данный момент он ей не нужен. Обеспечить экономию позволяет наличие белков регулируемого синтеза. Клетка может изменять скорость их синтеза и концентрацию (иногда в тысячи раз) в соответствии со своими нуждами. Таким образом, синтезируются только те белки (ферменты), которые необходимы клетке в данных условиях. Белки регулируемого синтеза можно разделить на две группы:
1.В случае индуцибельных белков регуляция направлена на «включение» синтеза ранее не требовавшегося фермента, когда в нем возникла необходимость. «Включение» синтеза белка называется индукцией, а «включающее» синтез химическое вещество — индуктором (или депрессором). Индуктор реагирует с репрессором, инактивируя его. Как правило, индуцибельными являются ферменты катаболических путей (сбраживание сахаров, распад аминокислот и др.).
2.В случае репрессируемых белков цель регуляции — прекращение (репрессия) их синтеза. Обычно репрессируемыми являются ферменты анаболизма (синтеза аминокислот, азотистых оснований и т.д.).
БИндукция. Лактозный оперон
Лактозный оперон (lac-оперон) — это оперон кишечной палочки (E. coli), содержащий три структурных гена lacZ, lacY, lacA, которые кодируют 3 белка: β -галак-
тозидазу, галактозидпермеазу, тиогалактозид-трансацетилазу. Эти белки участвуют в усвоении лактозы кишечной палочкой: они транспортируют её в клетку и расщепляют на глюкозу и галактозу, которые далее включаются в гликолиз.

134 Глава 7 Регуляция биосинтеза белка
Оперон может находиться в двух состояниях: активном (включён) и неактивном (выключен). В норме (при отсутствии лактозы в среде) лактоз-
ный оперон неактивен (выключен):
промотор оперона блокирован lac- репрессором — этот белок препятствует транскрипции, поскольку не даёт РНК-полимеразе возможности корректно начать её (связаться с промотором полимераза всё-таки может, как было показано в последние годы)
(см. Рис. 88 ).
Как только лактоза появляется в среде, она попадает в клетку и связывается с lac-репрессором. Это меняет его конформацию, он становится неактивен, утрачивает своё сродство к промотору и отщепляется. Lac-оперон включается и на нём начинается транскрипция, а затем происходит трансляция мРНК на белок (см. Рис. 89 ). Синтезированные ферменты помогают клетке «усвоить» лактозу:
1.Галактозидпермеаза служит мембранным переносчиком лактозы в клетку (ускоряет её перенос в разы);
2.β-Галактозидаза расщепляет лактозу до глюкозы и галактозы, которые затем включаются в гликолиз.
3.Тиогалактозид-трансацетилаза переносит ацетильную группу с аце- тил-КоА на β-галактозиды. Её функция в контексте lac-оперона ещё недостаточно изучена. Есть гипотеза, что этот фермент обезвреживает неметаболизируемые пиранозиды, ацетилируя их.
Вэтом механизме регуляции — индукции — лактоза является индуктором, в отсутствии неё репрессор выключает транскрипцию на опероне. Такую регуляцию называют негативной.
Рис. 89. Активация лактозного оперона: лактоза появляется в среде, связывается с репрессором, выключает его, начинается транскрипция и трансляция lac-оперона.

Регуляция экспрессии генов у прокариот 135
В Катаболическая репрессия. Лактозный оперон
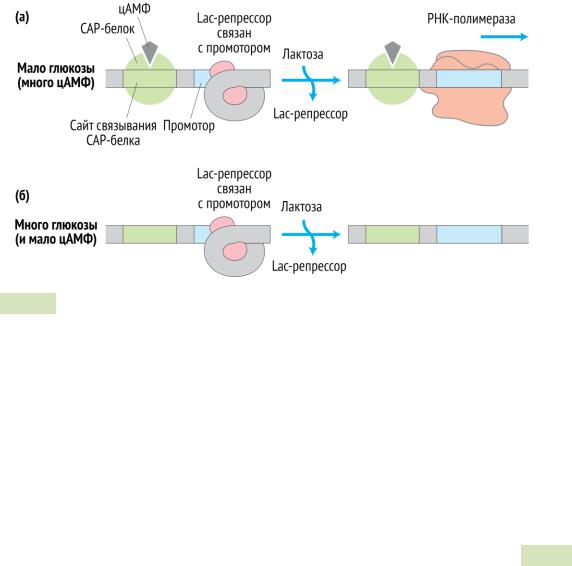
Помимо индукции, у кишечной палочки существует механизм позитивной регуляции — катаболическая репрессия (см. Рис. 90 ▼). Клетки кишечной палочки
E.coli способны усваивать как глюкозу, так и лактозу. Возможны два случая:
1.В среде есть глюкоза и лактоза. Глюкозы вполне достаточно, чтобы снабжать клетку энергией, поэтому в усвоении лактозы нет необходимости. Поэтому транскрипция на lac-опероне должна быть выключена, чтобы клетка не тратила ресурсы. Такой эффект достигается с помощью осо-
бого белка — CAP (англ. catabolite gene activator protein). CAP связыва-
ется с цАМФ и образует комплекс CAP + цАМФ. Этот комплекс присоединяется к промотору lac-оперона и помогает РНК-полимеразе начать транскрипцию. Однако, если в клетке достаточно глюкозы, концентрация цАМФ низкая12, комплекс CAP + цАМФ не образуется и активации транскрипции не происходит.
2.В среде есть только лактоза. Концентрация цАМФ повышается, он связывается с CAP-белком и образует активный комплекс CAP + цАМФ. Комплекс присоединяется к промотору и «усиливает» его. Транскрипция на lac-опероне начинается. Синтезируемые белки усваивают лактозу.
12Концентрация цАМФ у кишечной палочки E. coli регулируется с помощью фосфотрансферазной системы. Она служит для переноса моносахаридов в клетку и их фосфорилирования (это препятствует обратному выходу сахара из клетки, поскольку фосфорилированные моносахариды имеют отрицательный заряд и не «пропускаются» клеточной мембраной). Если глюкозы много, белок EIIA фосфотрансферазной системы находится в дефосфорилированном состоянии (остаток фосфорной кислоты переносится с него на глюкозу, в результате сам белок дефосфорилирован) и ингибирует аденилатциклазу (синтезирующую цАМФ) и галактозидпермеазу (транспортёр лактозы в клетку). Если глюкозы много, белок EIIA фосфорилирован и не может ингибировать эти ферменты. Концентрация цАМФ в таком случае вырастает.
136 |
Глава 7 |
Регуляция биосинтеза белка |
Рис. 90. Схема катаболической репрессии (слева — до появления лактозы, справа
— после её появления). А) Если глюкозы в клетке мало, концентрация цАМФ высока. Молекулы цАМФ связываются с CAP-белком, образуя комплекс CAP + цАМФ. Этот комплекс присоединяется к промотору и «усиливает» его. Транскрипция на lac- опероне начинается. Б) Если глюкозы в клетке много, концентрация цАМФ низкая. Комплексов CAP + цАМФ почти не образуется, и транскрипция на lac-опероне не идёт, поскольку промотор этого оперона «слабый», и сродство РНК-полимеразы к нему низкое.
ГРепрессия. Триптофановый оперон
Триптофановый оперон (trp-оперон) — это оперон кишечной палочки E. coli,
кодирующий 5 полипептидных цепей, которые затем образуют 3 белка (см. Рис. 91 ▼).
Эти белки синтезируют триптофан из хоризмовой кислоты:
1.Антранилатсинтаза;
2.N-(5’-фосфорибозил)-антранилатизомераза и индол 3-глицеролфос-
фатсинтаза (комплексный фермент с двумя активными центрами);
3.Триптофансинтаза.
Внорме триптофановый оперон включён: на нём идёт транскрипция, trp- репрессор синтезируется неактивным (в отличие от lac-репрессора, который после синтеза сразу активен). Как только белки, кодируемые trp-опероном, синтезируют избыток триптофана, его молекулы соединяются с trp-репрессором и активируют его. Комплекс trp-репрессор + триптофан связывается с оператором trp-оперона и снижается частоту транскрипции на нём примерно в 70 раз. Как только концентрация триптофана в среде снова снижается, trp-репрессор переходит в неактивное состояние, и транскрипция на trp-опероне возобновляется.
Вэтом механизме регуляции — репрессии — триптофан является корепрессором. Репрессия trp-оперона — другой пример негативной регуляции.
