
Министерство образования и науки РФ ФБГОУ ВПО Ульяновский государственный университет Институт медицины, экологии и физической культуры
Биологическая химия
Учебно-методическое пособие для студентов медицинского факультета
(первый семестр)
Ульяновск 2013
УДК 577.2 ББК 28.072
Рецензент: …
Терпиловский, М.А. Учебно-методическое пособие по биологической химии / М.А. Терпиловский. — Ульяновск: УлГУ, 2013. — 198 с.
Учебно-методическое пособие подготовлено в соответствии с рабочей программой по биологической химии и содержит общую информацию по всему курсу дисциплины, включая введение к каждой теме, основные термины, а также вопросы к семинарским занятиям с разъяснениями.
Предназначено для студентов медицинского факультета специальностей 060101 «Лечебное дело», 060103 «Педиатрия» и 060301 «Фармация».
© Терпиловский М.А. Ульяновский государственный университет, 2013 г.
2

Биологическая химия — одна из базовых дисциплин в подготовке студентов по медицинским специальностям. Целью её изучения является приобретение умений и навыков применять сведения о строении, химическом составе и обмене веществ клеток организма человека при освоении последующих дисциплин и для профессиональной деятельности.
Всостав современной биохимии входят следующие основные разделы: статическая биохимия, динамическая биохимия, основы биотехнологии, функциональная биохимия, патологическая и медицинская биохимия, фармацевтическая биохимия.
Биологическая химия изучается согласно программе во II и III семестрах. Настоящее пособие составлено в соответствии с программой по биологической химии для студентов, обучающихся по специальностям «Лечебное дело» и «Педиатрия».
Во II семестре изучаются темы: «Аминокислоты и белки», «Ферменты», «Нуклеиновые кислоты», «Репликация», «Транскрипция», «Трансляция», «Регуляция биосинтеза белка», «Мутации и репарация», «Иммунитет и антитела», «Биологические мембраны и транспорт веществ» и «Энергетический обмен».
ВIII семестре изучаются темы: «Введение в обмен углеводов», «Глюконеогенез и обмен гликогена», «Пентозофосфатный путь и путь уроновых кислот», «Нарушения обмена углеводов», «Общий путь катаболизма», «Обмен липидов», «Обмен нуклеиновых кислот», «Обмен аминокислот и белков», «Гормоны», «Вод- но-солевой обмен», «Биохимия крови», «Биохимия соединительной ткани», «Биохимия мышц», «Биохимия нервной ткани».
На практических занятиях проводятся лабораторные работы по темам, осуществляется разбор лекционного материала и контроль знаний студентов (устный и письменный). В течение семестра осуществляется проверка результатов и оформления лабораторных работ. Студенты изучают теоретические основы тем и сдают письменные контрольные работы. На усмотрение преподавателя студенты получают темы рефератов для последующей их сдачи.
3

Аминокислоты — это органические соединения, содержащие карбоксильную группу (–COOH), аминную группу (NH2–) и боковую цепь — радикал (R-группа) (см. Рис. 1). Их назвали так потому, что они являются аминопроизводными карбоновых кислот. Аминокислоты — мономеры, из которых состоят белки. Различия между аминокислотами объясняются свойствами их радикалов. Все аминокислоты кроме глицина существуют в двух формах — L- и D- форме. Эти стереоизомеры являются зеркальными отражениями друг друга и отличаются положением атомов в пространстве. В белках обнаруживают, как
правило, лишь L-аминокислоты, однако в природе существуют и D- аминокислоты.
Аминокислоты классифицируют исходя из свойств их боковых цепей: полярности и наличия кислых или осно́вных групп в составе самого радикала (см. Приложение 1).
1.К первой группе относят аминокислоты с неполярными радикалами; их боковые цепи имеют алифатическую или ароматическую природу: глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан и метионин.
2.Во вторую группу входят аминокислоты с электронейтральными радикалами, содержащими атомы кислорода, азота или серы: се-
рин, треонин, тирозин, цистеин, глутамин и аспарагин.
3.Третью группу составляют аминокислоты, имеющие карбоксильную группу в составе радикала — глутаминовая кислота (глута-
мат) и аспарагиновая кислота (аспартат).
4.В четвертую группу включены аминокислоты с осно́вными боковыми цепями (имеющими положительный заряд при физиологи-
ческих pH) — гистидин, лизин, аргинин.
Некоторые радикалы аминокислот подвергаются химическим изменениям уже после синтеза белковой молекулы (т.н. посттрансляционная модификация). Производные аминокислот выполняют функции нейро-
медиаторов: серотонин (триптофан), адреналин и дофамин (тирозин),
ацетилхолин (серин), ГАМК (глутаминовая кислота).
4

В свободных аминокислотах при нейтральных значениях pH (около 7) карбоксильная группа имеет отрицательный заряд (проявляет свойства кислот, т.е. отдаёт протон), а аминная группа — положительный (проявляет свойства оснований, т.е. принимает протон) (см. Рис. 2). Аминокислоты, не имеющие заряженных радикалов, находятся в нейтральном растворе в форме цвиттерионов (т.е. не заряжены за счет того, что отрицательный заряд карбоксильной группы скомпенсирован положительным зарядом аминной группы).
Рис. 2. Ионизация аминокислоты при pH = 7.
В белках аминокислотные остатки связаны между собой с помощью пептидных связей (разновидность ковалентных амидных связей), в образовании которых участвуют карбоксильная группа одной аминокислоты и аминогруппа другой (см. Рис. 3 и Рис. 4). Радикалы аминокислот, как правило, не принимают участие в образовании пептидных связей, однако есть и исключения. Пептидная группа имеет плоский жёсткий характер, обусловленный свойствами самой пептидной связи (вращение вокруг связи C—N затруднено). Эта особенность определяет трехмерную структуру пептидов и белков.
Рис. 3. Пептидная связь
Рис. 4. Образование пептидной связи между двумя аминокислотами
5

Различают пептиды и белки: первые, как правило, имеют от 2 до нескольких десятков аминокислотных остатков в цепи и не способны выполнять ряд функций белков; белки имеют от нескольких десятков и более аминокислотных остатков в цепи и выполняют самые разнообразные функции в организме человека. Кроме того, белки часто называют полипептидами, и это не ошибка. Важно помнить, что полипептид — соединение, состоящее из аминокислотных остатков, связанных между собой пептидными связями, поэтому не все полипептиды — белки.
Белки выполняют множество различных функций:
1.Каталитическая: белки, катализирующие химические реакции, называют ферментами. Примеры:
—Гидролазы расщепляют макромолекулы до простых соединений.
—Протеазы расщепляют белки.
—Полимеразы синтезируют полинуклеотидные цепи (ДНК и РНК).
—Киназы фосфорилируют сахара и белки.
2.Защитная: белки участвуют в иммунных реакциях и защищают организм от чужеродных вторжений или служат средством нападения:
—Токсины, содержащиеся в змеином яде, парализуют нервную систему добычи.
—Иммуноглобулины связывают чужеродные белки и клетки и помечают их для уничтожения клетками иммунной системы.
—Клеточные поверхностные антигены (белки главного комплекса гистосовместимости) отвечают за узнавание соб-
ственных клеток организма клетками иммунной системы.
3.Транспортная: белки можно разделить на мембранные и циркулирующие транспортеры. К мембранным относятся:
—Na+–K+-АТФаза выкачивает Na+ из клетки и закачивает внутрь K+.
—H+-АТФаза перекачивает через мембрану протоны H+.
—ГЛЮТ-белки переносят глюкозу из крови в клетки. Циркулирующими транспортерами являются:
—гемоглобин содержится в эритроцитах, переносит O2 и CO2.
—миоглобин содержится в мышцах, переносит O2 и CO2.
—цитохромы переносят электроны.
6

4.Структурная: фибриллярные белки являются важным компонентом тела человека — коллаген входит в состав сухожилий, кератин — волос и ногтей, а фибрин — тромбов.
5.Сократительная: белки актин и миозин отвечают за сокращение мышечных волокон.
6.Регуляторная: белки регулируют самые различные процессы в организме. Например:
—Осмотическое давление регулируется плазменными альбуминами.
—Экспрессия генов находится под контролем большого количества белков. Пример: lac-репрессор у E. coli.
—Гормональная регуляция осуществляется белками-
гормонами. Примеры: инсулин понижает концентрацию глюкозы в крови, стимулируя её захват мышечной и жировой тканями; вазопрессин стимулирует реабсорбцию воды почками и понижает диурез; окситоцин вызывает сокращения матки и выделение молока.
7.Запасающая: белки способны связывать ионы и участвовать в их запасании в организме:
—Ферритин связывает ~4500 ионов железа (Fe3+).
—Казеин (белок молока) связывает ионы кальция Ca2+ и фосфора (в виде PO43–).
—Кальмодулин связывает ионы кальция Ca2+.
8.Энергетическая: белки распадаются до аминокислот, которые включаются в метаболизм и усваиваются с помощью соответствующих метаболических путей и циклов (ЦТК и кетогенез).
Выделяют 4 уровня структурной организации белков: первичный, вторичный, третичный и четвертичный.
Первичная структура белков представляет собой цепь аминокислот-
ных остатков, связанных между собой пептидными связями:
— Аланин — Валин — Треонин — Аспарагин —
Разработаны методы определения первичной структуры белков (т.е. последовательности аминокислот). От первичной структуры — т.е. от порядка аминокислотных остатков в цепи — зависит трехмерная структура белка (его конформация). Хорошей иллюстрацией к вышесказанному служит серповидноклеточная анемия — заболевание, вызванное измене-
7

нием одного аминокислотного остатка в двух из четырёх полипептидных цепей гемоглобина.
Вторичная структура белка пред-
ставляет собой пространственную структуру, образующуюся в результате взаимодействий между атомами пеп-
тидных групп. Два основных вида вторичных структур — α-спираль и β-
структура (или β-лист)
α-Спираль стабилизируется с помощью водородных связей между атомами кислорода и азота пептидной
группы внутри одной полипептидной цепи (см. Рис. 5 и Рис. 6). Водородные связи параллельны оси вращения спирали. Конформация спирали допускает линейное расположение атомов, между которыми возникают водородные связи. Это придаёт связям и самой спирали прочность и стабильность.
Рис. 5. α-Спираль и её параметры
8

Рис. 6. Схема образования водородных связей в α-спиралях: CO-группа ами-
нокислотного остатка i образует водородную связь с NH-группой остатка i + 4.
Расположение атомов в β-листе отличается от положения атомов в α-спирали (см. Рис. 7). Пептидная цепь в β- листе почти целиком вытянута. Водородные связи могут возникать между атомами внутри одной полипептидной цепи или между атомами разных цепей. β-Листы имеют зигзагообразную структуру. Водородные связи перпендикулярны (или почти перпендикулярны, как в случае параллельных β-листов) направлению пептидной цепи, а не параллельны, как в α- спиралях.
—Аминокислоты, образующие α-спирали:
аланин, глутамат, глутамин, лизин, аргинин, метионин, лейцин, аспарагин, аспартат.
Рис. 7. Схема образования антипараллельных β-листов.
—Аминокислоты, образующие β-листы: серин, гистидин, цистеин,
треонин, тирозин, фенилаланин, триптофан, изолейцин, валин.
9

Третичная структура белка — это общее пространственное расположение всех атомов в молекуле белка (см. Рис. 8). Химические связи, стабилизирующие третичную структуру: координационные связи (с ионами ме-
таллов), гидрофобные взаимодействия, дисульфидные связи (–S–S–), ионные связи и водородные связи.
В рамках третичной структуры можно выде- |
|
|
|
лить некоторые надвторичные структуры: спи- |
|
|
|
раль-поворот-спираль, переплетёная спираль, βαβ, |
|
|
|
шпилька, β-меандр и др. (см. Рис. 9 и Рис. 10). |
|
|
|
Многие белки состоят из отдельных фраг- |
|
|
|
ментов, имеющих свою индивидуальную укладку, |
|
|
|
функцию и стабильноть — доме́нов. Длина ами- |
|
|
|
нокислотной цепочки одного домена может со- |
|
|
|
ставлять от 25 до 300 и более аминокислотных |
|
|
|
остатков. |
|
|
|
Домены белков по своему составу и структу- |
|
|
|
ре классифицируют на 4 группы: |
Рис. 8. Третичная |
||
— «α»-белки содержат только α-спирали. |
|||
структура |
цитохро- |
||
— «β»-белки — только β-структуры. |
ма b562 |
кишечной |
|
— «α/β»-белки состоят из параллельных β- |
палочки E. coli |
||
структур и параллельных α-спиралей, ко- |
|
|
|
торые антипараллельны друг другу. |
|
|
|
—«α+β»-белки подразделяют на две класса:
Белки одного класса напоминают « / »-белки тем, что в них слой -спиралей лежит на -листе. Их и участки в цепи и в пространстве регулярно чередуются.
Белки другого класса («собственно» « + »-белки) не имеют такого чередования, в их цепях -спирали пространственно
удалены от -структур.
Стоит упомянуть, что некоторые белки вовсе лишены вторичной и упорядоченной третичной структур (или содержат неупорядоченные фрагменты). Это вызвано большим количеством заряженных аминокислот и пролина в их цепях.
10

Рис. 9. Надвторичные структуры белков
Третичную структуру можно определить с помощью рентгеновской кристаллогра́фии, пропуская рентгеновские лучи через чистые белковые кристаллы, выращенные в определенных условиях, и затем анализируя дифракционную картину. Данная картина создаётся в результате рассеивания лучей электронами каждого атома молекулы. Рассеянные рентгеновские лучи могут взаимно усиливаться или ослабляться, создавая характерную картину для каждой молекулы.
Третичную структуру белка можно отчасти «предсказать», зная первичную структуру белка. Разработаны компьютерные алгоритмы, позволяющие сделать это, используя банк данных с уже известными конформациями белков. Другие методы основаны на анализе конформации отдельных участков молекулы: существуют данные о том, какие аминокислоты чаще всего образуют α-спирали и β-листы, а какие наоборот препятствуют этому и не формируют регулярных структур. Эту информацию успешно используют при прогнозировании третичной структуры белка.
11

Рис. 10. Уровни структурной организации белков
Четвертичной структурой обладают лишь те белки, которые содержат две и более полипептидные цепи. Каждую цепь при этом называют субъединицей (или протоме́ром). Белок, состоящий из нескольких протомеров, называют олигомерным. Количество цепей может варьироваться от 2 до 10 и более. Чаще всего встречаются димерные (две цепи), тримерные (три цепи) и тетрамерные (четы-
ре цепи) белки. Четвертичной структурой Рис. 11. Четвертичная струк-
обладает, например, белок гемоглобин |
тура гемоглобина |
|
|
(см. Рис. 11). |
|
Субъдиницы в полисубъединичных белках связаны с помощью неко- |
|
валентных связей: гидрофобных и электростатических взаимодействий. Поскольку эти связи достаточно слабые, субъединицы часто можно разделить в лабораторных условиях. Однако in vivo они остаются прочно связанными.
Некоторые факторы, способствующие образованию четвертичной структуры:
1.Олигомеры обычно более стабильны, чем их диссоциировавшие субъединицы. По всей вероятности, четвертичная структура продлевает «время жизни» белка.
12

2.Активные центры некоторых олигомерных ферментов формируются из аминокислотных остатков, относящихся к разным полипептидным цепям.
3.Трехмерная структура многих олигомерных белков меняется, когда белок связывается с лигандами. Иными словами, третичная и четвертичная структура таких белков изменчива, и это — ключ к регуляции их активности.
4.У некоторых белков есть общие субъединицы. Это можно объяснить тем, что в ходе эволюции субъединицы образовывали новые комбинации и это более оправданно, чем создание нового мономерного белка с той же функцией.
5.Полисубъединичные белки могут катализировать несколько последовательных реакций, в которых продукт первой реакции становится субстратом для второй. Пример: ПДГ (пируватдегидрогеназный комплекс).
Простые белки состоят только из аминокислот и при гидролизе распадаются только на аминокислоты. Примеры простых белков: альбумины, глутелины, гистоны, протамины, пепсин.
Сложные белки содержат небелковый компонент (простетическая группа), связанный с полипептидной цепью. Классы сложных белков:
1.Нуклеопротеины состоят из нуклеиновых кислот и белкового компонента. Примеры: рибосомы, сплайсосома, хроматин. Рибосомы синтезируют полипептидные цепи, используя в качестве матрицы мРНК. Сплайсосома осуществляет сплайсинг первичных транскриптов (РНК-продукты транскрипции). В хроматине белки способствуют компактизации спирали ДНК.
2.Гликопротеины представляют собой белки, связанные с углеводными группами. Примеры: иммуноглобулины (антитела), протеогликаны. Иммуноглобулины являются основой гуморального иммунитета и важными опсонинами (молекулами, помечающими антигены и чужеродные клетки для уничтожения их клетками нашего иммунитета). Протеогликаны содержат до 95% углеводов и входят в состав межклеточного матрикса.
3.Фосфопротеины в качестве простетической группы содержат один или несколько остатков фосфорной кислоты, которые обычно связаны с остатками серина, треонина и тирозина. Примеры: казеин (белок молока), вителлины (белки яичного желтка), овальбумин (белок куриного яйца).
4.Хромопротеины состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают: гемопроте-
13

ины (содержат в качестве простетической группы гем), магнийпорфирины и флавопротеины (содержат производные изоаллоксазина). Хромопротеины участвуют в фотосинтезе, клеточном дыхании и дыхании всего организма, транспорте кислорода и углекислого газа, окислительно-восстановительных реакциях, свето- и цветовосприятии. Примеры: гемоглобин (транспортирует O2 и CO2 в крови в составе эритроцитов и играет роль буферной системы) и цитохромы (входят в состав дыхательной цепи и переносят электроны).
5.Металлопротеины содержат негемовые ионы металлов, связанные с белковым компонентом координационными связями. Среди металлопротеинов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов).
6.Липопротеины являются комплексами белков и липидов. Их относят к 2 группам: трансмембранные липопротеины и липопротеины плазмы:
—Липопротеины очень низкой плотности;
—Липопротеины низкой плотности;
—Липопротеины высокой плотности;
—Липопротеины промежуточной плотности;
—Хиломикро́ны.
Трансмембранные липопротеины включают липидную группу для прочной связи с мембраной клетки. Липопротеины плазмы переносят липиды между клетками организма. Например, хиломикроны транспортируют экзогенные жиры, поступившие в организм человека с пищей.
Все белки активны, функциональны и структурно стабильны только при определенных условиях среды. Отклонения от этих условий могут привести к структурным изменениям в белках. Процесс утраты белками четвертичной, третичной и вторичной структур при воздействии химических или физических факторов называют денатурацией.
Большинство белков можно денатурировать воздействием высоких температур (при этом разрываются слабые связи, стабилизирующие белковую молекулу). Если повышение температуры происходит медленно, то белки сохраняют стабильность до определённой критической точки, когда утрата структурной организации происходит единовременно. Денатурация — кооперативный процесс, т.е. при нарушении структуры одного
14

фрагмента молекулы, нарушается и структура остальной её части. Однако не все белки денатурируют при относительно высоких температурах. Например, белки термофильных бактерий и архей способны выдерживать температуры до 100°С. Первичные структуры этих белков сравнивали с гомологичными им у кишечной палочки, и отличия оказались не такими значительными. Как именно такие малые изменения в аминокислотном составе белков помогают им сохранять целостность при действии высоких температур, до сих пор неизвестно.
Помимо температуры важными денатурирующими факторами являются: кислотность среды pH, органические растворители (спирт, ацетон), мочевина, гуанидин гидрохлорид, детергенты. Все эти факторы оказывают влияние на гидрофобные связи внутри белкового ядра, дестабилизируя его, вызывая электростатическое отталкивание между участками белковой цепи, разрыв водородных связей и общую утрату третичной структуры молекулой белка.
Третичная структура белка определяется его первичной структурой. Это доказывается тем, что некоторые белки денатурируют обратимо, т.е. способны к восстановлению нативной конформации — ренатурации. Классический пример: рибонуклеаза А полностью денатурирует в растворе мочевины, однако после удаления мочевины денатурированная молекула этого фермента восстанавливает свою первоначальную структуру и каталитическую активность. При этом восстанавливаются даже дисульфидные связи.
Выделение и очистка белков требуют поддержания жестких условий, особенно кислотности среды (pH) и температуры. Методы фракционирования позволяют выделять белки на основе их растворимости, заряда, полярности, размера молекулы и сродства к определенным лигандам. Различия в растворимости позволяют выделять белки с помощью метода выса́ливания. Различия в массе белков и следовательно в скоростях седиментации позволяют фракционировать их с помощью ультрацентрифугирования. Хроматогра́фия — разделение растворенных молекул по скорости их продвижения через нерастворимую матрицу в хроматографической колонке — это метод очистки молекул на основе их заряда (ионооб-
менная), гидрофобности (гидрофобная), размера (гель-фильтрационная) и
специфичности к определенным молекулам (аффинная). Сродство белков и их элюция (вымывание из хроматографической колонки с помощью элюента) зависят от концентрации солей и pH. Электрофоре́з разделяет молекулы по их заряду и размеру. Электрофорез белков в полиакриламидном геле (SDS-PAGE) разделяет белки в основном по размеру молекул. Двумерный гелевый электрофорез (2D) может разделить тысячи различных белков.
15

Выделение и очистка — обязательный этап в изучении макромолекул, но он не так прост. Как правило, степень очистки вещества, доля которого в клетке составляет < 0,1%, должна быть доведена до 98%.
Поначалу проблема очистки белков, находящихся в клетке в следовых количествах, была настолько актуальна, что многие белки изучались лишь отчасти. Гемоглобин (1/3 сухого веса эритроцита) был едва ли не самым изучаемым белком. Большинство ферментов, участвующих в основных метаболических процессах или экспрессии генетической информации, присущи всем видам. Поэтому для удобства их выделяют из тканей крупного рогатого скота или клеток микроорганизмов, ставших классическими микробиологическими объектами — кишечная палочка Escherichia coli и пекарские дрожжи Saccharomyces cerevisiae.
Современные методы позволяют выделить ген белка из желаемого организма, генетически модифицировать его и вставить в микроорганизм для большей экспрессии. Таким образом, можно добиться высокого «выхода» белка (его доля в результате может составить вплоть до 40% от всех белков микроорганизмов). Если количество белка в клетках организма слишком мало, то прибегают именно к таким методам.
Первым шагом в выделении белка из клетки является его извлечение из клетки в раствор — гомогениза́ция. Несколько актуальных методов:
1.Первый метод основан на гомогенизаторе Поттера-
Эльвейема— это толстостенная трубка, в которую вставляют пестик (трубка с насадкой). Давление и вращение пестика разрывает клетки и не нарушает структуру клеточных органелл.
2.Второй метод — использование звуковых волн для разруше-
ния клеточных мембран (обычно — ультразвук).
3.Третий метод — разрушение клеток замораживанием и раз-
мораживанием. Если белок прочно связан с мембраной, следует добавить детергенты, чтобы отделить его.
После гомогенизации клеток их подвергают дифференциальному центрифугированию (см. Рис. 12). Вращение образцов со скоростью, в 600 раз превышающей силу гравитации (600 g), приводит к выпадению в осадок (преципитированию) неразрушенных клеток и ядер (самые крупные частицы). Если интересующий нас белок находится не в ядре, то этот преципитат (т.е. осадок) удаляется. Надосадочная часть (супернатант) центрифугируется повторно со скоростью уже 15 000 g. В осадок выпадают митохондрии. Наконец ещё более быстрое центрифугирование (100 000 g) позволяет получить в осадке микросомальную фракцию, состоящую из рибосом и фрагментов мембран. Если искомый белок растворим, то этот осадок удаляют, а супернатант подвергают дальнейшей очистке.
16

Рис. 12. Гомогенизация и дифференциальное центрифугирование
На этом этапе растворимые белки подвергают грубой очистке. Метод основан на растворимости белков. Как правило, в качестве соли используют сульфат аммония (NH4)2SO4. Белки имеют различную растворимость в
17

полярных и ионных растворах. Растворяются белки благодаря своему взаимодействию с молекулами воды.
При добавлении сульфата аммония к раствору белков, часть молекул воды «отнимается» у белков и образует ионные связи с солью. При этом концентрация доступных для белков молекул воды снижается, и они начинают взаимодействовать друг с другом с помощью гидрофобных связей и постепенно выпадают в осадок. Чтобы ускорить этот процесс, раствор центрифугируют. Поскольку белки имеют различный ионный и гидрофобный состав (зависит от последовательности аминокислот в белках), они осаждаются при разной концентрации солей. Та концентрация, при которой искомый белок осаждается, называется точкой преципита́ции. Обычно в раствор добавляют сульфат аммония до 40% насыщения, осаждают белки с помощью центрифугирования. Далее снова используют супернатант и доводят степень насыщения до 60-70%. Формирующийся осадок часто содержит искомый белок. Процесс ускоряют центрифугированием, осадок растворяют в минимальном объёме буферного раствора.
Рис. 13. Высаливание
После высаливания раствор с белком подвергают диа́лизу: его переливают в целофановый мешочек, который погружают в буферный раствор (см. Рис. 14). Целофановая мембрана полупроницаема. Белки с большой молекулярной массой слишком велики, чтобы диффундировать через поры в этой мембране, однако остаточные соли (например, сульфат аммония и некоторые др.) выходят наружу в буферный раствор, а внутрь попадают буферные соли.
Вышеописанные методы не позволяют выделить чистый белок, однако они представляют собой важный этап в подготовке образцов для дальнейшей работы.
18

Рис. 14. Диализ
Как правило, для точного фракционирования белков используют методы хроматографии. Виды хроматографии классифицируют на основании используемой твёрдой матрицы (твердый материал, которым заполняют хроматографическую колонку).
Коло́ночная хроматография часто используется для разделения смеси белков (фракционирования). В цилиндрическую колонку, наполненную нерастворимым материалом (например, волокнами целлюлозы) или синтетическими гранулами («стационарная» фаза), наливают раствор белка («мобильная фаза») и вымывают его с помощью элюе́нта («мобильная фаза» или растворитель). По мере продвижения всего раствора белков через колонку внизу собирают элюа́т (жидкость, выделяющаяся из колонки). Скорость, с которой белки продвигаются через твёрдую матрицу (стационарную фазу) зависит от тех взаимодействий, в которые они вступают с ней. Различные белки элюируют с разной скоростью. Концентрация белка в каждой фракции может быть измерена с помощью пропускания через раствор УФ-света с длиной волны 280 нм (фотометри́я). Чтобы понять, в какой именно фракции находится очищаемый белок, фракции проверяют на биологическую активность (особенно актуально для ферментов, т.е. к ним добавляют их субстрат, и определяют, появился ли в среде продукт, так делают вывод о наличии фермента во фракции).
Колоночная хроматография была компьютеризирована и сейчас осуществляется под большим давлением с помощью плотно упакованных колонок с растворителем. Этим процессом управляет оператор с помощью компьютера. Такой метод получил название высокопроизводительной жидкостной хроматографии.
19
В ионообменной хроматографии матрица заряжена положительно (анионообменная) или отрицательно (катионообменная) (см. Рис. 15). Анионообменная матрица связывает отрицательно заряженные белки и задерживает их в колонке для последующего элюирования. Схожим образом, катионообменная матрица взаимодействует с положительно заряженными белками. Связанные с матрицей белки могут быть элюированы (вымыты из колонки) постепенным повышением концентрации соли в растворе. Когда концентрация солей достигнет нужной отметки, соли будут прочнее и быстрее связываться с матрицей, тем самым взаимодействие белков с твердой фазой будет нарушено, и они будут элюированы из колонки.
Гельфильтрационная хроматография разделяет белки на основа-
нии их размера (см. Рис. 16). Матрицей служит особый пористый гель. Малые белки проникают в поры геля и задерживаются там. Чем меньше размер белка, тем позднее он вымывается из колонки. Большие белки в поры не попадают и потому быстро минуют стационарную фазу, слабо контактируя с ней. Большие белки элюируются быстрее.
Аффи́нная хроматография — самая специфичная из всех видов хроматографии. Она основана на взаимодействии молекул белков со специфичными только к ним лигандами́ (см. Рис. 17). Этим лигандом может быть: субстрат, который связывается с белком in vivo; антитело, специфичное к нему; другой белок, который имеет свойство связываться с искомым. По мере прохождения смеси белков через колонку только искомый белок специфически связывается с матрицей. Колонку несколько раз промывают буферным раствором, чтобы вывести из неё все остальные белки. Затем в колонку добавляют соли в высокой концентрации, которые активнее вступают во взаимодействие с матрицей и нарушают её связи с необходимыми нам белками. Белки диссоциируют от матрицы и вымываются (элюируют). Иногда используют не соли, а раствор того же лиганда (отметим, что в колонке уже есть этот лиганд, но он связан с неподвижной матрицей — специальным твердым инертным материалом). Этот лиганд также вступает во взаимодействия с молекулами белков. Этот способ эффективен, когда лиганд является небольшой по размерам молекулой. Аффинная хроматография очищает белки в 1 000–10 000.
20

Рис. 15. Ионообменная хроматография: 1) В колонку вносят раствор с белка-
ми. Матрица связана с ионами Na+. 2) Белки, общий заряд которых нейтрален или отрицателен, легко вымываются из колонки. Белки, заряженные положительно, взаимодействуют с матрицей и вытесняют ионы Na+. 3) Избыток ионов Na+добавляется в колонку. Теперь уже они вытесняют белки, связываясь с матрицей. Белки элюируют.
21

Рис. 16. Гельфильтрационная хроматография. (а) Гелевые гранулы имеют по-
ры (гелевую матрицу). Малые молекулы свободно попадают в них. Крупные молекулы не проникают в гелевые гранулы. (б) Сверху в колонку подают раствор, содержащий образец. (в) Малые молекулы проникают в гель и мигрируют медленнее, чем крупные. (г и д) Сначала элюируют (вымываются из колонки) крупные молекулы. Малые молекулы требуют бо́льшего объе ма растворителя.
22

Рис. 17. Аффи́нная хроматография
Помимо вышеописанных методов существуют аналитические методы работы с белками: один из них — электрофорез.
Электрофоре́з разделяет белки на основании их миграции в элек-
трическом поле. В полиакрилами́дном гелевом электрофорезе (PAGE)
образцы белков помещают на гелевую матрицу из полиакриламида и воздействуют на них электрическим полем. Матрица буферизована до щелочной среды, чтобы зарядить белки отрицательно, и они свободно мигрировали к аноду (заряжен положительно). Обычно для сравнения миграции разных образцов используют некоторые стандартные. Матрица затрудняет движение крупных молекул белков, поэтому фракционирование происходит на основании двух показателей — заряда и матрицы.
Существует модификация стандартного метода электрофореза, в основе которой лежит использование отрицательно заряженного детергента додецилсульфата натрия (SDS). Его применяют для того, чтобы полностью «экранировать» (или компенсировать) нативный заряд белков так, чтобы фракционирование происходило только на основании массы. Полиакриламидный гелевый электрофорез (SDS-PAGE) используют для
23

оценки чистоты образцов и молекулярного веса белков, которые в этих образцах содержатся (обычно их несколько). В этом методе додецилсульфат натрия добавляют к образцам и к полиакриламидному гелю. К белкам добавляют восстановительный агент, восстанавливающий все дисульфидные связи. Додецилсульфат натрия, имеющий длинную гидрофобную цепочку, связывается гидрофобными радикалами аминокислотных остатков в белке. Комплекс SDS-белок заряжается крайне отрицательно и мигрирует к аноду. Однако скорость их миграции в геле обратно пропорциональна логарифму их массы, а значит, крупные белки мигрируют медленнее, встречая на своем пути больше «сопротивления» со стороны геля. Малые молекулы белков мигрируют гораздо быстрее.
Несмотря на то, что полиакриламидный гелевый электрофорез — аналитический метод, его можно адаптировать для очистки белков: вырезать фрагменты геля и отделять от него белки с помощью повторного воздействия электрического поля. После очистки белков от солей, их можно использовать в исследованиях, например, для структурного анализа.
Рис. 18. Электрофорез в полиакриламидном геле (SDS-PAGE)
24

Рис. 19. Снимок геля после проведения электрофореза. Дорожки обозначены цифрами. Слева приводится молекулярная масса в кДа (килодальто́ны)
Масс-спектрометри́я, как и следует из названия, определяет молекулярную массу белка. Масс-спектрометр измеряет время, которое необходимо молекуле, находящейся в газовой фазе, чтобы попасть из точки введения на чувствительный детектор. Это время зависит от заряда молекулы и массы и выражается в виде отношения «заряд/масса» m/z. Ранее этот метод был неприменим к белкам и нуклеиновым кислотам ввиду того, что эти молекулы разрушались при переводе их в газовую фазу (нагревание, испарение и пропускание потока электронов).
Однако затем были разработаны модификации этого метода, в которых эти проблемы были устранены. Например, в электроспрейной массспектрометрии раствор макромолекул распыляют из тонкой капиллярной трубки под большим напряжением (~4000 В) так, чтобы на выходе были заряженные капли, из которых растворитель быстро испаряется в вакуумных условиях. В результате макромолекулы переводятся в газовую фазу и имеют заряд от +0,5 до +2 на 1 кДа. Этот заряд объясняется протонированием аргинина и лизина. Далее ионы направляются на детектор магнитным полем.
Второй метод — матрично-активированная лазерная десорбция.
В данном методе белки смешивают с химической матрицей, и смесь наносят на металлический субстрат. Матрица — малая органическая молекула, поглощающая свет определенной длины волны. Лазерный импульс передает энергию на белки посредством этой матрицы. Белки десорбируются с субстрата и направляются на детектор. Масс-спектрометрия — очень чувствительный метод, позволяющий определить массу белков вплоть до 10–12 моль.
25

Рис. 20. Масс-спектрометрия
Рис. 21. Матрично-активированная лазерная десорбция
Аминокислота, радикал, хиральный центр, энантиомер, цвиттерион, изоэлектрическая точка, пептидная связь, пептид, белок, олигопептид, полипептид, C- и N-конец, олигомерный белок, протомер, простетическая группа, первичная структура, протеазы, протеом, кон-
26

сенсусная последовательность, гомологичные белки, конформация, нативная конформация, вторичная структура, α-спираль, β- конформация, надвторичные структуры, домен, третичная структура, гидрофобные взаимодействия, дисульфидные мостики, четвертичная структура, фибриллярные белки, глобулярные белки, кератин, коллаген, симметрия, денатурация, шапероны, гомогенизация, высаливание, фракционирование, диализ, хроматография, электрофорез.
1.Место биохимии среди других наук.
2.История развития биохимии белков.
3.Пептидная теория строения белков (основные аминокислоты, их классификация, нестандартные аминокислоты, пептидная связь).
4.Первичная структура белков.
5.Вторичная структура белков.
6.Третичная структура белков и взаимодействия, стабилизирующие её.
1.Четвертичная структура белков. Простые и сложные белки. Глобулярные и фибриллярные белки.
2.Физико-химические свойства белков. Денатурация и ренатурация белков.
3.Методы разделения и очистки, их взаимосвязь с физикохимическими свойствами белков.

1.Строение аминокислот. Общая структурная формула.
2.Классификация аминокислот на основе полярности и заряда их боковых цепей (радикалов).
3.Изоэлектрическая точка pI.
4.Стереохимическая конфигурация аминокислот.
5.Производные аминокислот в организме человека: γ-аминомасляная кислота (ГАМК), гистамин, дофамин, тироксин, адреналин.

1.Последовательность аминокислот как первичная структура белков.
2.Определение аминокислотной последовательности белков:
27
а. Секвенирование; б. Выявление эволюционных сходств;
в. Построение филогенетического древа на основе анализа аминокислотной последовательности белков.

1.Планарность пептидной связи и её влияние на конформацию пептидной цепи. Торсионные углы у связей Cα-N (угол φ) и Cα-C (угол ψ).
2.α-Спирали и β-листы:
а. Аминокислоты, принимающие участие в формировании вторичных структур, и их соотношение;
б. Параметры α-спирали и β-листа; в. Химические связи, стабилизирующие вторичные структуры.
3.Супервторичные структуры: спираль-поворот-спираль, β-меандр, βαβ, β-бочонок, шпильки, β-сендвич.

1.Пространственная конформация белков как их третичная структура.
2.Фолдинг белков:
а. Закономерности и пути принятия белками нативной конформации.
б. Фолдинг как кооперативный процесс.
в. Положение боковых цепей аминокислот в молекуле белка с нативной конформацией.
г. Участие разных шаперонов и их комплексов в фолдинге: hsp40/70/90, GroEL/ES.
3.Химические связи, стабилизирующие третичную структуру белков: а. Координационные связи с ионами металлов; б. Гидрофобные взаимодействия; в. Дисульфидные связи; г. Водородные связи;
д. Электростатические взаимодействия.
4.Глобулярные и фибриллярные белки: особенности строения и примеры.
5.Заболевания, связанные с неправильной конформацией белков.

1.Особенности формирования четвертичной структуры белков.
2.Примеры белков с четвертичной структурой. Особенности их функционирования. Гемоглобин.
3.Белок-белковые взаимодействия и стабилизация четвертичной структуры: гидрофобный эффект, электростатические взаимодей-
28

ствия, дисульфидные мостики, координационные связи с ионами металлов.

1.Высаливание.
2.Центрифугирование.
3.Хроматография:
а. Высокопроизводительная жидкостная; б. Гидрофобная; в. Гель-фильтрационная; г. Аффинная; д. Ионообменная;
е. Иммунологическая.
4.Электрофорез.
5.Масс-спектрометрия.
1.Расскажите о белках: их свойствах, строении и функциях.
2.Как классифицируют аминокислоты?
3.Почему при различных pH ионизация аминокислот меняется?
4.Нарисуйте общие структурные формулы аминокислоты и дипептида.
5.Какие уровни структурной организации белков выделяют?
6.Какие химические связи стабилизируют вторичную структуру белковой молекулы?
7.Какие химические связи стабилизируют третичную структуру белковой молекулы?
8.В чем отличия между глобулярными и фибриллярными белками?
9.Как определяют первичную структуру белков?
10. Какие методы работы с белками существуют?
29

Ферменты — это высокоэффективные биологические катализаторы химических реакций. По своей химической природе ферменты являются белками (однако способностью катализировать химические реакции обладают и некоторые молекулы РНК).
Каждому ферменту присваиваются 2 наименования: короткое (для удобства применения) и более полное систематическое.
Короткие названия обычно строятся по следующей схеме:
—Название субстрата + суффикс –аза (уреаза, глюкозидаза);
—Описание реакции, катализируемой ферментом (лактатдегидрогеназа, аденилатциклаза).
Систематические наименования опираются на номенклатуру ферментов, разработанную Комитетом по Номенклатуре Международного Союза по Биохимии и Молекулярной Биологии и содержат полное описание катализируемой реакции, включая наименования всех субстратов: лактат:NAD+ оксидоредуктаза. Каждому ферменту присваивается номер по схеме КФ х.х.х.х (англ. EC x.x.x.x). Например, фермент пируватдегидрогеназа (E1), входящий в состав пируватдегидрогеназного комплекса, имеет номер EC 1.2.4.1. С полной современной номенклатурой можно ознакомиться на сайте: http://enzyme.expasy.org.
Согласно этой номенклатуре, ферменты подразделяют на 6 классов:
1.Оксидоредуктазы катализируют окислительновосстановительные реакции. В ходе этих реакций один субстрат отдаёт электроны (окисляется), а другой их принимает (восстанавливается). Например, часто в клетке акцептором электронов служит NAD+ (восстанавливается до NADH). Пример реакции:
Лактат + NAD+ Пируват + NADH + H+ (фермент — лактатдегидрогеназа)
2.Трансферазы катализируют реакции переноса химических групп между молекулами разных веществ. Этот обширный класс включает в себя несколько подклассов: фосфотрансферазы, гликозилтрансферазы, аминотрансферазы и др. Пример реакции:
Аланин + α-Кетоглутарат Пируват + Глутамат (фермент — аланинтрансаминаза)
30

3.Гидролазы ускоряют гидролитическое расщепление химических связей (с участием молекул воды). Выделяют: эстеразы (гидролиз сложных эфиров), гликозидазы (гидролиз гликозидов), пептид-гидролазы (гидролиз белков и пептидов) и др. Пример реакции:
Пирофосфат + H2O → 2 HPO42– (фермент — пирофосфатаза)
4.Лиазы катализируют реакции разрыва химических связей без участия воды с образованием двойных связей. В обратной реакции они катализируют добавление групп по двойным связям с их разрывом. Пример реакции:
Пируват + H+ → Ацетальдегид + CO2 (фермент — пируватдекарбоксилаза)
5.Изомеразы ускоряют реакции изомеризации, внутримолекулярного переноса химических групп. В этих реакциях участвует только один субстрат, поэтому они одни из самых простых. Пример реакции:
Глюкозо-6-фосфат Фруктозо-6-фосфат (фермент — фосфоглюкоизомераза)
6.Лигазы катализируют образование связей C—C, C—S, C—O, C— N с использованием энергии АТФ (или другого нуклеотида). Например, карбоксилазы добавляют карбоксильную группу к субстрату (карбоксилируют его), при этом расщепляя молекулу АТФ и используя энергию разрыва макроэргической связи для образования новых связей. Пример реакции:
Пируват + CO2 + ATP → Оксалоацетат + АДФ + Фн (фермент — пируваткарбоксилаза)
—Ферменты высокоэффективно ускоряют химические реакции на много порядков (до 1015 раз). Количество молекул субстрата, которое фермент превращает в продукт, обычно составляет 102–104 в секунду.
—Обладают субстратной и каталитической специфичностью. Фер-
мент и субстрат формируют связанные комплексы [ES]. Связи между ферментом и субстратом могут быть как ковалентными, так и нековалентными.
—Ферментативные реакции происходят при относительно мягких условиях: температура ниже 100°C, атмосферное давление, почти нейтральные значения pH. Крайние условия наоборот нарушают их активность и структуру .
31

—Ферменты обладают способностью к регуляции с помощью алло-
стерического контроля, ковалентной модификации и изменения концентрации фермента.
—Ферменты способны катализировать одну и ту же реакцию большое количество раз (этим они отличаются он неорганических катализаторов). Т.е. ферменты неисчерпаемы.
Все ферменты имеют активный центр — участок молекулы фермента, где происходит катализ химической реакции. Активный центр представляет собой группу радикалов аминокислот, взаимодействующих с субстратом. Если взглянуть на первичную структуру фермента, то становится очевидно, что данные аминокислоты расположены далеко друг от друга в полипептидной цепи, однако сворачивание (фолдинг) белковой молекулы фермента обеспечивает их пространственное сближение и активность. В Приложении 2 приводится иллюстрация вышесказанному на примере химотрипсина (фермента, участвующего в переваривании белков в кишечнике).
Некоторые ферменты имеют аллостерический центр, отвечающий за регуляцию их активности.
Представления о специфичности ферментов в настоящее время расширяются и могут быть представлены следующим образом:
1.Относительная специфичность (или специфичность по хими-
ческим связям): при этом типе специфичности ферменты взаимодействуют с субстратами схожими по структуре и содержащими те же типы химических связей. Примеры:
а. Амилаза расщепляет α-1,4-гликозидные связи в крахмале, декстринах и гликогене.
б. Липаза гидролизует эфирные связи в различных триацилглицеролах.
2.Групповая специфичность (или структурная специфич-
ность): в этом случае фермент специфичен не только к типу химической связи, но и к структурным компонентам молекулы, окружающим её. Примеры:
а. Пепсин (желудочный фермент) — эндопептидаза, гидролизующая пептидные связи внутри белковой молекулы (потому и «эндо-») между ароматическими аминокислотами: фенилаланином, тирозином, триптофаном.
б. Трипсин — эндопептидаза, гидролизующая пептидные связи внутри молекулы белка между осно́вными амино-
32
кислотными остатками: лизином, аргинином и гистидином.
в. Химотрипсин — эндопептидаза, гидролизующая пептидные связи внутри молекулы белка по карбоксильным группам, принадлежащим ароматическим аминокислотным остаткам.
г. Аминопептидаза — это экзопептидаза, гидролизующая концевые пептидные связи (между последним и предпоследним аминокислотными остатками) в молекуле белка с его N-конца.
д. Карбоксипептидаза — это экзопептидаза, гидролизующая концевые пептидные связи (между последним и предпоследним аминокислотными остатками) в молекуле белка
сего C-конца.
3.Абсолютная специфичность (или субстратная специфич-
ность): фермент взаимодействует строго с одним субстратом. Примеры:
а. Уриказа катализирует окисление мочевой кислоты.
б. Аргиназа расщепляет аргинин до орнитина и мочевины. в. Карбоновая ангидраза расщепляет угольную кислоту до
углекислого газа и воды.
г. Лактаза расщепляет лактозу. д. Сахароза расщепляет сахарозу. е. Мальтаза расщепляет мальтозу.
4.Оптическая специфичность (или стереоспецифичность): при этом типе специфичности фермент специфичен не только к субстрату, но и к его пространственной конфигурации. Примеры:
а. Оксидаза L-аминокислот окисляет только L-
аминокислоты и не способна связываться с D- аминокислотами.
б. Оксидаза D-аминокислот окисляет только D-
аминокислоты и не способна связываться с L- аминокислотами.
в. α-Гликозидаза расщепляет только α-гликозидные связи (в крахмале, декстринах и гликогене).
г. β-Гликозидаза расщепляет только β-гликозидные связи (в целлюлозе). У людей этот фермент отсутствует, поэтому мы не усваиваем целлюлозу
5.Двойная специфичность подразделяется на 2 подтипа:
а. Фермент катализирует одну реакцию для двух различных субстратов. Пример: ксантиноксидаза окисляет ксантин
игипоксантин:
—Гипоксантин + H2O + O2 Ксантин + H2O2
33

— Ксантин + H2O + O2 Мочевая кислота + H2O2
б. Фермент катализирует две реакции с одним субстратом.
Пример: изоцитратдегидрогеназа сначала окисляет изоцитрат, а затем декарбоксилирует его:
— Изоцитрат + NAD+ → α-Кетоглутарат + CO2 + NADH + H+
Субстратная специфичность фермента связана с расположением аминокислотных радикалов активного центра в пространстве. Именно они формируют особый «карман», с которым связывается субстрат в ходе реакции. Существует две модели, объясняющие связывание субстрата с ферментом.
Предложена Эми́лем Фи́шером в 1890 г. Согласно его модели, субстрат строго соответствует активному центру фермента, как ключ — замку. Субстрат связывается с ферментом с помощью гидрофобных связей, электростатических взаимодействий, водородных связей и др. Даже малое несоответствие пространственной конфигурации химических групп субстрата расположению радикалов аминокислот в активном центре может привести к стерической некомплементарности и к возникновению сил отталкивания.
Создана Дэ́ниелом Ко́шландом в 1958 году. В ней сказано, что комплементарность субстрата ферменту — лишь часть сложной картины взаимодействий между ферментов и субстратом: при связывании субстрата с активным центром происходит изменение конформации молекулы фермента. То есть фермент «подстраивается» под субстрат, как «перчатка под руку».
Направление химической реакции определяется изменением стандартной свободной энергии (ΔG°) — разностью между энергиями субстратов и продуктов реакции. Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими. Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую.
Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими. Если абсолютное значение ΔG велико, то система устойчива, и ре-
34
акция в таком случае практически не осуществляется. При ΔG, равном нулю, система находится в равновесии.
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
Для примера рассмотрим реакцию глюкозы и кислорода. Они способны реагировать с образованием углекислого газа и воды:
Глюкоза + O2 → 6CO2 + 6H2O
Однако глюкоза химически стабильна на воздухе (реакция не идёт), несмотря на то, что эта реакция термодинамически вероятна, иными словами спонтанна, поскольку изменение свободной энергии для этой реакции G° = −2880 кДж/моль = 689 ккал/моль. То, что эта реакция спонтанна термодинамически, не означает, что она мгновенна. Чтобы произошла эта реакция, необходим приток энергии извне.
Количество энергии, необходимое для того, чтобы началась реакция, называется энергией активации. Ферменты катализируют реакции, сни-
жая энергию активации G°‡ (или активационную энергию) — энергию,
необходимую для того, чтобы реакция началась и было достигнуто переходное состояние. Важной особенностью ферментов является их более высокое сродство к соединениям, уже находящимся в переходном состоянии.
Итак, ферменты ускоряют химические реакции, но не меняют константу равновесия реакции, т.е. изменение свободной энергии. Скорость реакции зависит от свободной энергии активации, т.е. энергии, требуемой для того, чтобы началась реакция. Ферменты снижают активационную энергию, делая реакцию более вероятной и, следовательно, чаще протекающей, отсюда и ускорение реакции. Все вышесказанное проиллюстрировано на графиках (см. Рис. 22).
35

Рис. 22. График изменения свободной энергии реакции (слева) и снижение энергии активации ферментом (справа)
В 1913 году Леонор Михаэлис и Мод Ментен предложили простую модель кинетики ферментативных реакций:
Фермент E связывается с субстратом S, константа скорости этой реакции равна k1. Комплекс ES может диссоциировать до E + S со скоростью k–1 или образовать продукт E + P со скоростью k2. Кроме того, он может вновь образовать комплекс ES со скоростью k–2. Однако мы можем упростить эти реакции, приравняв скорость реакции к нулю (т.е. V0), когда можно пренебречь образуемым количеством продукта и, как следствие, обратной реакцией k–2[E][P] ≈ 0:
Начнём с того, что скорость реакции равна произведению концентрации [ES] на константу скорости образования продукта k2:
(1)
Теперь выразим концентрацию [ES] известными нам параметрами: Скорость образования ES = k1[E][S]
Скорость распада ES = (k–1 + k2)[ES] 36

В 1924 году Джордж Бриггс и Джон Холдейн сделали допущение о равновесии реакции. В состоянии равновесия концентрации промежуточных продуктов — т.е. ES — поддерживаются на одном уровне, даже если концентрации субстратов и продуктов реакции меняются. Это состояние достигается, когда скорости образования и распада ES равны. Приравняем правые части уравнений, указанных выше:
(2)
Преобразуем это уравнение и получаем:
(3)
Это уравнение можно упростить, введя новую константу Km. Бриггс и Холдейн назвали её константой Михаэлиса:
(4)
Теперь подставим константу Михаэлиса в уравнение 3:
(5)
Посмотрим на числитель уравнения 5. Поскольку концентрация субстрата всегда значительно выше концентрации фермента, то концентрация несвязанного субстрата почти равна общей концентрации субстрата (общая концентрация [S] равна сумме связанного субстрата с ферментом и несвязанного субстрата). Концентрация несвязанного фермента [E] равна разности общей концентрации фермента и фермент-субстратного комплекса [ES].
(6)
Выразим [E] в уравнении 5через разность в уравнении 6:
(7)
Преобразуем уравнение 7: раскрываем скобки и переносим [ES][S] в левую часть уравнения. Затем делим обе части уравнения на [ES] и переносим [ES] из знаменателя (в правой части) в левую часть, а сумму Km + [S] из левой части в знаменатель правой части. Получаем:
(8)
Теперь выразим [ES] в уравнении 8, используя уравнение 1:
37

(9)
Максимальная скорость ферментативной реакции Vmax достигается, когда все каталитические центры фермента заняты (концентрация насыщения) субстратом. Т.е. [ES] = [ET].
(10)
Теперь подставим уравнение 10 в уравнение 9. Получаем уравнение Михаэлиса-Ментен:
(11)
1.Константа Михаэлиса характеризует сродство фермента к субстрату.
Чем ниже значение Km, тем прочнее фермент связывается с субстратом.
2.Константа Михаэлиса Km равна концентрации субстрата, при которой скорость реакции составляет половину максимальной (Vmax/2).
3.Константа Михаэлиса Km равна соотношению констант скоростей прямой и обратных реакций (k–1 + k2)/k1.
Каталитическая константа
(kcat) — это количество обращений — максимальное количество молекул субстрата, которое может быть трансформировано в продукт одной молекулой фермента за единицу времени. Соотношение kcat/Km является мерой каталитической эффективности фермента.
Уравнение Михаэлиса-Ментен Рис. 23. График Михаэлиса-Ментен (математический вывод — Бриггс и
Холдейн):
V [S]
V0 max
K m [S]
На практике этим уравнением и графиком Михаэлиса-Ментен очень тяжело пользоваться, поскольку точно определить значения максимальной скорости Vmax и константы Михаэлиса Km они не позволяют.
38

В связи с этим Лайнуивер и Берк, используя метод двойных обратных величин, трансформировали это уравнение следующим образом:
График, соответствующий этому уравнению, имеет вид прямой, а потому удобнее для определения Vmax (пересечение с осью ординат) и Km (пересечение с осью абсцисс):
Рис. 24. График Лайнуивера-Берка
С помощью графика находим значения константы Михаэлиса и максимальной скорости реакции:
y |
1 |
||||
K |
|
||||
|
|
|
m |
||
|
|
|
|
||
K |
|
|
1 |
||
m |
y |
||||
|
|
|
|||
|
|
|
|
||
Каталитические механизмы
ров схожи. В основе лежат:
x |
|
1 |
V |
|
|
|
max |
|
|
|
Vmax 1x
ферментов и химических катализато-
—Общий кислотно-основный катализ: ускорение реакции дости-
гается путём переноса протона; этот тип катализа происходит
39

при значениях pH близких к нейтральным. Аминокислоты, входящие в состав активного центра: аспартат, глутамат, гистидин, цистеин, тирозин, лизин.
—Ковалентный катализ: между субстратом и ферментом образуются ковалентные связи при достижении переходного состояния. Обычно ковалентная связь образуется между нуклеофильной группой фермента (донор электронов) и электрофильной группой субстрата.
—Ионный катализ: примерно 1/3 всех ферментов нуждается в ионах металлов для ускорения реакций: Fe2+, Fe3+, Cu2+, Mn2+, Co2+. Ионы металлов участвуют в катализе тремя путями:
o Связываются с субстратом и ориентируют его правильно
в активном центре.
oУчаствуют в окислительно-восстановительных реакциях, меняя степень окисления.
oЭлектростатически стабилизируют или экранируют отрицательный заряд.
Расположение функциональных групп в активном центре фермента имеет огромное значение, поскольку обеспечивает эффект близости и ориентации субстрата, а также электростатический катализ. Активный центр всегда образован ионизируемыми аминокислотными остатками: они могут участвовать в кислотно-основном катализе и ковалентном катализе.
В настоящее время ферменты успешно выделяют из клеток и изучают их свойства in vitro. Различные ферменты по-разному функционируют при изменении концентрации субстрата, температуры и кислотности среды.
Скорость ферментативной реакции — это количество молекул субстрата, превращённых в продукт в единицу времени. Обычно скорость выражают в мкмоль/мин. Скорость ферментативной реакции повышается с увеличением концентрации субстрата, пока не достигнет максимальной отметки Vmax. Это объясняется насыщением всех молекул фермента субстратом.
С повышением температуры скорость ферментативной реакции увеличивается до максимальной отметки. Это объясняется увеличением чис-
40

ла молекул, имеющих достаточную энергию для того, чтобы преодолеть энергетический барьер реакции и превратиться в продукт.
Рис. 25. Зависимость скорости химической реакции от температуры среды
Дальнейшее повышение температуры приводит к обратному эффекту — скорость реакции снижается в результате денатурации самого фермента. Температурный оптимум большинства ферментов человека лежит в интервале 35-40°С. Ферменты человека начинают денатурировать уже при температурах выше 40°С.
Кислотность среды pH влияет на ионизацию активного центра фермента. Концентрация H+ влияет на скорость реакции следующим образом: фермент и субстрат должны иметь ионизированные или деионизированные химические группы для протекания ферментативной реакции. Например, может потребоваться, чтобы аминогруппа радикала фермента находилась в протонированной форме —NH3+. Щелочная среда будет вызывать депротонирование этой группы, а, следовательно, и снижение скорости реакции. Крайние значения pH среды могут вызвать денатурацию фермента из-за ионизации/деионизации радикалов аминокислот и проявления сил отталкивания между участками цепи. Оптимальная кислотность — специфическая характеристика фермента. Она отражает, при каких условиях фермент функционирует в клетке и организме. Например, пепсин (синтезируется главными клетками желудка и участвует в переваривании белков) проявляет максимальную активность при pH ≈ 2. Хотя для ферментов, функционирующих при нейтральной кислотности среды, такие условия совсем не подходят (вызовут денатурацию). То, при какой кислотности фермент наиболее активен, зависит от его аминокислотной последовательности и конформации.
41

Рис. 26. Зависимость скорости химических реакций, катализируемых раз-
личными ферментами, от pH среды: на графике видно, что ферменты имеют разные оптимумы pH.
Некоторые ферменты нуждаются в ионах металлов (кофакторах) и органических соединениях (коферментах) для ускорения реакций; при этом коферменты могут быть косубстратами (связаны с ферментами не-
ковалентными связями) или простетическими группами (связаны с фер-
ментами ковалентными связями). Пример простетической группы: гем, входящий в состав цитохромов.
Неорганические ионы (кофакторы) — K+, Cu2+, Mg2+, Ca2+, Zn2+, Fe3+ — участвуют в катализе и связывании фермента с субстратом. Это утверждение объясняет, зачем человеку необходимо поступление этих ионов с пищей. Кроме того, это объясняет и токсические эффекты некоторых тяжелых металлов. Например, кадмий Cd2+, ртуть Hg2+ могут связываться с активными центрами ферментов вместо цинка Zn2+ и выключать их, вызывая тяжелые последствия для организма.
Некоторые коферменты синтезируются из общих метаболитов, другие являются производными витаминов — органических соединений, которые должны непременно присутствовать в диете и поступать в организм человека и других животных в малом количестве. Примеры коферментов:
—NAD+ и NADP+ (производные никотиновой кислоты — витамин
B3);
—FAD и FMN (производные рибофлавина — витамина B2);
—кофермент А (производное пантотеновой кислоты — витами-
на B5);
42

—тиаминпирофосфат (ТПФ, производное тиамина — витамина
B1);
—пиридоксаль-5-фосфат (производное пиридоксина — витамина B6);
—биотин (витамин B7 или H);
—тетрагидрофолат (производное фолиевой кислоты — витамина B9);
—аденозилкобаламин (производное кобаламина — витамина
B12);
—липоамид (производное липоевой кислоты — витамина N).
Мультисубстратные реакции — это реакции, в которых участвуют 2 (60% всех ферментативных реакций) или более субстратов (крайне редко). Они происходят по двум основным механизмам.
Сначала все субстраты связываются с ферментом, а уже затем происходит сама реакция. Последовательные реакции дополнительно классифицируют на 2 подвида, происходящие по следующим механизмам:
1.Упорядоченный механизм: связывание субстратов происходит в строго определённом порядке. Однако это не значит, что то соединение, которое присоединяется первым, первым же и отщепляется. Так работает большинство NAD+/NADH-зависимых дегидрогеназ.
Рис. 27. Упорядоченный механизм двусубстратной реакции: А и В — субстраты, P и Q — продукты.
Пример реакции:
Пируват + NADH + H+ Лактат + NAD+
Вэтой реакции:
—NADH — A, а пируват — B;
— Лактат — P, а NAD+ — Q.
43

Т.е. NADH всегда присоединяется первым и отщепляется последним. Пируват всегда присоединяется последним и отщепляется первым.
2.Случайный механизм: субстраты связываются с ферментом в любом порядке. Так функционируют некоторые дегидрогеназы и киназы.
Рис. 28. Случайный механизм двусубстратной реакции:
А и В — субстраты, P и Q — продукты.
Пример реакции:
Креатин + АТФ Фосфокреатин + АДФ
В этой реакции креатин может быть присоединяться как первым, так и последним. Это же касается и АТФ. Отщепление тоже происходит в случайном порядке.
По этому механизму протекают реакции, в которых продукт превращения первого субстрата отщепляется раньше, чем будет связан второй субстрат реакции.
Рис. 29. Механизм «пинг-понг»: А — первый субстрат, P — первый продукт, В
— второй субстрат, Q — второй продукт.
Пример реакции:
Аспартат + α-Кетоглутарат Оксалоацетат + Глутамат
Аспартат (A) связывается с ферментом, «отдаёт» свою аминогруппу. Образуется оксалоацетат (P). Он отщепляется. Затем присоединяется α-
44

кетоглутарат (B), принимает аминогруппу. Образуется глутамат (Q) и отщепляется.
Вещества-ингибиторы снижают скорость ферментативной реакции. Обратимые ингибиторы образуют нековалентные связи с ферментами. Необратимые ингибиторы образуют ковалентные связи с ферментами.
Обратимые ингибиторы классифицируют на:
—Конкурентные;
—Бесконкурентные;
—Неконкурентные.
Конкурентные ингибиторы [I] конкурируют с субстратом [S] за активный центр фермента [E] (т.е. образуется или комплекс [ES], или [EI]) и снижают концентрацию свободных молекул фермента.
Уравнение Михаэлиса и значение коэффициента α для конкурентного ингибирования:
45

Рис. 30. График Михаэлиса-Ментен для конкурентного ингибирования
Конкурентные ингибиторы повышают константу Михаэлиса (Km) и не изменяют максимальную скорость Vmax:
—Повышение константы Михаэлиса означает, что требуется больше молекул субстрата, чтобы насытить фермент и достичь
Vmax/2. Важно: повышение концентрации субстрата снижает вероятность взаимодействия молекул фермента с молекулами ингибитора;
—Максимальная скорость не меняется, поскольку является теоретически и практически достижимой: повышение концентрации субстрата приведёт к тому, что ингибитор не будет «успевать» взаимодействовать с ферментом, а значит, реакция сможет идти с максимальной скоростью.
46

Рис. 31. График Лайнуивера-Берка для конкурентного ингибирования
Пример: конкурентное ингибирование этанолом лежит в основе лечения отравления метанолом. Фермент алкоголь дегидрогеназа превращает метанол в очень опасное соединение — формальдегид (вызывает слепоту и смерть уже в малых дозах). Этанол конкурирует с метанолом за активный центр алкоголь дегидрогеназы. В результате концентрация формальдегида снижается, а метанол выводится из организма с мочой.
Ещё одним примером конкурентных ингибиторов являются антигиперлипидемические агенты. Они конкурентно ингибируют первую стадию синтеза холестерола в организме человека. Эта реакция катализируется гидроксиметилглутарил-КоА-редуктазой. Аторвастатин и правастатин являются структурными аналогами соединения гидроксиметилглутарилКоА и способны связываться с активным центром фермента, препятствуя связыванию его с ГМГ-КоА. Именно так они ингибируют синтез холестерола, снижая его концентрацию в плазме крови.
Бесконкурентные ингибиторы связываются только с ферментсубстратным комплексом. Связывание бесконкурентного ингибитора с комплексом фермент-субстрат [ES] нарушает активный центр, отчего фермент становится неактивным. Повышение концентрации субстрата (как в случае конкурентного ингибирования), не способно исправить ситуацию, поскольку субстрат не влияет на связывание ингибитора с фер-
47

ментом. Уравнение Михаэлиса и значение коэффициента α для бесконкурентного ингибирования:
Бесконкурентные ингибиторы пропорционально снижают Km и Vmax:
—Максимальная скорость Vmax снижается, поскольку комплексы ESI непродуктивны (не приводят к образованию продуктов);
—Константа Михаэлиса Km Таблица 1. Примеры бесконкурент-
уменьшается, поскольку ин- |
|
ных ингибиторов |
||||||||
гибитор |
[I] связывается |
с |
|
|
|
|
|
|
||
|
Вещество |
|
|
Фермент (болезни) |
|
|||||
|
|
|
|
|||||||
[ES] и образует [ESI]. Концен- |
|
|
|
|
||||||
|
|
|
|
|
|
|||||
трация [ES] снижается, а зна- |
|
|
|
|
Инозин 5’- |
|||||
|
Мукофенольная |
|
монофосфат дегидро- |
|||||||
чит, согласно принципу Ле |
|
кислота |
|
геназа (рак, иммуно- |
||||||
Шателье, |
равновесие |
реак- |
|
|
||||||
ции будет сдвинуто в сторо- |
|
|
|
|
супрессия). |
|||||
|
Финастерид, |
|
|
Стероидная 5α- |
|
|||||
ну образования [ES], т.е. |
|
эпристерид, ду- |
|
|
редуктаза (аденома |
|
||||
больше оставшихся молекул |
|
тастерид |
|
|
простаты, облысение) |
|
||||
субстрата [S] будут связы- |
|
|
|
|
Дигидрофолат редук- |
|||||
ваться с |
ферментом |
[E]. |
И |
|
Метотрексат |
|
таза (рак, бактери- |
|||
меньшее |
количество |
моле- |
|
|
|
|
альные инфекции) |
|||
|
Вальпроевая |
|
|
ГАМК-трансфераза |
|
|||||
кул субстрата [S] будет необ- |
|
кислота |
|
|
(эпилепсия) |
|
||||
ходимо для достижения по- |
|
Камптотецин |
|
Топоизомераза I (рак) |
||||||
ловины |
максимальной кон- |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
центрации комплексов [ES].
48
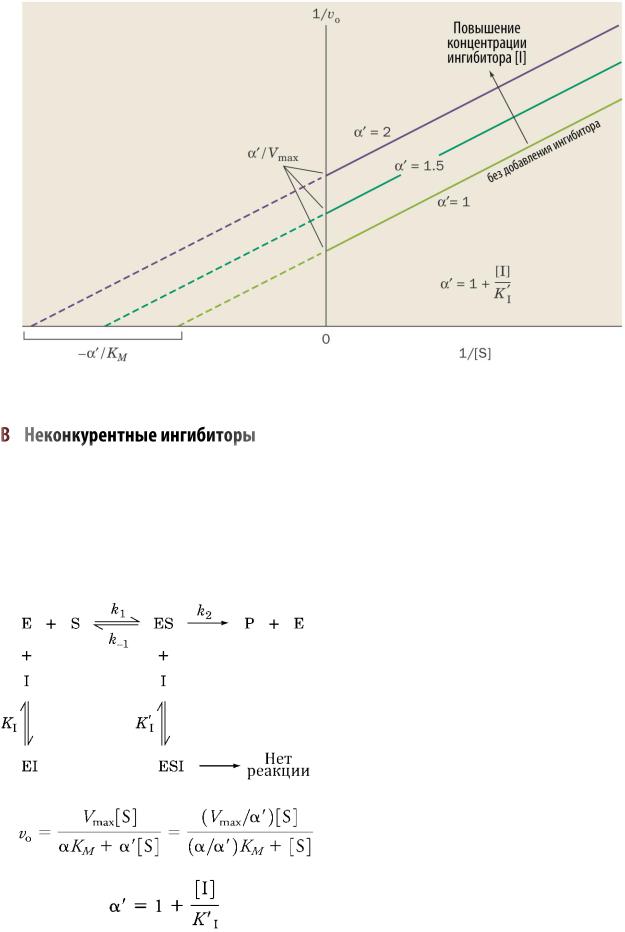
Рис. 32. График Лайнуивера-Берка для бесконкурентного ингибирования
Неконкурентный ингибитор связывается или со свободным ферментом [E], или с комплексом фермент-субстрат [ES].
После связывания ингибитора с ферментом, субстрат всё ещё может связаться с их комплексом, однако к образованию продукта, это не приведёт. Неконкурентный ингибитор снижает концентрацию функционального фермента.
|
Вещество |
|
|
Фермент (болезнь) |
|
|
|
|
|
||
|
|
|
|
|
|
|
Дезоксициклин |
|
Коллагеназа |
||
|
|
|
|
(периодонтит). |
|
|
Невирапин, |
|
|
Обратная транскрип- |
|
|
эфавиренз |
|
|
таза ВИЧ-1 (ВИЧ) |
|
|
Этопозид |
|
Топоизомераза II |
||
|
|
(рак) |
|||
|
|
|
|
||
|
|
|
|
Ацетилхолинэстераза, |
|
|
Такрин |
|
|
моноаминоксидаза |
|
|
|
|
(болезнь Альцгейме- |
|
|
|
|
|
|
|
|
|
|
|
|
ра) |
|
|
|
|
|
Предположительно |
|
|
Тразодон |
|
аденозиндезаминаза |
||
|
|
|
|
(депрессия) |
|
49

Рис. 33 График Лайнуивера-Берка для неконкурентного ингибирования
Неконкурентный ингибитор снижает максимальную скорость реакции Vmax и не изменяет константу Михаэлиса Km:
—Максимальная скорость Vmax снижается, поскольку ингибитор снижает концентрацию фермента и его раствор «ведёт себя» как разбавленный (между концентрацией фермента и скоростью реакции прямо пропорциональная зависимость).
Аллостерические ферменты обычно состоят из нескольких субъединиц и проявляют положительную кооперативность при связывании с субстратом: связывание субстрата с одной субъединицей облегчает его связывание с другой. Существует две модели, описывающие кооперативные эффекты:
Предложена в 1965 году Жаком Моно, Джеффри Вайманом и ЖанПьером Шанье. Эта модель основана на представлении, что у каждой субъединицы есть свой сайт связывания субстрата. Существует два состояния:
50

R- и Т-конформация. Субъединица в R-конформации имеет высокое сродство к субстрату, а в T-конформации — низкое. Конформации всех субъединиц фермента взаимосвязаны: при изменении одной субъединицы,
меняются и остальные. Связывание субстрата с одной субъединицей фермента в T-конформации меняет третичную структуру всех субъединиц фермента и одновременно активирует их (переводит в R-конформацию).
Параллельная модель была дополнена важными положениями, касающимися аллостерических эффекторов (и аллостерической регуляции в целом):
—Субстрат связывается преимущественно с субъединицей в R- конформации.
—Аллостерический ингибитор связывается с субъединицами в T- конформации (неактивными) и стабилизирует их (сохраняет в неактивном состоянии).
—Аллостерический активатор связывается с субъединицами в R- конформации и тоже стабилизирует их.
Предложена Даниэлем Кошландом, Джорджем Не́мети и Дэвидом Филмером. Эта модель утверждает, что субъединицы фермента могут находиться в разных конформациях. Связывание субстрата с субъединицей в T-конформации активирует её (переводит в R-состояние), после чего становится возможным изменение конформации и других субъединиц. От-
личительная черта этой модели в том, что одновременного изменения конформации субъединиц не происходит. Связывание субстрата с одной субъединицей «подготавливает» и постепенно активирует другие.
Последовательная модель объясняет и аллостерическую регуляцию фермента ингибитором и активатором:
—Связывание ингибитора стабилизирует сначала одну, а потом и остальные субъединицы в T-конформации.
—Активатор же напротив сохраняет субъединицы в R- конформации.
51

Рис. 34. Две модели кооперативных взаимодействий при связывании субстрата с ферментом
Существует явление отрицательной кооперативности ферментов:
связывание субстрата с одной субъединицей делает невозможным связывание таких же молекул субстрата с остальными субъединицами фермента. Например, связывание тирозина с одной субъединицей тирозил-тРНК- синтетазы ингибирует связывание тирозина с другими субъединицами.
Аллостерические ферменты регулируются молекулами, которые называют эффекторами. Они связываются с ферментом в аллостерическом центре и изменяют свойства ферментов: сродство к субстрату (прочность его связывания с ним) и максимальная скорость катализа. Эффекторы могут быть положительными и отрицательными (позитивными и негативными). Положительные эффекторы — активаторы — повышают активность ферментов, а отрицательные эффекторы — ингибиторы — снижают её. Кроме того, эффекторы классифицируют на:
1.Гомотропные эффекторы: если субстрат фермента может выступать в роли эффектора, его называют гомотропным. Чаще всего регуляция происходит по позитивному механизму: присутствие субстрата повышает сродство к нему и активность всех каталитических субъединиц фермента. Однако не исключается и негативная регуляция.
2.Гетеротропные эффекторы: если эффектором фермента является не субстрат, а другое соединение, то его называют гетеротропным. Регуляция может быть как позитивной, так и негативной, но чаще всего она негативная: связывание гетеротропного эффектора (ингибитора) снижает сродство фермента к субстрату и влияет на его каталитические свойства.
52

Регуляция работы фермента может осуществляться и по механизму ковалентной модификации. Одна из наиболее частых модификаций фермента — его фосфорилирование / дефосфорилирование — присоедине-
ние / отщепление остатка фосфорной кислоты. Как правило, фосфорилированию подвергаются остатки серина, тирозина и треонина. Белки, которые осуществляют эти реакции называют протеинкиназами. Донором фосфатных остатков являются молекулы АТФ.
Рис. 35. Фосфорилирование серина
Стоит заметить, что фосфорилирование не всегда активирует фермент. Нельзя точно предсказать, как скажется фосфорилирование на активности белка без проверки обеих гипотез (активация / ингибирование) на практике. Например, гликогенфосфорилаза в фосфорилированном состоянии активна, а гликогенсинтаза — неактивна.
Антиферменты — это соединения, например, антитела или ингибирующие ферменты, способные снизить или нарушить активность фермента. Примером антифермента является α-1-антитрипсин (его ещё называют α-1-ингибитор протеаз), который защищает ткани от ферментов иммунных клеток, участвующих в неспецифическом иммунном ответе (в реакциях воспаления). Антитрипсин ингибирует эластазу нейтрофилов, которая расщепляет фибриллярный белок эластин. Другие примеры: α-1-
антихимотрипсин, каллистатин, васпин, антитромбин, нейросерпин.
Мультиферменты представляют собой комплексные ферментные системы, последовательно катализирующие взаимосвязанные реакции одного метаболического пути или реакции, имеющие общие метаболиты. Примеры: Комплексы I и IV (дыхательная цепь митохондрий), синтаза жирных кислот, глициндекарбоксилазный комплекс, α- кетоглутаратдегидрогеназный комплекс, сахаразо-изомальтазный комплекс, пируватдегидрогеназный комплекс.
53

Изоферменты (или изозимы) — это ферменты, отличающиеся по аминокислотной последовательности, но при этом катализирующие одну
иту же химическую реакцию. Иными словами, изоферменты — это разные варианты одного и того же фермента. Обычно у этих ферментов разные кинетические показатели (константа Михаэлиса) или другие функциональные отличия. Примеры: гексокиназа и глюкокиназа (печёночная форма) катализируют фосфорилирование глюкозы до глюкозо-6-фосфата.
Изоферменты часто имеют органоспецифичность (экспрессируются
исинтезируются в определённых органах). Примером органоспецифичного изофермента является лактатдегидрогеназа (ЛДГ): ЛДГ1— в сердечной мышце и эритроцитах, ЛДГ2 — в лейкоцитах, ЛДГ3 — в лёгких, нервной ткани и почках, ЛДГ4 — в почках, плаценте и поджелудочной железе, ЛДГ5
— в печени и скелетных мышцах.
В медицине существуют два основных направления использования ферментов:
Определение ферментов в крови используют в диагностике различных заболеваний. Ферменты, имеющие клиническое значение: лактатдегидрогеназу, креатинкиназу, щелочную фосфатазу, аспартатаминотрансферазу, аланинаминотрансферазу, кислую фосфатазу, глюкозо-6-фосфат дегидрогеназу.
—Определение изоформы ЛДГ в крови позволяет диагностировать инфаркт миокарда (при разрушении клеток миокарда ЛДГ попадает в кровь и может быть определён с помощью биохимических методов), лейкемию, цирроз печени, опухоли центральной нервной системы.
—Креатинкиназу, аспартатаминотрансферазу и глюкозо-6- фосфат дегидрогеназу определяют при инфаркте миокарда.
—Щелочную фосфатазу определяют при болезни Педжета, остеогенной саркоме, заболеваниях печени и желчного тракта.
—Кислая фосфатаза имеет диагностическое значение при раке простаты.
Применение ферментов в качестве терапевтических средств. Энзимотерапия развивается в следующих направлениях:
—Заместительная терапия — использование ферментов при их недостаточности;
—Комплексная терапия — применение ферментов в сочетании с другой терапией.
54

Заместительная энзимотерапия эффективна при желудочнокишечных заболеваниях, связанных с недостаточностью секреции пищеварительных ферментов. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. При дефиците ферментов поджелудочной железы рекомендуется прием внутрь препаратов, содержащих основные панкреатические ферменты (мезим-форте, фестал, энзистал и др.).
Помимо этого, заместительная терапия эффективна при некоторых лизосомальных заболеваниях (внутривенное введение ферментов) — болезни Гоше, болезни Фабри, мукополисахаридозах I, II, VI типов — и гликогенозах II типа.
Катализ, фермент, кофактор, кофермент, простетическая группа, холофермент, апофермент, активный центр, субстрат, изменение стандартной свободной энергии Гиббса, переходное состояние, энергия активации, константа равновесия, скорость реакции, сродство фермента, специфичность, индуцированное состояние, кислотноосновный катализ, константа Михаэлиса, уравнение МихаэлисаМентен, уравнение Лайнуивера-Берка, константа диссоциации, число обращений, ингибирование, аллостерический фермент, отрицательная обратная связь, зимоген, аналоги соединений переходного состояния.
1.Общая характеристика ферментов. Свойства и строение.
2.Классификация ферментов.
3.Механизм действия ферментов. Специфичность действия ферментов.
4.Влияние параметров среды на активность ферментов. Коферменты и кофакторы.
1.Зависимость скорости ферментативной реакции от действия факторов окружающей среды (температура, рН).
2.Коферменты, кофакторы, их роль в ферментативном катализе.
3.Кинетика ферментативных реакций. Уравнение Михаэлиса-Ментен.
4.Регуляция ферментативной активности: ингибирование и активация. Определение параметров ферментативной реакции и вида ингибирования с использованием графической интерпретации уравнения Лайнуивера-Берка.
5.Органоспецифичность ферментов. Изоферменты. Антиферменты. Энзимопатии. Применение ферментов в медицине.
55


1.Скорость ферментативной реакции: примеры ферментов и степени ускорения реакций ими.
2.Умеренные условия среды: физические параметры условий при которых функционируют ферменты (температура, pH, атмосферное давление).
3.Специфичность: виды специфичности и примеры ферментов.
а. стереоспецифичность; б. геометрическая специфичность: абсолютная и относительная.
4. Способность к регуляции: примеры регуляторных механизмов.

1.Классы ферментов: принципы классификации и типы катализируемых реакций.
2.EC-классификация ферментов в интернете (ознакомиться): http://expasy.org/enzyme/

1. Кофакторы:
а. Органические (т.е. коферменты): косубстраты и простетические группы, различия между ними и примеры.
б. Неорганические: ионы металлов.

1.Кислотно-основный катализ.
2.Ковалентный катализ.
3.Катализ при участии ионов металлов.
4.Эффект близости.
5.Предпочтительное связывание комплекса в переходном состоянии.

1.Реакции первого и второго порядков.
2.Уравнение Михаэлиса-Ментен. Вывод уравнения. График зависимости скорости ферментативной реакции от концентрации субстрата. Различные смыслы константы Михаэлиса.
3.Вклад Бриггса и Холдейна в развитие ферментативной кинетики.
4.Уравнение Лайнуивера-Берка. Вывод уравнения и график по методу двойных обратных величин. Нахождение максимальной скорости реакции и константы Михаэлиса по графику.
5.Двусубстратные реакции (бисубстратные):
56

а. последовательный механизм; б. «пинг-понг».

1. Обратимое ингибирование:
а. Конкурентное ингибирование: уравнение, графики и примеры. б. Смешанное (неконкурентное) ингибирование: уравнение, гра-
фики и примеры.
в. Бесконкурентное ингибирование: уравнение, графики и примеры.
2. Необратимое ингибирование:
а. Механизм необратимого ингибирования; б. Примеры необратимых ингибиторов.
3.Интерпретация ингибирования на графиках Михаэлиса-Ментен и Лайнуивера-Берка.

1.Согласованная модель (Жак Моно, Джеффри Вайман).
2.Последовательная модель (Дэниел Кошланд, Джордж Немети, Дэвид Филмер).
1.Что такое ферменты? Какие свойства они имеют?
2.Как классифицируют ферменты? Какой принцип лежит в основе их классификации?
3.Что такое активный центр фермента? Как он устроен?
4.Расскажите о видах специфичности ферментов.
5.Что такое ингибирование ферментативной активности? Расскажите о его видах.
6.Что такое «переходное состояние» комплекса ES?
7.Какое значение имеют показатели Km и Vmax? Как можно графически определить Km и Vmax?
8.В чем заслуга Лайнуивера и Берка? В чем преимущество предложенного ими метода?
9.Как регулируется активность ферментов?
10. Что такое аллостерический центр?
57

ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота) — виды нуклеиновых кислот. ДНК — это молекула, отвечающая за наследственную информацию у про- и эукариотических организмов. У вирусов эту функцию может выполнять как ДНК, так и РНК. По химическому строению они представляют собой полимеры, состоящие из мономеров — нуклеотидных остатков — связанных между собой 3’–5’ фосфодидиэфирными связями.
Нуклеозиды — это органические соединения, состоящие из пятиуглеродного сахара и азотистого основания, связанных между собой с помощью N-гликозидной связи.
Нуклеотиды представляют собой фосфорные эфиры нуклеозидов, т.е. содержат ещё и остаток фосфорной кислоты. Таким образом, нуклео-
тиды состоят из остатка фосфорной кислоты, азотистого основания
(аденина, гуанина, цитозина и тимина, который отсутствует в РНК; вместо тимина в РНК присутствует урацил) и пятиуглеродного сахара (пентозы)
— дезоксирибозы (в ДНК) или рибозы (в РНК):
Таблица 3. Номенклатура оснований, нуклеозидов и нуклеотидов
Азотистое |
Рибонуклеозид |
Рибонуклеотид |
основание |
(основание + рибоза) |
(5’-монофосфат) |
 Аденин
Аденин
Гуанин
 Цитозин
Цитозин
Урацил
Азотистое
основание
Аденин
 Гуанин
Гуанин
Цитозин
 Тимин
Тимин
 Аденозин
Аденозин
Гуанозин
 Цитидин
Цитидин
Уридин
Дезоксирибонуклеозид (основание + дезоксирибоза)
Аденозин
 Гуанозин
Гуанозин
Цитидин
 Тимидин
Тимидин
 Аденозин 5’-монофосфат (АМФ); аденилат Гуанозин 5’-монофосфат (ГМФ); гуанилат
Аденозин 5’-монофосфат (АМФ); аденилат Гуанозин 5’-монофосфат (ГМФ); гуанилат
 Цитидин 5’-монофосфат (ЦМФ); цитидилат Уридин 5’-монофосфат (УМФ); уридилат
Цитидин 5’-монофосфат (ЦМФ); цитидилат Уридин 5’-монофосфат (УМФ); уридилат
Дезоксирибонуклеотид (5’-монофосфат)
Дезоксиаденозин 5’-монофосфат (АМФ); дезоксиаденилат Дезоксигуанозин 5’-монофосфат (ГМФ); дезоксигуанилат
Дезоксицитидин 5’-монофосфат (ЦМФ); дезоксицитидилат Дезокситимидин 5’-монофосфат (ТМФ); дезокситимидилат или тимидилат
58

Рис. 36. Структурные формулы дезоксирибонуклеотидов
Рис. 37. Структурные формулы двух пентоз, входящих в состав нуклеино-
вых кислот: рибоза содержится в рибонуклеотидах (РНК), а дезоксирибоза — в дезоксирибонуклеотидах (ДНК)
59
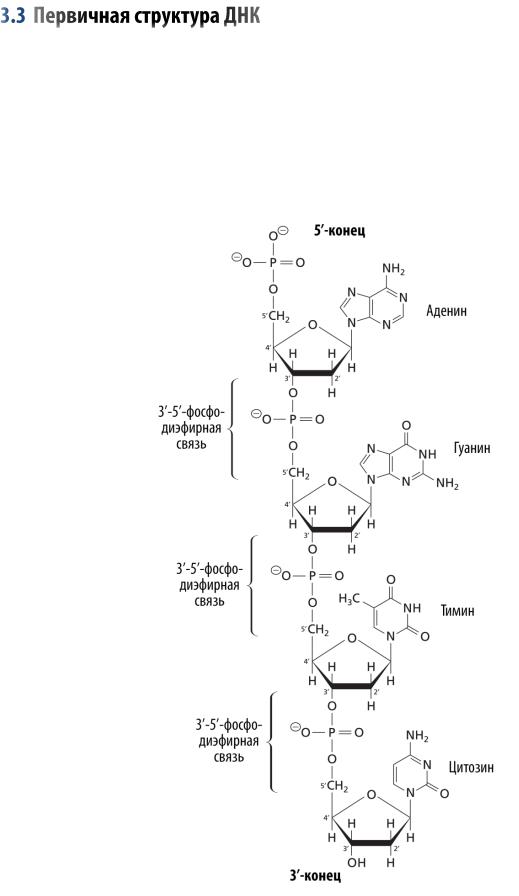
Первичная структура ДНК — это последовательность нуклеотидов в полинуклеотидной цепи, кодирующая наследственную информацию. ДНК имеет сахарофосфатный остов, с которым связаны азотистые основания: аденин (А), цитозин (Ц), гуанин (Г), тимин (Т). Нуклеотиды связаны между собой с помощью фосфодиэфирных связей. В их образовании участвуют 3’- гидроксильные группы пентоз одного нуклеотида и 5’-фосфатные группы другого (см. Рис. 38).
Рис. 38. Первичная структура ДНК: остатки нуклеотидов, связанные между собой
фосфодиэфирными связями
60

У цепи ДНК есть 5’-конец (свободный остаток фосфорной кислоты) и 3’-конец (гидроксильная группа, связанная с 3’-атомом углерода дезоксирибозы).
Последовательность нуклеотидов в ДНК обычно записывается с помощью букв, обозначающих азотистые основания. Например: 5’ -А-Ц-Т-Г- 3’.
Вторичная структура ДНК представляет собой |
|
||||
двухцепочечную спираль, из двух длинных полинук- |
|
||||
леотидных цепей, закрученных относительно общей оси. |
|
||||
Сахаро-фосфатный скелет обеих цепей обращён наружу |
|
||||
от оси спирали, а азотистые основания обращены внутрь |
|
||||
спирали. |
|
|
|
|
|
Две цепи удерживаются вместе с помощью водо- |
|
||||
родных связей между азотистыми основаниями (аденин |
Рис. 39. Вторич- |
||||
образует две связи с тимином, а гуанин — три связи с |
|||||
ная структура |
|||||
цитозином), |
гидрофобных |
связей, |
стэкинг- |
ДНК |
|
взаимодействий и ионных связей. Одна цепь ДНК комплементарна другой, при этом цепи антипараллельны.
Структурные особенности двойной спи-
рали:
1.Две антипараллельные цепи являются правозакрученными вдоль общей оси, диаметр спирали ~23,7
Å (2,37 нм).
2.Плоскости, в которых лежат азотистые основания, образующие водородные связи, почти перпендикулярны оси спирали. В B-ДНК основания занимают центральную часть спирали, а сахаро-фосфатный скелет закручен и обращён наружу. Только края оснований контактируют с растворителем.
3.Каждое основание имеет приблизительно одну ширину, что придает спирали ДНК практически пол-
ную симметрию независимо от со- Рис. 40. Вторичная структура става самих оснований. Основания ДНК: двойная спираль и её в парах можно поменять местами параметры без каких-либо последствий для
61

спирали: Г ≡ Ц можно изменить на Ц ≡ Г или А = Т на Т = А.
4.Каноническая (идеальная) форма B-ДНК имеет 10 пар оснований в одном шаге (в одном повороте спирале). При этом на каждую пару приходится 36° (если быть точным, то число пар в шаге — 10,4, следовательно, угол составляет 34,6°). Пары основа-
ний уложены в спирали «стопками». Шаг спирали составляет 34 Å (3,4 нм).
ДНК обладает структурной гибкостью и существует в нескольких формах: A-ДНК, B-ДНК (классическая Уотсон-Криковская двойная спираль), Z-ДНК и др. A- и B-ДНК являются правозакрученными спиралями. В B-ДНК азотистые основания располагаются почти перпендикулярно к оси вращения спирали. Z-ДНК представляет собой левозакрученную спираль. Бо́льшая часть ДНК клетки находится в B-форме (см. Приложение 3).
В двойной спирали различают боль-
шую и малую бороздки — это расстояния между сахарофосфатными остовами обеих цепей в двойной спирали.
Длину ДНК измеряют в килоба́зах, т.е. тысячах пар нуклеотидов: 1 кб = 1 000 пар нуклеотидов. Геном человека (т.е. все 46 хромосом) имеет длину 3,2 × 106 кб (или 3,2 × 109 пар нуклеотидов).
Химические связи, стабилизирующие вторичную структуру ДНК:
1.Стэкинг-взаимодействия: пары оснований, уложенные в спирали «стопками» удерживаются силами Ван-дер-Ваальса. И несмотря на то, что связи между 2 парами оснований крайне слабые, их большое количество во всей молекуле ДНК является важным фактором её стабилизации.
2.Водородные связи образуются между азотистыми основаниями цепей. Между аденином и тимином — 2 водородных связи, а между гуанином и цитозином — 3.
3.Гидрофобные связи: гидрофобные азотистые основания «погружены» внутрь спирали, это придаёт спирали дополнительную стабильность.
4.Электростатические взаимодействия: электростатическое отталкивание между отрицательно заряженными остатками фосфорной кислоты дестабилизирует спираль ДНК, однако эти
62

эффекты минимизированы присутствием ионов Mg2+ и катионных белков (богатых лизином и аргинином).
ДНК в клетке термодинамически стабильна и спирализована, однако некоторые её области подвергаются «плавлению» (т.е. двойная спираль разматывается) из-за происходящих процессов репликации, транскрипции, репарации и рекомбинации. Полное расплетение цепей и их разделение называют денатурацией. Денатурация происходит только in vitro.
Двухцепочечная ДНК может быть денатурирована воздействием высоких температур или хаотропных агентов, таких как мочевина или гуанидин хлорид.
При медленном повышении температуры двойная спираль ДНК денатурирует постепенно, за счет нарушения стэкинг и водородных связей. Две цепи постепенно расплетаются и наконец полностью диссоциируют (разделяются). Температура, при которой половина молекулы ДНК подверглась денатурации, называет-
ся точкой плавления Tm. Ренатурацией называется
процесс восстановления нативной конформации ДНК. Ренатурация
происходит самопроизвольно при охлаждении раствора, в котором содержатся диссоциировавшие цепи ДНК.
ДНК и РНК могут образовывать гибриды по принципу комплементарности (например, матричная цепь ДНК и транскрибированная с неё пре-мРНК). Кроме того, если смешать в одном растворе денатурированные цепи ДНК различных видов, они тоже будет образовывать гибриды, но в силу того, что полностью нуклеотидные последовательности этих цепей некомплементарны (ввиду генетической изменчивости и разнообразия), такие гибриды будут считаться неполными: помимо спирализованных участков будут образовываться «вздутия», не имеющие спиральной укладки.
Степень денатурации можно измерить с помощью абсорбции ультрафиолетовых лучей. Одноцепочечные ДНК при длине волны 260 нм поглощают 12-40% света. Разумеется, области, богатые парами A = T быстрее подвергаются плавлению, чем Г ≡ Ц участки.
63
