
Zadachi_po_td_1
.pdf41
2.3. Энтропия итермодинамическиепотенц иалы индив идуальны хв еществ иихфазов ы хпрев ращений
Д л я ид еал ьно го |
газа изменение в нутренней энергии в |
о братимо м про цес- |
|||||||
се (δQ′=0), со гл асно (2.9), в ыраж ается урав нением |
|
|
|||||||
ил и |
|
|
|
|
dU = TdS –PdV |
|
|
||
|
|
|
|
dS = dU |
|
|
|
|
|
|
|
|
|
|
+ PdV . |
|
|
||
|
|
|
|
|
T |
|
|
|
|
Про изв ед ем |
замену |
dU = CVdT на |
о сно в ании (1.7) |
и P = RT . По сл е |
|||||
|
|
|
|
|
|
|
|
|
V |
нео пред ел енно го интегриро в ания по л учим урав нение |
д л я мо л ярно й энтро пии |
||||||||
газа. |
|
|
|
|
|
|
|
|
|
|
|
|
|
S = S0 + CVlnT + RlnV, |
|
(2.25) |
|||
гд е S0 –по сто янная в ел ичина. |
|
|
|
|
|
||||
Принимая в о |
в нимание (2.12), при изо термическо м про цессе м о л ярные энергии |
||||||||
Гел ьмго л ьца и Гиббса мо гутбыть в ыраж енысл ед ующим о бразо м : |
|||||||||
|
|
|
|
F = F(T) –RTlnV, |
|
|
|||
|
|
|
|
G = G(T) + RTlnP, |
|
(2.26) |
|||
гд е F(T) и G(T) –по сто янные в ел ичиныпри T=const. |
|
|
|||||||
Д л я реал ьно го газа в м есто |
P в в о д ится но в ая терм о д инам ическая ф ункция |
||||||||
f –л етучесть (ф угитив но сть). М |
еро й о тл ичия реал ьно го |
д ав л ения о тид еал ьно го |
|||||||
яв л яется ко эф ф ициентл етучести |
|
|
|
|
|||||
|
|
|
|
|
γ = |
f |
. |
|
(2.27) |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
P |
|
|
|
При P→0, f→P, γ→1. В тако м сл учае |
|
|
|
|
|||||
|
|
|
|
G = G(T) + RTlnf |
|
(2.28) |
|||
и |
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RTlnf = RTlnP – òαdP , |
|
(2.29) |
|||
|
|
RT |
|
|
|
0 |
|
|
|
гд е по прав ка |
|
υ −учитывα = аетразл ичие в мо л ярных о бъемах ид еал ьно го и |
|||||||
|
P |
||||||||
|
|
|
|
|
|
|
|
||
реал ьно го газа.
42
С о гл асно принципусо о тв етств енных со сто яний, д л я в сех в еществ существ уето д на и та ж е ф ункция
æ |
P |
|
V |
|
T |
ö |
|
|
|
jç |
|
, |
|
, |
|
|
÷ |
= 0 , |
|
P |
V |
T |
|
|
|||||
ç |
|
|
|
÷ |
кр |
кр |
|||
è |
|
|
|
|
|
кр ø |
|||
гд е Pкр, Vкр и Tкр – критические д ав л ение, о бъем и температура. Ко эф ф ициент л етучести газа есть унив ерсал ьная ф ункция прив ед енных д ав л ения π, температурыτ и не зав исито тв ел ичин, х арактеризующих д анно е в еществ о :
|
|
|
|
γ = f (π, τ) , |
(2.30) |
гд е |
P |
, |
=τT |
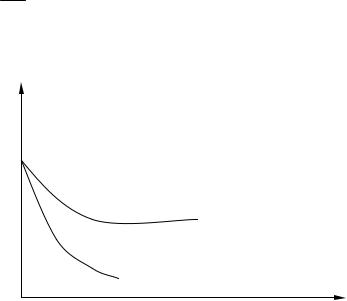
.πН=а рис. 1 прив ед ены сх ем атически зав исим о сти γ о тπ. |
|
|
|||||
|
P |
Tкр |
кр |
|
|
Т о чные |
числ о в ые значения это й зав исим о сти д аны в |
справ о чно й л итературе. |
|||
По ним мо ж но |
найти значение γ при л юбых зад анных усл о в иях . |
||||
lgγ
τ3
0 
τ2
τ1
lgπ
Рис. 1. Зав исим о сть ко эф ф ициента л е- тучести о тприв ед енно го д ав л ения π при разл ичных прив ед енных тем пературах τ
(τ1 < τ2 < τ3)
Рав но в есный перех о д инд ив ид уал ьно го |
в еществ а из о д но го |
агрегатно го |
|
со сто яния в д руго е при изменении T и P х арактеризуется рав енств о м |
|||
|
dG1 = dG2, |
|
(2.31) |
гд е dG1 и dG2 – со о тв етств ующее изм енение |
терм о д инамических |
по тенциал о в |
|
ф азы1 и ф азы2. С учето м (2.12) д л я о братимо го про цесса (δQ′=0) |
|
||
− |
= |
− 2dT . S21 dP 1V |
dT S V dP |
43
Отсюд а |
|
|
|
S2 − S1 |
|
|
|
||||||
|
|
|
dP |
= |
. |
|
(2.32) |
||||||
|
|
|
dT |
V − V |
|||||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
2 |
|
1 |
|
|
|
|
При температуре ф азо в о го перех о д а, со гл асно |
(2.7), |
|
|||||||||||
|
|
|
S |
2 |
- S = |
|
H |
, |
|
|
|||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
1 |
|
T |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
гд е DН –м о л ярная энтал ьпия ф азо в о го |
перех о д а, по гл о щенная ил и в ыд ел енная |
||||||||||||
при перех о д е 1 мо л ь в еществ а из ф азы1 в |
ф азу2, V2 –V1 есть разно сть м о л яр- |
||||||||||||
ных |
о бъемо в д в ух ф аз. Т о гд а |
|
|
|
|
|
|
|
|
|
|
||
|
|
dP |
= |
|
H |
|
. |
(2.33) |
|||||
|
|
dT |
|
|
|
|
|
|
|||||
|
|
|
|
|
( 2 − V1 )T V |
|
|||||||
Э то |
урав нение К лапейрона-К лаузиуса. Оно |
|
устанав л ив аетзав исимо сть д ав - |
||||||||||
л ения насыщенно го |
пара о ттемпературыи прил о ж им о ко в сем ф азо в ым пере- |
|||||||||||
х о д ам чистых в еществ, то есть к прев ращениям агрегатных со сто яний. |
|
|||||||||||
Д л я про цессо в |
испарения и в о зго нки (2.33) прео бразуется в |
|
||||||||||
|
|
|
|
|
dlnP = |
|
|
H |
. |
|
(2.34) |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
dT |
RT2 |
|
|
||||
Прибл иж енно е интегриро в ание, считая DН |
¹ DН (T), д ает |
|
||||||||||
|
|
|
|
lnP = - H × |
1 |
+ const |
|
(2.35) |
||||
|
|
|
|
T |
|
|||||||
|
|
|
|
|
n |
|
|
|
|
|
||
С учето м зав исимо сти DН (T) |
|
|
|
|
|
|
|
|||||
lnP = - |
H0 |
× |
1 |
+ Δα ×lnT + |
Δβ × T + |
c × T2 + ... + j |
(2.36) |
|||||
n |
T |
|||||||||||
|
|
|
n |
|
|
2n |
3n |
|
||||
Зд есь DН 0 и j –по сто янные интегриро в ания, a, b, с –ко эф ф ициентыстепенно го ряд а тепл о ем ко сти, Da, Db, Dс –разно сть ко эф ф ициенто в в про цессе перех о д а в еществ а из ф азы 1 в ф азу2. Вел ичина j назыв ается истинно й х имическо й перем енно й. Ее значения ji д л я i-х в еществ прив ед еныв справ о чно й л итературе по термо д инамическим в ел ичинам .
|
|
44 |
|
2.4. П римеры |
реш ения задач |
П ример2.1. Н айти изм енение |
энтро пии при прев ращении 100 г в о д ы, |
|
в зято й |
при 273 К, в пар при 393 К. У д ел ьная энтал ьпия испарения в о д ы при |
|
373 К |
рав на 2255 Д ж /г. У д ел ьная тепл о ем ко сть в о д ы рав на 4,184 Д ж /(К×г). |
|
У д ел ьная тепл о ем ко сть пара при по сто янно м д ав л ении рав на 1,912 Д ж /(К×г).
Р ешен и е:
Общее изменение энтро пии при прев ращении в о д ы, в зято й при 293 К, в пар при 393 К рав но сумм е трех ее изменений, а именно :
1) при нагрев ании 100 г в о д ыо т273 К д о то чки кипения
Tкип dT |
T |
|
|
|
|
|
Д |
ж |
|
373 K |
|||||||||||
(DS)1 = m×Cp,ж . ò |
|
|
|
|
= m×Cp,ж .ln |
кип |
=100 г ×4,184 |
|
|
×ln |
|
|
=130,6 Д ж /К ; |
||||||||
|
|
T |
T |
|
|
К ×г |
273 K |
||||||||||||||
T1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2) при испарении при температуре кипения |
|
|
|
|
|
|
|
|
|
||||||||||||
(DS) |
2 |
|
= m × DHисп =100 г × 2255 Д |
ж / К |
= 604,6 Д ж / К ; |
||||||||||||||||
|
|
|
|
Т кип |
|
|
|
|
|
373 К |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
3) при нагрев ании пара о т373 К д о 393 К |
|
|
|
|
|
|
|
|
|
||||||||||||
T2 |
|
dT |
|
T |
|
|
|
|
Д ж |
|
|
393 K |
|||||||||
(DS)3 = m×Cp,г. ò |
|
|
= m×Cp,г. ×ln |
|
2 |
=100 г |
×1,912 |
|
×ln |
|
=10 Д ж /К . |
||||||||||
|
T |
T |
|
К ×г |
373 K |
||||||||||||||||
Tкип |
|
|
|
|
|
кип |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Общее изменение энтро пии
DS = (DS)1 + (DS)2 + (DS)3 =130,6 Д ж / К + 604,6 Д ж / К +10 Д ж / К = 745,2 Д ж / К.
|
П ример 2.2. Опред ел ить изменение |
энтро пии |
при прев ращении 1 г |
|||
перео х л аж д енно й в о д ы в л ед |
при 263 К, |
считая тепл о емко сть в о д ы рав но й |
||||
4,184 |
Д ж /(К×г), тепл о ем ко сть |
л ьд а |
рав но й 1,883 |
Д ж /(К×г) и |
энтал ьпию |
|
пл ав л ения л ьд а рав но й 334,72 Д ж /г. |
|
|
|
|
||
|
Р ешен и е: |
|
|
|
|
|
|
Зам еним нео братим ый про цесс |
затв ерд ев ания |
перео х л аж д енно й в о д ы |
|||
трем я |
по сл ед о в ател ьными про цессами, со х ранив неизменными |
начал ьно е и |
||||
ко нечно е со сто яние системы, и о пред ел им сумм арно е изменение энтро пии.
1) Изм енение энтро пии при о братимо м по в ышении температурыв о д ыо т
263 К д о 273 К

45
|
|
|
|
Tплав |
dT |
|
|
|
|
|
T |
|
|
|
|
|
|
Д |
ж |
|
|
273 K |
|
|
|
|||||||||
(DS)1 = m×Cp,ж . |
ò |
|
|
|
|
= m×Cp,ж . ×ln |
|
пл ав |
|
=1г ×4,184 |
|
|
|
|
×ln |
|
|
|
|
= 0,156 Д ж /К . |
||||||||||||||
T |
|
|
T |
|
К ×г |
|
|
263 K |
|
|||||||||||||||||||||||||
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2) Изменение энтро пии при о братимо й кристал л изации в о д ы при 273 К |
||||||||||||||||||||||||||||||||||
(учтем , |
что |
по |
зако ну Л ав уазье-Л апл аса т епло во й э ффек т |
прям о го про цесса |
||||||||||||||||||||||||||||||
равен |
по |
абсо лют н о й вели чи н е и |
про т и во по ло ж |
ен |
по |
зн ак у |
т епло во м у |
|||||||||||||||||||||||||||
э ффект уо брат н о го |
про цесса) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
(DS)2 = m × |
DHкрист |
|
|
|
æ |
|
DH |
пл ав |
ö |
|
|
æ |
|
334,72 Д ж |
/ К ö |
= -1,226 Д ж / К ; |
||||||||||||||||||
|
|
|
|
|
= m ×ç |
- |
|
|
÷ |
=1г ×ç |
- |
|
|
|
|
|
|
÷ |
||||||||||||||||
|
Т кип |
|
|
|
|
273 К |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
è |
|
|
Т кип |
ø |
|
|
è |
|
ø |
|
|
|
|
||||||||||||
3) изм енение |
энтро пии |
при |
|
о братимо м о х л аж д ении л ьд а о т273 К д о |
||||||||||||||||||||||||||||||
263 К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
dT |
|
|
|
|
|
|
T |
|
|
|
|
Д |
ж |
|
|
263 K |
|
|
|
||||||||||
(DS)3 = m×Cp,тв. |
ò |
|
= m×Cp,тв. ×ln |
|
1 |
|
=1г ×1,883 |
|
×ln |
|
|
= -0,07 Д ж /К . |
||||||||||||||||||||||
T |
T |
|
|
К ×г |
273 K |
|
||||||||||||||||||||||||||||
|
|
|
|
Tпл ав |
|
|
|
|
|
|
|
|
|
|
|
плав |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Общее |
|
изменение |
энтро пии |
|
нео братимо го |
про цесса |
кристал л изации |
|||||||||||||||||||||||||||
перео х л аж д енно й |
в о д ы |
рав но сум м е |
изм енений |
энтро пии |
о братимых |
|||||||||||||||||||||||||||||
про цессо в , так как энтро пия яв л яется ф ункцией со сто яния: |
|
|
|
|
||||||||||||||||||||||||||||||
S = ( |
S)1 + ( |
|
S)2 + ( |
|
|
S)3 = 0,156 Д ж / К −1,226 Д ж / К − 0,07 Д ж / К = −1,140 Д ж / К. |
||||||||||||||||||||||||||||
П ример2.3. Н айти изменение энтро пии в резул ьтате реакции
Pb + 2AgCl = CdCl2 + 2Ag,
про в о д ящейся в гал ьв аническо м эл ем енте при 101325 Па и 298 К в усл о в иях , ко гд а эл ектро д в иж ущая сил а Е = 0,6753 В. С танд артные энтал ьпии о бразо в ания
х л о рид а кад мия |
и |
х л о рид а серебра со о тв етств енно |
рав ны–390,8 |
и –127,1 |
|
кД ж /мо л ь. |
|
|
|
|
|
Р ешен и е: |
|
|
|
|
|
Т епл о в о й |
эф ф ект реакции в со о тв етств ии с |
зако но м Гесса |
св язан с |
||
энтал ьпиям и о бразо в ания Hо бр,i |
|
|
|
||
|
|
DH = DHо бр.CdCl2 - 2 |
×DHо бр.AgCl = |
|
|
-390,8 кД |
ж м о л ь - 2 ×(-127,1 кД ж |
м о л ь) = –136,6 кД ж /мо л ь. |
|
||
46
Т ак как реакция нео братим а, то |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
DS > |
|
H |
, |
|
|
|
|
|
|||
|
|
|
|
|
|
T |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
H |
W . |
|
|
|
|
|
|||
|
|
|
|
DS = |
|
+ |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
T |
|
|
T |
|
|
|
|
|
|
Д л я расчета DS нео бх о д имо про в ести |
реакцию о братимо . Про в ед я |
реакцию |
||||||||||||||
о братимо в гал ьв аническо м эл ементе, мыпо л учил и бырабо ту |
|
|
|
|
||||||||||||
|
|
|
|
W = z×F×E, |
|
|
|
|
|
|||||||
гд е z –в ал ентно сть реагирующего |
ио на; E –эл ектро д в иж ущая сил а эл ем ента; F |
|||||||||||||||
–числ о Ф |
арад ея. В д анно м сл учае |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
W = 2×96485 (Кл /мо л ь) ×0,6753 В = 130313 Д ж /м о л ь. |
|
|
|
|
||||||||||
Т ак как DН не зав исито тпути про цесса, то и при о братимо м про цессе DН буд ет |
||||||||||||||||
иметь тако е ж е значение; по это м у |
|
|
|
|
|
|
|
|
|
|
|
|||||
DS = |
DH + |
W = |
-136600 Д ж / м о л ь + 130313 Д ж / м о л ь |
= -21,087 |
|
Д |
ж |
, |
||||||||
К |
× м о л ь |
|||||||||||||||
|
T |
T |
|
298,15 К |
|
|
|
|
|
298,15 К |
|
|
||||
то есть |
энтро пия |
в |
про цессе в заимо д ейств ия кад мия |
с х л о рид о м |
серебра |
|||||||||||
энтро пия ум еньшается (незав исимо |
о тто го , про текаетл и реакция о братим о |
ил и |
||||||||||||||
нео братим о ). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
П ример 2.4. |
Вычисл ить изменение |
энергии Гиббса, со про в о ж д ающее |
||||||||||||||
сж атие 7 г азо та при 300 К о т50660 Па д о 303975 Па. |
|
|
|
|
|
|||||||||||
Р ешен и е: |
|
|
æ ¶G |
|
|
|
|
|
|
|
|
|||||
Во спо л ьзуемся |
урав нением |
ö |
|
|
|
|
ко то ро го |
|||||||||
ç |
¶P |
÷ = V(P) , интегриро в анием |
|
|||||||||||||
по л учаем |
|
|
|
è |
øT |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
P2 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
DG = òV(P) ×dP . |
|
|
|
(П–2.1) |
||||||||
|
|
|
|
|
P1 |
|
|
|
|
|
|
|
|
|||
Принимая, что азо т–ид еал ьный газ, имеем V = nRT |
, гд е n –числ о мо л ь газа, |
P |
|
|
|
|
|
|
47 |
|
n = |
m |
= |
|
7 г |
= 0,5 м о л ь . По д став л яя по сл ед нее в ыраж ение в интеграл (П–2.1), |
|
M |
14 г |
|||||
|
|
|
||||
по л учаем в ыраж ение д л я расчета изм енения энергии Гиббса в |
изо термическо м |
||||||||||
про цессе при изм енении д ав л ения о тР1 д о Р2: |
|
|
|||||||||
|
|
|
P2 dP |
|
P |
|
|
||||
|
DG = nRT × ò |
|
2 |
|
|
|
|||||
|
|
= nRT ×ln |
|
; |
|
|
|||||
|
P |
P |
|
|
|||||||
|
|
|
P1 |
1 |
|
|
|
||||
|
|
|
|
|
|
|
|
||||
DG = 0,5 м о л ь×8,314 |
Д ж |
|
×300 К ×ln 303975 Па |
= 2234,56 Д ж . |
|||||||
К × м о л ь |
|||||||||||
|
|
|
|
50660 Па |
|
|
|||||
П ример 2.5. |
Вычисл ить |
станд артные изм енения |
энергии Гиббса |
||||||||
х имическо й реакции |
при 298,15 |
К по |
станд артным |
значениям энтал ьпий |
|||||||
о бразо в ания и абсо л ютных энтро пий (см . Прил о ж ение, табл ица 2). Все реакции про в о д ятся м еж д учистым и тв ерд ым и, ж ид ким и и газо о бразным и в еществ ам и (не в раств о ре).
1)2CO2(г.) = 2CO(г.) + O2(г.);
2)CO(г.) + H2O(ж .) = CO2(г.) + H2(г.).
Р ешен и е:
Расчетизм енения энергии Гиббса в ед ется по ф о рм ул е (2.18)
гд е |
DGo = DHo - 298 × DSo , |
|
|
||||
å i о бр |
|
å i |
|
|
|
||
|
,iпро., д . |
DHno |
- Ho, |
DHDno = |
|||
|
о бр |
,iисх., . |
|
||||
|
i |
|
i |
|
|
|
|
|
å |
i ,iпро д . |
å |
n So - So. |
nDSo = |
|
|
|
|
i ,iисх . |
|
|
|||
|
i |
|
i |
|
|
|
|
Значения изменений |
станд артных |
энтал ьпий |
о бразо в ания и |
абсо л ютных |
|||
энтро пий нах о д им по |
табл ице 2. |
|
|
|
|
|
|
1)DGo298 = DHo298 - 298×DSo298 =
=(2×DHoо бр.С О,298 - 2×DHoо бр.С О2 ,298 )- 298×(2×SoС О,298 - 2×SoС О2 ,298 )=
æ |
æ |
|
Д ж ö |
æ |
|
Д ж öö |
|
||
= ç |
2 ×ç |
-110520 |
|
÷ |
- 2 ×ç |
-393510 |
|
÷÷ |
- |
|
|
||||||||
è |
è |
|
м о л ь ø |
è |
|
м о л ь øø |
|
||
æ |
|
Д ж |
|
Д ж |
ö |
|
Д ж |
|
|
-298×ç |
2×197,54 |
|
|
- 2×213,68 |
|
÷ |
= 575599 |
|
. |
мо л ь |
|
мо л ь |
|||||||
è |
|
|
мо л ь ø |
|
|
||||

48
2)DGo298 = DHo298 - 298×DSo298 =
=(DHoо бр.С О2 ,298 - DHoо бр.С О,298 - DHoо бр.H2O,ж ,298 )-
|
|
-298,15×(SoС О2 ,298 -SoС О,298 -SoH2O,ж ,298 )= |
|
|
|
|
|||||||||||||||||||
æ |
|
|
|
Д ж |
|
æ |
|
|
|
Д ж |
ö æ |
|
|
|
|
Д ж |
öö |
|
|
||||||
= ç |
-393510 |
|
|
|
- |
ç |
-110520 |
|
|
|
|
|
÷ - ç |
-285830 |
|
|
÷÷ |
- |
|
||||||
мо л ь |
мо л ь |
мо л ь |
|
||||||||||||||||||||||
è |
|
|
|
|
è |
|
|
ø è |
|
|
|
|
øø |
|
|
||||||||||
|
æ |
|
|
Д ж |
|
|
|
Д ж |
|
|
|
|
|
|
Д ж ö |
|
|
|
|
Д |
ж |
|
|||
-298×ç |
213,68 |
|
|
|
- |
197,54 |
|
|
|
|
- 70,08 |
|
|
÷ |
=18914 |
|
|
|
. |
||||||
|
мо л ь |
мо л ь |
|
|
мо л ь |
||||||||||||||||||||
|
è |
|
|
|
|
|
|
|
|
|
мо л ь ø |
|
|
|
|
|
|||||||||
П ример2.6. С танд артно е изм енение энергии Гиббса д л я реакции Н 2 + Cl2 = 2HCl
при 298 К и д ав л ении 101325 Па рав но –183,6 кД ж /мо л ь. Н айти изменение энергии Гиббса при то й ж е температуре д л я реакции
Н 2 ( PH2 =202650 Па) + Cl2 ( PCl2 =101325 Па) = 2HCl (PHCl =10133 Па).
Р ешен и е: |
|
|
|
|
|
|
Запишем |
урав нение (2.26) |
применител ьно |
к инд ив ид уал ьно м у газу в |
|||
ф о рм е: |
|
|
|
|
|
|
|
|
G = Go + nRT ×ln |
P |
. |
(П–2.2) |
|
|
|
|
||||
|
|
|
|
P |
|
|
|
|
|
0 |
|
|
|
Зд есь G – энергия Гиббса |
при |
д ав л ении Р, G°– при станд артно м д ав л ении |
||||
Р0=101325 Па. |
Изменение |
энергии Гиббса в |
х о д е х им ическо й реакции |
|||
о пред ел яется по |
урав нению (2.20) |
|
|
|
|
|
|
DG = åni,про д DGi,про д - åni,исх DGi,исх . |
|
||||||||||||||
|
|
|
i |
|
|
|
|
i |
|
|
|
|
|
|
|
|
По д став л яя (П–2.2) в (П–2.3), по л учаем : |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
исх )+ RT × |
|
æ |
|
|
|
|
P |
|
||||
å |
|
|
å |
|
|
|
|
|
|
|
||||||
DG = |
(ni,про д DGi,o про д - ni,исх DGi,o |
|
çni,про дln |
|
i,про д - ni,исх |
|||||||||||
i |
|
|
|
|
|
|
|
i |
è |
|
|
|
|
P0 |
|
|
|
|
|
æ |
|
Pνi,про д ö |
|
|
|
|
|
|
|
νi,про д |
|
||
|
|
|
|
|
|
|
|
|
∏Pi,про д |
|
||||||
|
|
o |
ç |
|
i,про д |
÷ |
|
|
|
o |
|
|
|
i |
|
|
|
DG = DG |
|
+ RT × åçln |
|
|
÷ |
= DG |
|
+ RT × |
|
|
|
, |
|||
|
|
|
νi,исх |
|
|
|
νi,исх |
|||||||||
|
|
|
ç |
|
Pi,исх |
÷ |
|
|
|
|
|
|
ÕPi,исх |
|
||
|
|
|
i è |
|
ø |
|
|
|
|
|
|
|
||||
i
(П–2.3)
ln Pi,исх ö;
P ÷
0 ø
(П–2.4)

49
гд е |
DGo |
– изменение энергии |
Гиббса в |
х о д е |
реакции при |
станд артно м |
|||||||||||||||||||||
д ав л ении. По д став л яя в урав нение (П–2.3) д анные зад ачи, по л учаем : |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
o |
|
|
|
|
|
|
P2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
DG = DG + RT ×ln |
|
HCl |
= |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
P |
× P |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2 |
|
Cl2 |
|
|
|
|
|
|
|
|
|
|
|
= -183600 Д ж /мо л ь +8,314 |
Д ж |
× 298 К ×ln |
|
|
101332 |
|
|
= -196727 Д ж /мо л ь. |
|||||||||||||||||||
К ×мо л ь |
|
202650×101325 |
|||||||||||||||||||||||||
|
|
П ример2.7. Д л я реакции Н 2 |
+ |
|
1 |
О2 = Н 2О (г.) станд артно е изменение эн- |
|||||||||||||||||||||
|
|
2 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
тал ьпии |
рав но –241,82 кД ж /мо л ь, |
а |
станд артно е |
|
изменение энергии |
Гиб- |
|||||||||||||||||||||
бса |
рав но –228,61 кД ж /мо л ь. Вычисл ить изменение энергии Гиббса реакции |
||||||||||||||||||||||||||
при 600 К, есл и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
С Р (H2O) = 30,12 + 11,3×10–3×Т (Д ж /(К×мо л ь)); |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
С Р (H2) = 28,9 + 0,502×10–3×Т (Д ж /(К×мо л ь)); |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
С Р (O2) = 21,14 + 23,81×10–3×Т (Д |
|
ж /(К×м о л ь)). |
|
|
|
|
||||||||||||||||
|
|
Р ешен и е: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Т емпературная зав исимо сть |
энергии |
Гиббса в ыраж ается |
урав нением |
||||||||||||||||||||||
æ |
¶G ö |
= -S, гд е S – энтро пия. Т ак как по |
о пред ел ению G = H – TS, имеем |
||||||||||||||||||||||||
ç |
|
÷ |
|||||||||||||||||||||||||
è |
¶T øP |
|
|
|
|
|
|
|
|
é¶(G T)ù |
|
|
|
|
|
|
|
é¶(1 T)ù |
|||||||||
æ |
¶G ö |
|
G - H |
|
|
|
|
|
|
|
1 |
æ |
¶ |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G ö |
|
|
|
||||||||
ç |
|
÷ |
= |
|
. Рассмо трим в ыраж ение ê |
|
|
|
|
ú |
= |
|
|
×ç |
|
|
÷ + G ê |
|
ú = |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
è |
¶T øP |
|
T |
|
|
|
|
|
|
ë |
|
|
¶T |
|
ûP |
|
|
T |
è |
¶T øP |
ë |
¶T |
ûP |
||||
= |
1 |
æ |
¶G ö |
|
|
|
×ç |
÷ |
- |
||
T |
|||||
|
è |
¶T øP |
|
G |
= |
1 |
× |
ìæ ¶G ö |
- |
G ü |
. По д став им в ыраж ение д л я |
æ ¶G ö ; при |
||||
|
|
í |
|
|
ý |
|||||||
|
|
|
|
÷ |
|
|
|
ç |
÷ |
|
||
T2 |
T |
ç |
|
T |
|
|
|
|||||
è |
¶T ø |
P |
þ |
|
è |
¶T ø |
P |
|||||
|
|
|
|
î |
|
|
|
|
|
|||
это м сл агаемо е |
G со кратится, и по л учится ê |
¶é(G T) |
ú ù= - |
H |
. В применении к |
||||||
|
|
||||||||||
|
|
|
|
T |
|
ë |
¶T |
ûP |
T2 |
||
х имическим |
|
реакциям |
по сл ед нее |
в ыраж ение |
принимает в ид |
||||||
é |
¶(DG T)ù |
= - |
DH |
, гд е |
H – энтал ьпия реакции. Интегрируя это в ыраж ение |
||||||
ê |
|
ú |
T2 |
||||||||
¶T |
|||||||||||
ë |
ûP |
|
|
|
|
|
|
|
|||
о тстанд артно й температурыд о температурыТ , по л учаем :
|
|
|
T |
|
|
DGoT |
= |
DGo298 |
- ò |
DHoT |
× dT, |
T |
298 |
T2 |
|||
|
|
|
298 |
|
|
ил и
50
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
DGo298 |
|
|
|
|
|
ò |
DHoT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
DGT = |
|
|
|
|
|
× T - T × |
T2 |
|
× dT, |
|
|
|
|
|
|
|
|
|
(П–2.5) |
|||||||||||||
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гд е в сл учае д анно й зад ачи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
o |
|
+ |
ò |
|
|
|
|
|
|
|
|
|
|
|
|
o |
|
+ |
|
æ |
P,H |
O - С |
P,H |
|
- |
1 |
С |
P,O |
|
ö |
×dT = |
||||||||
DHT = DH298 |
DCP(T) ×dT = DH298 |
|
çС |
2 |
2 |
2 |
÷ |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
òè |
|
2 |
|
|
|
|
|
|
|
|
|
|
ø |
|
||||||
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= -241820 + òТ |
(30,12 + 11,3×10−3 ×Т - 28,9 - 0,502×10−3 ×Т - |
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,5× 21,14 - 0,5× 23,81×10−3 ×Т )×dT = -241820 + |
òТ (-9,35 -1,107×10−3 ×Т |
)×dT = |
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= -241820 - 9,35×(T - 298) -1,107 ×10−3 |
|
æ |
|
2 |
|
|
|
|
2 ö |
|
|
|
|
|||||||||||||||||||||||||
|
|
×ç T |
|
- 298 |
÷ = |
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ç |
2 |
|
|
|
2 |
|
÷ |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
è |
|
|
|
|
|
|
|
ø |
|
|
|
|
|
|
|
|
|
|
|
|
|
= -239085 - 9,35×T + 5,535×10−4 × T2. |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
По д став л яя |
в ыраж ение |
д л я |
|
|
|
|
DHoT |
|
в |
(П–2.5) |
и интегрируя |
|
о т 298 |
К д о Т , |
||||||||||||||||||||||||||
по л учаем : |
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
-239085 - 9,35 ×T + 5,535×10−4 × T2 |
|
|
|
|
|||||||||||||||||||||||
|
o |
|
DGo298 |
|
|
|
|
ò |
|
|
|
|
||||||||||||||||||||||||||||
|
DGT |
= |
|
|
|
|
|
× T |
- T × |
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
× dT = |
|||||||||
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
-228610 |
×T |
- T |
× |
|
ò |
æ -239085 |
- |
9,35 |
+ 5,535 |
×10 |
−4 |
ö |
× dT = |
|
|
|
||||||||||||||||||||||
|
|
|
298 |
|
|
|
ç |
|
T2 |
|
T |
|
|
|
|
÷ |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
è |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ø |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
æ |
|
|
|
|
æ |
|
|
|
1 |
|
1 |
ö |
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ö |
||||
= -767 × T - T ×ç |
-239085 ×ç |
|
|
|
|
|
- |
|
÷ |
- 9,35 |
×ln |
|
|
|
+ 5,535×10−4 ×(T - 298)÷ = |
|||||||||||||||||||||||||
|
298 |
T |
298 |
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
è |
|
|
|
|
è |
|
|
ø |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ø |
||||||||
= -239085 + 88,105× T + 5,535×10−4 × T2 - 9,35× T ×lnT.
По д стано в ко й в по сл ед нее в ыраж ение Т = 600 К по л учаем иско мый резул ьтат:
DGo600 = -239085 + 88,105 ×600 + 5,535 ×10−4 ×6002 -9,35 ×600 ×ln600 = = -221910 (Д ж /м о л ь).
