
- •1.Методы аналитической химии: методы пробоотбора, методы разложения проб, методы разделения и концентрирования, методы обнаружения и количественного определения. Гибридные методы анализа
- •2.Виды анализа (качественный, количественный, структурный). Анализ изотопный, молекулярный, функциональный, фазовый. Методы анализа (физ, хим и физ-хим)
- •1)Классиф-ия анализа в зависимости от цели:
- •2)Класс-ция в зависимости от того,какие компоненты необходимо обнаружить:
- •3.Важанейшие хар-ки аналитической р-ии. Системат. Метод анализа. Дробный метод анализа
- •4.Методы расчета концентрации вещества по величине аналитического сигнала: метод калибровочного графика, метод стандартов, метод добавок.
- •5. Качественный анализ катионов. Способы устранения мешающего влияния ионов.
- •6.Общая х-ка и аналитические р-ии катионов 1 аналит. Группы.
- •7.Общая х-ка и аналит. Р-ии катионов 2 аналит. Группы.
- •11. Катионы V аналитической группы.
- •Вопрос 12. Катионы VI аналитической группы.
- •14. Систематический ход анализа катионов IV-VI аналитических групп катионов по кислотно-основной классификации
- •16. Анализ неизвестного неорганического вещества. Предварительные испытания. Переведение анализируемого вещества в раствор. Проведение анализа.
- •21. Расчет состава равновесных смесей протолитов при заданном рН
- •25. Влияние различных факторов на процесс комплексообразования и устойчивость комплексных соединений (природа комплексообразователя и лиганда, температура, ионная сила, побочные реакции)
- •26. Влияние концентрации реагирующих в-в на комплексообразование. Расчет молярных долей свободных ионов металла и комплексов в равновесной смеси.
- •27.Применение орг. Реагентов в аналитической химии. Функц.-аналитическая группировка. Классификация орг. Реагентов по типу донорных атомов. Важн. Орг. Реагенты, исп. В хим. Анализе.
- •29.Влияние различных факторов на растворимость малорастворимых электролитов. Общие принципы растворения осадков малорастворимых электролитов.
- •31. Формальный электродный потенциал. Влияние различных факторов(температура, посторонние ионы, рН, побочные реакции) на протекание овр. Использование овр для маскировки нежелательного влияния ионов.
- •32. Применение методов ов титрования: определение йодного числа, активного хлора в гипохлорите натрия
- •33. Понятие о механизме образования осадка. Образование первичных центров кристаллизации. Относительное пересыщение и его влияние на характер образующегося осадка
- •34. Константа равновесия овр, использование овр в аналитической химии и фармац. Анализе. Связь константы равновесия с электродными потенциалами.
- •35. Расчет рН смеси сильных кислот, слабых кислот, смеси слабой и сильной кислоты.
- •37. Виды гравиметрических определений. Осаждаемая и гравиметрическая формы, основные этапы гравиметрических определений. Г. В фарм анализе
- •39. Разложение пробы. Разложение пробы путем растворения (без хим р-ции и с хим р-цией), сплавления и термического разложения. Нежелательные процессы
- •43. Правила работы с округленными величинами. Понятие о значащих цифрах
- •44. Основные характеристики аналитической методики: предел обнаружения, предел определения, границы определяемых содержаний, чувствительность, воспроизводимость, правильность.
- •46. Способы описания количественного состава растворов. Расчеты в титриметрических методах анализа, связанные с приготовлением растворов титрантов и титрованием.
- •47. Способы титрования: прямое, прямое реверсивное, обратное титрование, титрование заместителя, косвенное титрование. Стандартные в-ва в титриметрии, требования, предъявляемые к стандартным в-вам.
- •48. Понятие о кривой титрования, степень оттитрованности, кривые титрования в ациди- и алкалиметрии, факторы, влияющие на величину скачка к-о титрования
- •103. Полярографическая кривая. Полярографическая волна. Потенциал полуволны. Уравнение Ильковича.
- •104. Вольтамперометрический метод анализа. Полярография и собственно амперометрия. Условия, необходимые для вольтамперометрических измерений.
21. Расчет состава равновесных смесей протолитов при заданном рН
Рассмотрим двухосновную кислоту

Уравнение материального баланса
![]()
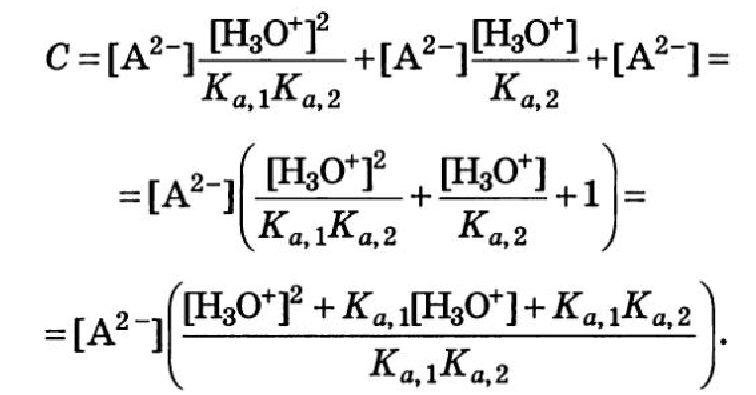

Для одноосновной кислоты:
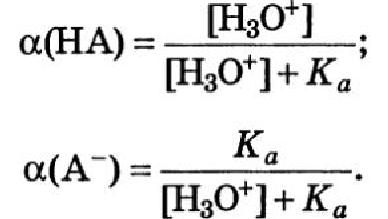

22. Расчет рН водных растворов сильных кислот и оснований, +при концентрации меньше, чем 10*-6
![]()
С > 10*-6, автопротолизом пренебрегаем
![]()
C < 10*-6
![]()
![]()
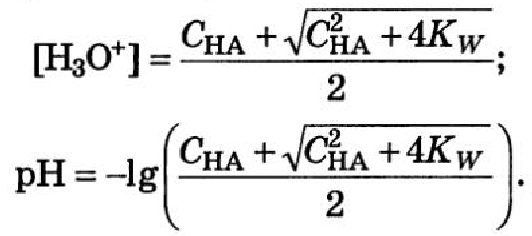
Для оснований
![]()
![]()
23. Кислотно-основные буферные растворы, уравнение Гендерсона-Хассельбаха. Общая характеристика. Принцип действия. Расчет рН буферного раствора. Буферная емкость.
Буферные растворы – системы, поддерживающие определенное значение какого-либо параметра (рН, потенциала системы и т.д.) при изменении состава системы.
Кислотно-основный называется буферный раствор, сохраняющий примерно постоянным значение рН при добавлении к нему не слишком больших количеств сильной кислоты или сильного основания, а также при разбавлении и концентрировании. Кислотно-основные буферные растворы содержат слабые кислоты и сопряженные с ним основания. Сильная кислота при добавлении к буферному раствору»превращается» в слабую кислоту, а сильное основание – в слабое основание. Формула для расчета рН буферного раствора: рН = рКо+ lg Cо /Сс Это уравнение Гендерсона – Хассельбаха. Из этого уравнения следует, что рН буферного раствора зависит от соотношения концентраций слабой кислоты и сопряженного с ней основания. Поскольку при разбавлении это соотношение не изменяется, то и рН раствора остается постоянным. Разбавление не может быть безграничным. При очень значительном разбавлении рН раствора изменится, так как, во-первых, концентрации компонентов встанут настолько малыми, что уже нельзя будет пренебречь автопротолизом воды, а во-вторых, коэффициенты активности незаряженных и заряженных частиц по-разному зависят от ионной силы раствора.
Буферный раствор сохраняет постоянные величины рН при добавлении лишь не очень больших количеств сильной кислоты или сильного основания. Способность буферного раствора «сопротивляться» изменению рН зависит от соотношения концентраций слабой кислоты и сопряженного с ней основания, а также от их суммарной концентрации – и характеризуется буферной емкостью.
Буферная емкость – отношение бесконечно малого увеличения концентрации сильной кислоты или сильного основания в растворе( без изменения объема) в вызванному этим увеличением изменению рН(стр.239, 7.79)
В сильнокислой и сильнощелочной среде буферная емкость значительно увеличивается. Растворы, в которых достаточно высока концентрация сильной кислоты или сильного основания, также обладают буферными свойствами.
Буферная емкость максимальна при рН=рКа. Для поддержания некоторого значения рН следует использовать такой буферный раствор, у которого величина рКа входящий в его состав слабой кислоты находится как можно ближе к этому рН. Буферный раствор имеет смысл использовать для поддержания рН, находящегося в интервале рКа+_ 1. Такой интервал называется рабочей силой буфера.
24.Основные понятия, связанные с комплексными соединениями. Классификация комплексных соединений. Константы равновесия, используемые для хар-ки комплексных соединений: константы образования, константы диссоциации (общие, ступенчатые, термодинамические, реальные и условные концентрационные)
Чаще всего комплексом называют частицу, образованную в рез-те донорно-акцепторного взаимодействия центрального атома(иона), называемого комплексообразователем, и заряженных или нейтральных частиц, называемых лигандами. Комплексообразователь и лиганды должны самостоятельно существовать в той среде, где происходит р-ция комплексообразования.
Комплексное соединение состоит из внутренней и внешней сфер. К3(Fe(CN)6)- К3-внешняя сфера, Fe-комплексообразователь, CN- лиганд, комплексообразователь+ лиганд=внутренняя сфера.
Дентатностью называется число донорных центров лиганда, участвующих в донорно-акцепторном взаимодействии при образовании комплексной частицы. Лиганды бывают монодентатными(Cl-, H2O, NH3), бидентатными( C2O4(2-), 1,10-фенантролин) и полидентатными.
Координационным числом называют число донорных центров лигандов, с которыми взаимодействует данный центральный атом. В выше указанном примере: 6-координационное число. (Ag(NH3)2)+ –координационное число 2, так как аммиак монодентатным лигандом, а в (Ag(S2O3)2)3- - координационное число 4, так как тиосульфат ион –бидентатный лиганд.
Классификация.
1)В зависимости от своего заряда: анионные( (Fe(CN)6)3-), катионными((Zn(NH3)4)2 +) и незаряженными или комплексы-неэлектролиты(HgCl2).
2)В зависимости от числа атомов металла: моноядерные и полиядерные комплексы. В состав моноядерного комплекса входит один атом металла, а в состав полиядерного- два и более. Полиядерные комплексные частицы, содержащие одинаковые атомы металла, называют гомоядерными(Fe2(OH)2)4+ или Be3(OH)3)3+), а содержащие атомы различных металлов- гетероядерными(Zr2Al(OH)5)6+).
3)В зависимости от хар-ра лигандов: однороднолигандные и разнолигандные (смешаннолигандные) комплексы.
Хелаты-циклические комплексные соединения ионов металлов с полидентатными лигандами(обычно органическими), в которых центральный атом входит в состав одного или нескольких циклов.
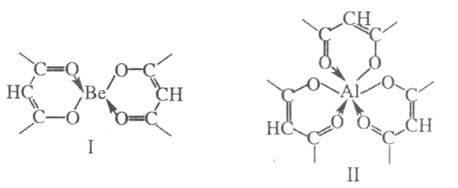
Константы. Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости.
Если
справочные данные по ступенчатым
константам нестойкости отсутствуют,
пользуются общей константой нестойкости
комплексного иона:
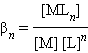
Общая константа нестойкости равна произведению ступенчатых констант нестойкости.
В
аналитической химии вместо констант
нестойкости в последнее время пользуются
константами устойчивости комплексного
иона:
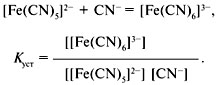
Константа устойчивости относится к процессу образования комплексного иона и равна обратной величине константы нестойкости: Куст = 1/Кнест.
Константа устойчивости характеризует равновесие образования комплекса.
Термодинамическая и концентрационная константы см. стр. 313.
