
- •5. Ядерная модель атома по Резерфорду. Противоречия ядерной модели.
- •6. Постулаты Бора. Строение атома водорода по Бору. Линейчатость спектров
- •7. Оптический спектр водорода
- •15. Графическое изображение электронных структур. Правило Хунда.
- •18. Радиоактивность: альфа-, бета-, гамма-излучение.
- •19. Радиоактивный распад. Типы радиоактивного распада. Закон смещения.
- •22. Основные виды химической связи(ковалентная, ионная, металлическая).
- •27. Ионная связь и её свойства.
- •28. Межмолекулярные силы. Силы Ван-дер-Ваальса.
- •29. Водородная связь
- •30. Металлическая связь и её особенности.
28. Межмолекулярные силы. Силы Ван-дер-Ваальса.
Сила Ван-де-Ваальса.
Между частицами растворителя и растворённого вещества действуют химические и физические силы обуславливающие образование раствора:
- ориентационные силы – возникают между молекулами с постоянными электрическими дипольными молекулами, т.е. между молекулами у которых есть положительно и отрицательно заряженные полюса.
Ориентационные
силы стремятся расположить молекулы
упорядоченно так, чтобы векторы
электрических дипольных моментов были
ориентированы вдоль одной прямой. Такое
взаимное расположение диполей
энергетически выгодно. Преобладание
ориентационных сил соответствуют
растворы полярных веществ в полярных
растворителях: 3-метиламин в диэтиловом
эфире
- индукционные силы – возникают в следствие поляризуемости молекул, т.е. потому что силовое поле молекул полярного растворителя может вызывать увеличение электрических дипольных моментов у молекул не полярных растворённых веществ.
Индукционные силы всегда гораздо слабее ориентационных, в том числе и для раствора 3-метиламина в диэтиловом эфире.
- дисперсионные силы – силы взаимодействия мгновенных электрических дипольных моментов в соседних атомах, в следствие движения ē.
Действие дисперсионных сил объясняет существование растворов неполярных веществ в неполярных растворителях. (нефть, жидкий воздух). Дисперсионные силы действуют между любыми молекулами.
29. Водородная связь
Водородная связь существует внутри молекул отдельных веществ, а также возникает между молекулами некоторых веществ. Образуется между атомами водорода и электроотрицательными элементами в соединениях с: кислородом, азотом, фтором. Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода. Например: спирты, карбоновые кислоты и т.д.
30. Металлическая связь и её особенности.
Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи. Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Многие металлы обладают высокой твёрдостью, например хром, молибден, тантал, вольфрам и др. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связи.
31. Написать электронные формулы элементов S-семейства, p-семейства, d-семейства, f-семейства.
1s2; 2s2, 2p6; 3s2, 3p6; 4s2, 3d10, 4p6; 5s2, 4d10, 5p6; 6s2, 5d10, 4f14, 6p6; 7s2, 6d10, 5f14, 7p6.
На каждой орбитали могут находиться, согласно запрету Паули, только два электрона с антипараллельными спинами.
s – подуровень повторяется на всех энергетических уровнях, всегда имеет максимальное число электронов s² и ему соответствует значение 1 = 0.
Второй
энергетический уровень 2s²2р6.
На нем находятся два подуровня s
и р. Так как два подуровня s
1 всегда = 0. То при n
= 2, значение 1 = 1, будет соответствовать
р – подуровню и количество электронов
на этом подуровне будет равно 2(21+1) = 6,
а число орбиталей 21+1 = 3. Графически это
будет выглядеть таким образом:
![]()
р – орбиталь имеет гантелевидную форму, согласно значениям магнитного квантового числа при n = 2, 1 = 1 и m = – 1; 0; + 1 имеет три положения в пространстве (рис. 1).
Третий энергетический уровень 3s²3р63d10. На нем три подуровня: подуровни предыдущего уровня s² и р6, и новый d – подуровень со значением n = 3; 1 = 2. На d – подуровне 10 электронов и 5 орбиталей, имеющих четырехлепестковую форму и пять положений в пространстве (см. рис. 1).
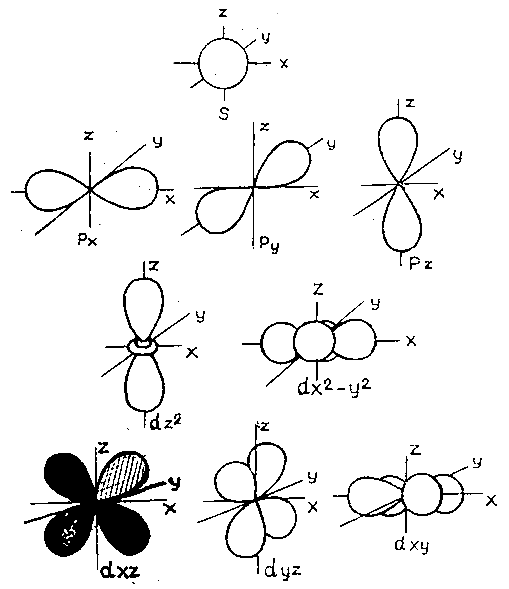
Графическое
изображение d
– подуровня:
![]()
На четвертом энергетическом уровне 4s²4р64d104f14, кроме подуровней s –, p, d –, появляется f – подуровень, которому соответствуют квантовые числа n = 1, l = 3, m = – 3, –2, –1, 0, +2, +3.
Количество
электронов на f – подуровне 14, количество
орбиталей 7. Графическое изображение
f – подуровня:
![]()
Заполнение 3d – подуровня начинается с 21 элемента скандия, 4d – подуровня с39 элемента иттрия, 5d – подуровня с 57 элемента лантана, 6d – подуровня с 89 элемента актиния, 4f – подуровня с 58 элемента церия, и 5f – подуровня с 90 элемента тория.
-
У элементов главных подгрупп валентные электроны показывают высшую валентность атома и располагаются на последнем энергетическом уровне на s – и р – подуровнях и их сумма равна номеру группы. Главная подгруппа включает элементы больших и малых периодов.
-
У элементов побочных подгрупп валентные электроны располагаются на последнем энергетическом уровне на s – подуровне и на предпоследнем энергетическом уровне на d – подуровне и в сумме составляют номер группы.
Побочная подгруппа включает элементы только больших периодов.
