
- •5. Ядерная модель атома по Резерфорду. Противоречия ядерной модели.
- •6. Постулаты Бора. Строение атома водорода по Бору. Линейчатость спектров
- •7. Оптический спектр водорода
- •15. Графическое изображение электронных структур. Правило Хунда.
- •18. Радиоактивность: альфа-, бета-, гамма-излучение.
- •19. Радиоактивный распад. Типы радиоактивного распада. Закон смещения.
- •22. Основные виды химической связи(ковалентная, ионная, металлическая).
- •27. Ионная связь и её свойства.
- •28. Межмолекулярные силы. Силы Ван-дер-Ваальса.
- •29. Водородная связь
- •30. Металлическая связь и её особенности.
19. Радиоактивный распад. Типы радиоактивного распада. Закон смещения.
Радиоактивный распад – спонтанное изменение состава или внутреннего строения нестабильных атомных ядер (заряда Z, массового числа A) путём испускания элементарных частиц, гамма-квантов и/или ядерных фрагментов. Естественная радиоактивность — самопроизвольный распад атомных ядер, встречающихся в природе.
Искусственная радиоактивность — самопроизвольный распад атомных ядер, полученных искусственным путем через соответствующие ядерные реакции.
Радиоактивный распад происходит в соответствии с так называемыми правилами смещения, позволяющими установить, какое ядро возникает в результате распада данного материнского ядра. Правила смещения:
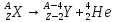 ,
для
α распада,
,
для
α распада,
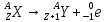 ,
для β
распада,
,
для β
распада,
Где
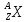 —материнское
ядро, Y—
символ дочернего ядра,
—материнское
ядро, Y—
символ дочернего ядра,
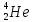 — ядро гелия,е—символическое
обозначение электрона (заряд его равен
—1, а массовое число — нулю). Правила
смещения являются ничем иным, как
следствием двух законов, выполняющихся
при радиоактивных распадах, — сохранения
электрического заряда и сохранения
массового числа: сумма зарядов (массовых
чисел) возникающих ядер и частиц равна
заряду (массовому числу) исходного
ядра.
— ядро гелия,е—символическое
обозначение электрона (заряд его равен
—1, а массовое число — нулю). Правила
смещения являются ничем иным, как
следствием двух законов, выполняющихся
при радиоактивных распадах, — сохранения
электрического заряда и сохранения
массового числа: сумма зарядов (массовых
чисел) возникающих ядер и частиц равна
заряду (массовому числу) исходного
ядра.
Возникающие в результате радиоактивного распада ядра могут быть, в свою очередь радиоактивными. Это приводит к возникновению цепочки или ряда радиоактивных превращении, заканчивающихся стабильным элементом. Совокупность элементов, образующих такую цепочку, называется радиоактивным семейством.
20. Химический элемент в свете строения атома.
Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв, регламентированные ИЮПАК и приводятся, в частности, в таблице Периодической системы элементов Менделеева.
26. Донорно акцепторный механизм образования ковалентной связи.
Донорно-акцепторный механизм образования ковалентной связи - это способ образования ковалентной связи между двумя атомами или группой атомов, осуществляемый за счет не поделённой пары электронов атома-донора и свободной орбитали атома-акцептора.
Донор - элемент, имеющий свободную пару электронов. Акцептор имеет пустую орбиталь. По этому принципу NH4 (аммоний).
21. Природа химической связи. Количественные характеристики связи.
Химическая связь имеет в основном электромагнитный характер. При образовании химической связи происходит перераспределение электронной плотности связывающихся атомов. По характеру этого распределения химические связи классифицируют на ковалентную, ионную, координационную, металлическую. По числу электронных пар, участвующих в образовании данной химической связи, различают простые (одинарные), двойные, тройные химические связи, по числу непосредственно взаимодействующих атомов - двух-, трех- и многоцентровые.
Энергией связи называют ту энергию, которую необходимо невозбужденном состоянии. Эта величина определяет прочность связи. Чем больше энергия, затрачиваемая на разрыв связи, тем прочнее связь. Например, энергия связи Н—Н в молекуле водорода равна 436 кДж/моль.
Длиной связи называют среднее расстояние между ядрами, отвечающее минимуму энергии системы. В ряду аналогичных по составу молекул длины связей также изменяются закономерно. Например, в ряду HF, НС1, HBr, HI длина связи увеличивается с возрастанием размера атома и соответственно равна 0,091; 0,127; 0,141; 0,160нм. Кроме того, на длину связи влияет ее кратность, которая определяется числом электронных пар, связывающих два атома. С увеличением кратности связей происходит их упрочнение, межъядерные расстояния уменьшаются.
Валентные углы. Это углы между связями в молекуле. Их схематически можно представить как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые, проведенные через два ядра, называют линиями связи. Величины валентных углов зависят от природы атомов и характера связи. Простые двухатомные молекулы всегда имеют линейную структуру. Трехатомные и более сложные молекулы могут обладать различными конфигурациями.
