
- •5. Ядерная модель атома по Резерфорду. Противоречия ядерной модели.
- •6. Постулаты Бора. Строение атома водорода по Бору. Линейчатость спектров
- •7. Оптический спектр водорода
- •15. Графическое изображение электронных структур. Правило Хунда.
- •18. Радиоактивность: альфа-, бета-, гамма-излучение.
- •19. Радиоактивный распад. Типы радиоактивного распада. Закон смещения.
- •22. Основные виды химической связи(ковалентная, ионная, металлическая).
- •27. Ионная связь и её свойства.
- •28. Межмолекулярные силы. Силы Ван-дер-Ваальса.
- •29. Водородная связь
- •30. Металлическая связь и её особенности.
7. Оптический спектр водорода
Оптический спектр - спектр излучения или спектр поглощения оптического излучения. Различают:
- линейчатые оптические спектры;
- полосатые оптические спектры, состоящие из групп близких спектральных линий;
- сплошные оптические спектры, соответствующие излучению или поглощению электромагнитного излучения в широком диапазоне длин волн.
При
облучении, освещении, нагревании ē
переходит на удалённые орбиты. Такое
состояние атома называется возбуждённым,
и там ē может находиться
 затем он переходит с удалённых орбит
на ближние, что и обуславливает линейчатый
спектр атомов:
затем он переходит с удалённых орбит
на ближние, что и обуславливает линейчатый
спектр атомов:
1) при переходе ē с более высоких энергетических уровней на первый, то получаются линии лежащие в УФ-части спектра (серия Лаймана)
 ,
при
этом выделяется много энергии, больше
10 эВ, а линии мельше 400 нм.
,
при
этом выделяется много энергии, больше
10 эВ, а линии мельше 400 нм.
2)
При переходе ē с удалённых орбит на
вторую,
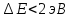
Λ = от 700 до 450, линии этой части спектра, находятся в видимой части спектра и носят название серия Бальмера.
3)
При переходе ē с удалённых на 3-ю,
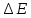 – уменьшается, а λ увеличивается, больше
700, линии – инфракрасная часть спектра,
серия Пашена.
– уменьшается, а λ увеличивается, больше
700, линии – инфракрасная часть спектра,
серия Пашена.
Существуют
и другие серии спектра атома
 ,
если атому водорода сообщена энергия
более 13,6 эВ, то атом ионизируется.
,
если атому водорода сообщена энергия
более 13,6 эВ, то атом ионизируется.
8. Порядковый номер элемента. Закон Мозли: Мозли (1913) доказал, что заряд ядра равен порядковому номеру элемента(закон Мозли).
Корни квадратные из обратного значения длин волн рентгеновских лучей находятся в линейной зависимости от порядкового номера элемента.
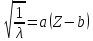 ,
где Z
– номер
элемента, a,b
– константы, отвечающие определённому
виду рентгеновского излучения.
,
где Z
– номер
элемента, a,b
– константы, отвечающие определённому
виду рентгеновского излучения.
Значение закон Мозли:
-
Подтвердил правильность положения элементов в ПС, перестановка Менделеевым некоторых пар элементов (Co-Ni, Te-I), нарушающая последовательность атомных масс была правильной.
-
Подтвердилось слоистое строение атома
-
Закон позволил предсказать ещё некоторые элементы (Hf – 1923 г.)
9. Современная формулировка закона Менделеева. Физический смысл периодического закона.
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов. Итак, физический смысл периодического закона состоит в том, что периодическое изменение свойств элементов находится в полном соответствии с периодически возобновляющимися на все более высоких энергетических уровнях сходными электронными структурами атомов. С их закономерным изменением закономерно изменяются физические и химические свойства элементов.
17. Строение ядра. Изобары. изотопы.
Ядро состоит из нейтронов (n) и протонов (p). р имеет заряд +1 и mр =1 а.е.м.
Считается, что р и n энергично обмениваются π-ми зонами:
+11р+0-1π→01n; 01n+0+1π→+1-1p
Кроме этого существует ряд теорий, которые предполагают наличие некоторых простейших частиц квантов, из которых построены остальные элементарные частицы.
Массовое число = n+p, а № элемента в периодической системе = p.
Существуют изотопы – ядра одного и тог же элемента с одинаковым номером и одинаковым зарядом ядра, но с разным числом n (16O, 17O, 18O).
Многие тяжелые элементы имеют на стабильные ядра, способные к радиоактивному распаду. Такие вещества принято характеризовать периодом полураспада, т.е. временем, за которое распадается половина исходного кол-ва данного изотопа. Масса радиоактивного изотопа через некоторое время после начала распада можно охарактеризовать формулой: m=(1/2)n*m0, где n – число периодов полураспада.
Существует 3 основных механизма радиоактивного полураспада:
это α-распад, при котором ядро излучает α-частицу, в результате его масса уменьшается на 4 единицы, а заряд на 2l.
β-распад – излучаются β-частица = ē, поэтому масса ядра практически остается постоянной, а заряд увеличивается на 1 единицу.
γ-распад – изменяется только энергия ядра, а масса и заряд не изменяются.
Элементы, у которых ядра содержат одинаковое число протонов и разное число нейтронов, то есть, у которых порядковый номер одинаков, а массовые числа различны, называют изотопами. Элементы, у которых ядра содержат разное число протонов и одинаковое суммарное число протонов и нейтронов, то есть у которых порядковые номера различаются, а массовые числа одинаковы, называются изобарами.
10. Основные положения квантовой химии:
1. Дискретность - вещество состоит из отдельных микрочастиц. Именно эти частицы изучает квантовая химия. Идею квантования энергии, основываясь на спектрах излучения нагретых тел, выдвинул Планк.
2.
Корпускулярно-волновой
дуализм.
Микрочастицы в микромире обладают и
свойствами частицы, и свойствами волны.
Впервые корпускулярно-волновой дуализм
был предположен для света (электромагнитного
излучения). С одной стороны свет, это
электромагнитная волна и для него
характерны такие свойства, как
интерференция и дифракция, а с другой
стороны при наблюдении явления
фотоэффекта͵
было
выдвинуто предположение, что свет это
поток частиц - фотонов. Была измерена
даже масса фотона. Энергия фотона равна
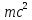 .
.
3. Вероятностный характер законов микромира.В 1927 ᴦ. Гейзинберг выдвинул принцип неопределённости; согласно этому принципу невозможно точно определить местоположение частицы и её импульс в данный момент времени.
Двойственная природа электрона. Уравнение де Бройля:
В классической механике рассматривается два вида движения: движение тела с локализацией перемещающегося объекта в каждой точке траектории в определенный момент времени и движение волны, делокализованной в пространстве среды. Для микрообъектов такое разграничение движения невозможно. Эту особенность движения называют корпускулярно-волновым дуализмом. Корпускулярно-волновой дуализм - способность микрочастицы, обладающей массой, размерами и зарядом, одновременно проявлять и свойства, характерные для волн, например, способность к дифракции. В зависимости от того, какие свойства частиц изучаются, они проявляют либо одни, либо другие свойства. Автором идеи корпускулярно-волнового дуализма стал А. Эйнштейн, который предложил рассматривать кванты электромагнитного излучения - фотоны - как движущиеся со скоростью света частицы, имеющие нулевую массу покоя. Их энергия равна
E
=
 = hν
=
= hν
=
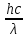 ,
,
где m - масса фотона, с - скорость света в вакууме, h - постоянная Планка, ν - частота излучения, λ - длина волны. В 1924 г. французский физик Л. де Бройль предположил, что корпускулярно-волновыми свойствами обладает не только фотон, но и любая другая частица, движущаяся со скоростью v. Он получил уравнение, связывающее скорость движения частицы с длиной волны производимого ей электромагнитного излучения (уравнение де Бройля):
λ
=
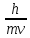 ,
,
где m - масса частицы, v - ее скорость, h - постоянная Планка; величина λ получила название длины волны де-Бройля. Для объектов, обладающих сравнительно большой массой, волновые свойства обнаружить не удается. Так, для тела массой 1 г, летящего со скоростью 1 м/с, длина волны де-Бройля имеет порядок 1·10− 30 м, что на 15 порядков меньше размера ядра атома, и не поддается измерению. В то же время для нейтрона массой около 1,7·10−27 кг, движущегося со скоростью 500 м/с, длина волны де Бройля составляет уже примерно 1·10−9 м. Этой величиной пренебрегать уже нельзя. Гипотеза де Бройля была подтверждена экспериментально. В 1927 г. американские физики К. Дэвиссон и Л. Джермер и независимо от них англичанин Дж.-П. Томсон обнаружили дифракцию электронов на кристалле никеля.
12. Квантовые числа.
1. Главное квантовое число(n): n=1,2,3. Буквенное обозначение KLMNO
2. Орбитальное l
3. Магнитное me
4. Магнитное спиновое число ms.
Квантовое число дает понятие в каком периоде находится число. Характеризует:-номер энергетического уровня; интервал энергии электронов , находящихся на этом уровне; размеры орбиталей; число подуровней данного энергетического уровня( 1 уровень состоит из 1 подуровня); - в ПСХЭ значению главного квантового числа соответствует номер периода. Емкость энергетического уровня определяется по формуле: 2n2 Орбитальное кв. число l- определяет момент движения ē (момент импульса) точное значение его энергии и форму орбитами. l=0s, l=1p, l=2d, l=3f. Магнитное кв. число me- определяет возможные ориентации электронного облака в пространстве. Кол-во чисел= кол-ву возможных ориентаций ē облака в пространстве.
13. Принцип Паули s p d электроны типы электронных орбиталей.
В атоме не может быть двух эл. имеющих одинаковый набор всех четырех кв. чисел. В каждой атомной орбитали может размещаться максимально два электрона (с противоположными спинами). Имеет разную ориентацию в пространстве. (принцип Паули). В случае s-орбитали электронное облако сферическое. В случае p-орбиталей форма электронного облака гантелеобразная:
14. В каких группах и подгруппах и подгруппах находятся s p d f элементы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне). В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на:
s- элементы (элементы главной подгруппы I и II групп),
p- элементы (элементы главных подгрупп III - VII групп),
d- элементы (элементы побочных подгрупп),
f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам. Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы). Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
