
3 семестр - Физическая химия
.pdf14.Растворы электролитов. Зависимость электропроводности растворов электролитов от концентрации. Связь электропроводности со скоростями движения ионов. Причины различий в подвижности ионов
15.Ионная сила раствора. Средний ионный коэффициент активности.
16.Электродные процессы. Электродвижущие силы. Скачки потенциалов на границе металл – раствор.
17.Обратимые электрохимические цепи. Термодинамические характеристики химических реакций.
18.Типы полуэлементов (электродов). Электродные потен-
циалы.
19.Химические цепи. Применение потенциометрических
методов.
20.Скорость химических реакций. Основной постулат химической кинетики. Молекулярность и порядок реакции.
21.Кинетические уравнения односторонних реакций.
22.Зависимость скорости реакции от температуры. Энергия активации.
3.5. Примеры решения задач Пример 1. Определить тепловой эффект реакции
СО + 2 Н2 = СН3ОН (г) при 298 К и стандартном давлении:
1) Р = const; 2) V = const.
Решение
Тепловой эффект реакции при 298 К и Р = const можно рассчитать по теплотам образования и сгорания веществ, участвующих в реакции. Теплоты образования (∆Н0f, 298) и сгорания (∆Н0с, 298) при стандартных условиях приводятся в справочниках. Используя следствия из закона Гесса, определим тепловой эффект реакции по теплотам образования и сгорания.
Тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции:
10
∆Н0298 = ∑(νi∆Н0f, 298)прод. – ∑(νi ∆Н0f, 298)исх. |
1) |
Тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции:
∆Н0298 = ∑ (νi∆Н0с, 298)исх. – ∑(νi∆Н0c, 298)прод. . |
(2) |
Найдем тепловой эффект реакции СО + 2 Н2 = СН3ОН(г) по теплотам образования. Справочные данные приведены в приложении (табл. П1).
H0298 |
Hf0,298CH3OH ( Hf0,298CO 2 Hf0,298H2 ) |
||||
201,0 ( 110,53 2 0) 90,47кДж / моль. |
|
||||
По теплотам сгорания: |
|
|
|
||
( Hc,298CO0 |
2 Hc,298H0 |
2 ) Hc,298CH0 |
3OH |
|
|
( 283,01 2 285,84) 765,14 90,55кДж / моль.
Тепловой эффект реакции при Р = const (∆Н) и тепловой эффект реакции при V = const (∆U) связаны между собой уравнением
∆Н0298 = ∆U0298 + ∆nRT,
где ∆n – изменение числа молей газообразных продуктов реакции и исходных веществ.
∆n = ∑nпрод. – ∑nисх.вещ. , тогда ∆U0298 = ∆Η0298 – ∆nRT. Для нашей реакции ∆ n = -2, R = 8,31À10-3 кДж/(мольÀК),
Т = 298 К.
Тепловой эффект реакции при 298 К и V = const равен:
∆U0298 = -90,47 + 2 À 8,31 À 10-3 À 298 = -85,52 кДж/моль.
Пример 2. Определить тепловой эффект реакции СО + 2 Н2 = СН 3ОН(г) при 500 К, Ср ≠ f (T) .
11
Решение Зависимость теплового эффекта реакции от температуры
выражается уравнением закона Кирхгофа: |
|
|||
|
d |
H |
C0p . |
(3) |
|
|
|
||
|
|
dt |
|
|
После интегрирования уравнения Кирхгофа в интервале |
||||
температур от 298 до Т получим: |
|
|||
|
|
|
Т |
|
∆Н0Т = |
∆Η0298 + Ср0 dT . |
(4) |
||
|
|
298 |
|
|
Изменение теплоемкости химической реакции ∆С0р при |
||||
стандартных условиях рассчитывают по уравнению |
|
|||
∆С0р 298 = ∑νi C0p 298 прод. – ∑νi Cpi, 298 исх . |
(5) |
|||
Если считать, что теплоемкость не зависит от температуры Ср≠ f (T), то тепловой эффект реакции можно определить по уравнению
∆Н0Т = ∆Н0298 + ∆Ср (Т – 298). |
(6) |
Для заданной реакции СО + 2 Н2 = СН3ОН найдем ∆С0р 298 по уравнению (5), значения С0р 298 берем в приложе-
нии (табл. П1).
С0p298 C0p298CH3OH (C0p298CO 2C0p298H2 )
44,13 (29,14 2 28,83) 42,67Дж /(моль К)
42,67 10 3 кДж /(моль К).
Тепловой эффект реакции ∆Н0298 рассчитан в примере 1.
∆Н0298 = -90,47 кДж/моль.
Тогда тепловой эффект реакции при 500 К найдем по уравнению (6), считая, что Ср ≠ f (T).
∆Н0500 = -90,47 – 42,67 À 10-3 (500 – 298) = – 99,00 кДж/моль.
12

Пример 3. Определить изменение энтропии в реакции СО + 2Н2 = СН3ОН(г)
при стандартных условиях (∆Ѕ0298) и при Т = 500 К (∆Ѕ0500).
Решение Изменение энтропии реакции при стандартных условиях
определим по уравнению:
∆S0298 = ∑νi S0i, 298 прод. – ∑νi,S0 i,,298 исх.в-в . |
(7) |
Стандартные значения энтропий веществ (S0298) приведены в приложении (табл. П1).
S0298 S0298CH3OH (S0298CO 2S0298H2 )
239,76 (197,55 2 130,52) 218,83Дж /(моль К).
Изменение энтропии при Т = 500 К рассчитаем по уравне-
нию
Т |
Сp dT |
|
|||
S0T = ∆S0298 + |
|
|
|
, |
(8) |
|
|
|
|||
298 |
|
T |
|
||
считая, что ∆Сp = const, получаем уравнение |
|
||||
∆S0T = ∆S0298 + ∆Cpln |
Т |
|
|||
|
. |
|
(9) |
||
|
|
||||
|
|
298 |
|
|
|
S5000 218,83 42,67 ln 500 240,16Дж /(моль К) 298
Пример 4. Рассчитать изменение энтропий при нагревании при постоянном давлении 8 кг уксусной кислоты в интервале температур от Т1= 223 К до Т2 = 423 К. Справочные данные приведены в приложении (табл. П2).
Решение Выпишем из табл. П2 температуры кипения и плавления ук-
сусной кислоты, определим, входят ли они в заданный интервал температур: Тпл. = 298,8 К; Ткип. = 391,1 К.
13
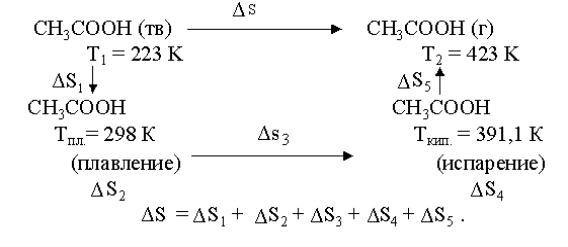
Обе температуры входят в заданный интервал температур. При температуре Т1 = 223 К (меньшей Тпл.) уксусная кислота на-
ходится в твердом состоянии, а при Т2 = 423 К (большей Ткип.) уксусная кислота находится в газообразном состоянии. Весь про-
цесс нагревания уксусной кислоты от Т1 до Т2 можно провести в несколько стадий, рассчитать изменение энтропии на каждой стадии. Изменение энтропии процесса будет равно сумме изменений энтропии отдельных стадий.
Определяем изменение энтропии при нагревании 1 моля уксусной кислоты от Т1 = 223 до Тпл = 289.
СрСН3СООН(тв.) 87,02Дж /(моль К).
|
289,8 Cp( тв) dT |
|
289,8 |
|
289 |
||||
S1 |
|
|
Cp(тв) |
ln |
|
|
87,02 ln |
|
22,01Дж /(моль К). |
T |
|
|
|||||||
|
223 |
|
223 |
|
|
223 |
|||
При Тпл = 298,9 осуществляется фазовый переход – плавление уксусной кислоты. Определяем изменение энтропии 1 моля уксусной кислоты при фазовом переходе.
S2 |
|
Hпл |
|
11700 |
40,37Дж(моль К) . |
Т пл |
|
||||
|
|
289,8 |
|
||
∆Нпл – теплота плавления уксусной кислоты равна 11700 Дж/моль.
14

Определяем изменение энтропии при нагревании 1 моля уксусной кислоты от Тпл=289,9К до Ткип. = 391,1 К.
СрСН3СООН 123,43Дж /(моль К).
|
391,1 Cp(ж ) dT |
|
391,1 |
|
|
391,1 |
|
||
S3 |
|
|
CP(ж) |
ln |
|
|
123,4 ln |
|
36,89Дж /(моль К). |
T |
|
|
|||||||
|
289,8 |
|
289,8 |
|
289,8 |
||||
При Ткип. = 391,1 К осуществляется фазовый переход – испарение уксусной кислоты. Определяем изменение энтропии 1 моля уксусной кислоты при фазовом переходе:
S4 |
|
Hисп. |
|
24370 |
62,31Дж(моль К). |
Т кип. |
|
||||
|
|
391,1 |
|
||
∆Нисп. – теплота испарения уксусной кислоты = 24370 Дж/моль.
Определяем изменение энтропии при нагревании 1 моля уксусной кислоты от Ткип. = 391,1К до Т2 = 423К.
СpCH3COOH(г ) 66,5Дж /(моль К).
|
423 Cp(г) dT |
|
423 |
|
|
423 |
|
||
S5 |
|
|
Cp(г ) |
ln |
|
|
66,5 ln |
|
4,58Дж /(моль К). |
T |
|
|
|||||||
|
391,1 |
|
391,1 |
|
391,1 |
||||
Определяем количество молей (n) кислоты, содержащихся в 8 кг.
М.в. СН3СООН = 60г/моль.
n 8000 133,3моль. 60
Определим общее изменение энтропии:
∆S = (∆S1 + ∆S2 + ∆S3 + ∆S4 + ∆S5) n.
∆S = 133,3 (22,01 + 40,37 + 36,89 + 62,31 + 4,58) = 22149,13 Дж/К.
Пример 5. Рассчитать термодинамические потенциалы ∆G0 и ∆А0 при Т = 500К для реакции
15
СО + 2 Н2 = СН3ОН(г). Определить направление реакции.
Решение
Изменение термодинамических потенциалов ∆G0T и ∆А0Т позволяет определить направление реакции.
При ∆G0T > 0 и ∆А0Т > 0 реакция протекает не самопроизвольно в обратном направлении.
При ∆G0T < 0 и ∆А0Т < 0 реакция протекает самопроизволь-
но в прямом направлении. |
|
|
При ∆G0Т = 0, ∆А0Т = |
0 – химическое равновесие. |
|
∆G0500 = ∆H0500 – T∆S500 . |
(10) |
|
∆H0500 – рассчитано в примере 2. ∆Н0500 = -99,00 кДж/моль.
∆S0500 – рассчитано в примере 3.
∆S0500 = -240,16 Дж/(мольÀК) = -240,16À10-3 кДж/(мольÀК). ∆G0500 = -99,00 + (500 À 240,16 À 10-3) = 21,08 кДж/моль.
∆А0500 = ∆G0500 – ∆nRT . |
(11) |
∆n = -2; R = 8,31À10-3 кДж/(мольÀК); T = 500 K. ∆А0500 = 21,08 + 2À8,31À10-3À500 = 29,39 кДж/моль.
При расчете получилось, что ∆G0500 >0 и ∆А0500 > 0, значит, реакция протекает не самопроизвольно в обратном направлении.
Пример 6. Для реакции СО + 2Н2 = СН3ОН(г), протекающей при постоянном давлении и постоянной температуре, определить константу равновесия Кр при 298К и 500К, а также равновесный выход продукта.
Решение Запишем для нашей реакции уравнение изотермы:
G T RT ln K p RT ln |
РCH3OH |
|
, |
(12) |
||
P |
P 2 H |
2 |
||||
|
|
|
||||
|
CO |
|
|
|
||
16

где Р – парциальные давления компонентов реакции. |
|
|
Если парциальные давления компонентов Р |
равны 1 атм, то |
|
уравнение изотермы принимает вид |
|
|
∆G0T = – RTlnKp . |
|
(13) |
Если парциальные давления компонентов Р равны |
||
1,0133À105н/м2, то |
|
|
∆G0T = -RTlnKp + ∆nRTln 1,0133∙105 |
. |
(14) |
∆G0T = -2,3 RTlgKp + 95832 ∆nT . |
|
(15) |
∆G0T – стандартное изменение изобарно-изотермического потенциала;
∆n – изменение числа молей газообразных веществ реакции.
|
G T0 |
95832 nT |
|
|
lg K p |
|
|
. |
(16) |
|
|
|||
|
|
2,3RT |
|
|
∆G0298 = ∆H0298 – Τ∆S0298 = –90,47 + 298 ∙ 218,83 ∙ 10-3 = = –25,31 кДж/моль = –25,31 ∙ 106 Дж/Кмоль.
∆Η0298 (пример 1), ∆S0298 (пример 3).
∆G0500 (пример 5) = 21,08 кДж/моль = 21,08 ∙ 106 Дж/Кмоль.
lg K p 25,31 106 95832 ( 2) 298 5,543, 2,3 8,31 103 298
lg Kp 298 = – 5,543 = 6,457; Kp298 = 2,86∙10-6.
|
|
21,08 106 |
95832 |
( 2) 500 |
|
lg K p500 |
|
|
|
|
12,234, |
2,3 8,31 103 |
|
||||
|
|
500 |
|||
lg K p500 12,234 13,766; Kp = 5,83∙10-13.
17
Константа равновесия с ростом температуры уменьшается. Определим равновесный выход продукта реакции при Т = 298К и общем давлении в реакционной системе 1,0133∙105 Н/м2. Исходные вещества взяты в эквивалентных количествах, равновесное количество продукта примем равным žХ£ кмолей. Покажем материальный баланс в исходной смеси и в момент равновесия.
Число киломолей |
СО + 2Н2 = СН3ОН |
||
в исходной смеси |
1 |
2 |
0 |
в равновесной смеси |
1-Х |
2-2Х |
Х |
Общее число киломолей в равновесной смеси
∑n = 1 – X + 2 – 2X + X = 3 – 2X.
Равновесные парциальные давления компонентов выразим через общее давление и мольные доли компонентов.
|
|
Рi = Pобщ Ni. |
|
|
|
|
||
РСН3ОН Робщ |
х |
; РСО Робщ |
1 х |
; РН2 |
Робщ |
2 |
2х |
. (17) |
3 2х |
|
3 |
|
|||||
|
|
3 2х |
|
2х |
||||
Выразим константу равновесия через парциальные давле-
ния: |
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
PCH3OH |
|
|
|
Pобщ |
|
|
|
|
|
|
|
х(3 2х)2 |
|
||||
K p298 |
|
|
|
|
|
3 2x |
|
|
|
|
|
; |
||||||||
P P 2 |
|
|
1 х |
2 |
|
2 2х |
|
|
|
(1 х)3 |
||||||||||
|
|
|
|
|
|
2 4Р2 |
|
|||||||||||||
|
|
|
CO |
H2 |
|
Pобщ 3 2х |
Робщ |
(3 2х ) |
|
|
|
общ |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
4К р298 Робщ2 |
|
х(3 2х)2 |
4 2,86 10 6 (1,0133 105 )2 |
11,74 104 . |
||||||||||||||||
|
||||||||||||||||||||
|
|
|
(1 х)3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Такое уравнение можно решить методом подбора значений žх£, возможные значения которого лежат в пределах 0 < x < 1.
Х = 0,96 кмоль СН3ОН.
Пример 7. Дан гальванический элемент, состоящий из двух полуэлементов:
Pt / Co3+, Co2+; |
Pt /Fe3+ , Fe2+ . |
18

Активности всех ионов в растворе:
аСо3+ = 0,012; |
аFe3+ = 0,005; |
aCo2+ = 0,010; |
aFe2+ = 0,060. |
Определить:
1)ЭДС этого элемента;
2)максимальную работу;
3)константу равновесия реакции, протекающей в гальваническом элементе.
Решение
По стандартным электродным потенциалам полуэлементов составляем гальванический элемент. Значения стандартных электродных потенциалов приведены в приложении (табл. П3).
0 |
3+ |
2+ |
= 1,82 В . |
0 |
3+ |
2+ |
= 0,771 В. |
φ Со /Со |
φ Fe /Fe |
||||||
Электрод, имеющий меньший потенциал, принимаем за отрицательный электрод. Гальванический элемент запишем:
(–) Pt / Fe3+, Fe2+ // Co3+, Co2+ / Pt (+).
На отрицательном электроде протекает реакция окисления:
Fe2+ – e-  Fe 3+.
Fe 3+.
На положительном электроде – реакция восстановления:
Co3+ + e- |
Co2+. |
Суммарная реакция, протекающая в гальваническом элементе:
Fe2+ + Co3+ |
Fe 3+ + Co2+. |
Найдем ЭДС гальванического элемента по уравнению
19
