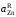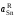- •II. Термодинамика растворов
- •8. Реальные растворы произвольной концентрации. Термодинамическая активность компонента
- •8.1. Определение активностей компонентов бинарного раствора по давлению паров над раствором
- •8.2. Определение активности растворителя по понижению температуры кристаллизации раствора
- •8.3. Определение активности компонента раствора по данным о химическом равновесии
- •8.4. Вычисление активности компонента бинарного раствора по известной активности другого компонента
- •8.5. Задачи для самостоятельного решения
8.4. Вычисление активности компонента бинарного раствора по известной активности другого компонента
Химические потенциалы компонентов бинарного раствора связаны между собой уравнением Гиббса – Дюгема
х1d1+х2d2= 0, (II.37)
которое позволяет вычислить активность (коэффициент активности) компонента раствора, если известна активность (коэффициент активности) другого. Рассмотренные в дальнейшем примеры связаны с использованием уравнения Гиббса-Дюгема для самого простого случая неограниченной растворимости компонентов, когда в качестве стандартного состояния можно выбрать чистые компоненты. В этом случае для обоих компонентов химические потенциалы определяются формулой
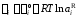 .
.
Индекс Rдалее будет опущен. С учетом этого соотношения уравнение Гиббса–Дюгема примет вид
х1dlnа1 + х2dlnа2 = 0. (II.38)
В таком виде уравнение Гиббса – Дюгема неудобно для расчетов, так как не позволяет использовать информацию о чистом растворителе: при х20lnа2–. Если же в уравнение (II.38) подставитьаi =i xiи при преобразованиях учесть, что для бинарного растворах1+х2= 1 их1dlnx1+ +х2dlnx2= 0, получим уравнение
х1dln1 + х2dln2 = 0, (II.39)
позволяющее рассчитать коэффициенты активности одного компонента при известных коэффициентах активности другого компонента.
Для вычисления коэффициента активности растворителя имеем
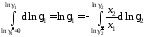 , (II.40)
, (II.40)
а для коэффициента активности растворенного вещества
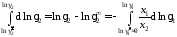 . (II.41)
. (II.41)
Как видно, для расчетов необходимо знать коэффициент активности растворенного вещества в бесконечно разбавленном растворе
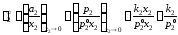 ,
,
здесь k2– постоянная закона Генри для разбавленных идеальных растворов, см. рис. 2.6.
Если известна аналитическая зависимость коэффициента активности одного из компонентов от его концентрации, для расчетов используются формулы:
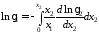 , (II.42)
, (II.42)
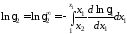 . (II.43)
. (II.43)
Пример 2.57.Для расплаваPb–Biзависимость коэффициента активности свинца от его молярной доли определяется уравнением
lgPb= –0,32(1 –хPb)2, 0хPb1.
Найти зависимость BiотхBi.
Решение. Искомая зависимость определяется уравнениями (II.40) и (II.42)
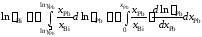 .
.
Используя зависимость
lnPb= –2,3030,32(1 –хPb)2,
определяем производную
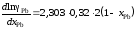 .
.
Подставляя ее значение в подинтегральное выражение, получаем следующую зависимость BiотхBi:
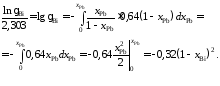
Пример 2.58.Зависимость коэффициента активности алюминия от состава расплаваFe–Alпри 1873Kописывается уравнением
lgAl= –1,51 + 2,60хAl , 0хAl0,25.
Определить зависимость коэффициента активности железа от концентрации его в расплаве.
Решение. После преобразований, аналогичных проделанным в предыдущем примере, уравнение (II.21) для железоалюминиевого расплава примет вид
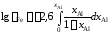 .
.
Вычисление интеграла упрощается, если подинтегральную функцию представить следующим образом
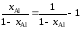 .
.
Тогда получим
 ;
;
lgFe = 5,99lgxFe + 2,6(1 – xFe), 0,75 xFe 1.
Пример 2.59.Зависимость активности монооксида железа в оксидном расплавеFeO–Fe2O3от ионной доли двухвалентного железаFe2+определяется уравнением
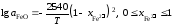 .
.
Определить зависимость активности Fe2O3от ионной долиFe3+.
Решение.Если стандартными являются состояния чистых жидких оксидовFeOиFe2O3, то по уравнению Гиббса-Дюгема
 .
.
Выразим молярные доли оксидов через ионные доли катионов железа. По определению ионной долей называется отношение числа молей иона к общему числу молей ионов того же знака, то есть
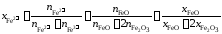 ,
,
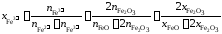 .
.
Последние преобразования
в этих соотношениях связаны с делением
числителя и знаменателя на сумму
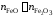 .
Если учесть, что
.
Если учесть, что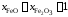 и
и ,
получим
,
получим
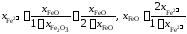 ;
;
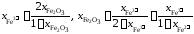 .
.
Таким образом,
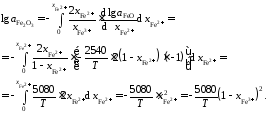
Пример 2.60.Определенные опытным путем давления насыщенных паров цинка над бинарными расплавамиSn–Znпри температуре 973 Kприведены в таблице 2.13. Рассчитать активности цинка и олова.
Решение. Расчеты выполним для стандартных состояний "чистый жидкий компонент". Приведенные в табл. 2.13 величины активностей и коэффициентов активности цинка вычислялись по уравнениям
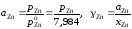 .
.
Таблица 2.13
Результаты опытов и расчетов активностей компонентов
бинарных расплавов Sn–Zn
|
хZn |
0 |
0,05 |
0,10 |
0,15 |
0,20 |
0,30 |
0,40 |
0,50 |
1 |
|
рZn, кПа |
0 |
0,551 |
1,086 |
1,605 |
2,124 |
3,114 |
3,992 |
4,744 |
7,984 |
|
|
0 |
0,069 |
0,136 |
0,201 |
0,266 |
0,390 |
0,500 |
0,594 |
1 |
|
Zn |
1,39* |
1,38 |
1,36 |
1,34 |
1,33 |
1,30 |
1,25 |
1,188 |
1 |
|
хZn/хSn |
0 |
0,053 |
0,111 |
0,176 |
0,250 |
0,429 |
0,667 |
1,000 |
|
|
lnZn |
0,329* |
0,322 |
0,307 |
0,293 |
0,285 |
0,262 |
0,223 |
0,174 |
0 |
|
lnSn |
0 |
1,85510–5 |
1,24910–3 |
3,25810–3 |
4,96210–3 |
0,0128 |
0,0342 |
0,0750 |
— |
|
Sn |
1 |
~1 |
1,001 |
1,003 |
1,005 |
1,013 |
1,035 |
1,078 |
— |
|
|
1 |
0,950 |
0,901 |
0,853 |
0,804 |
0,709 |
0,621 |
0,539 |
0 |
*
– величины
 иln
иln определены экстраполяцией.
определены экстраполяцией.
Для вычисления коэффициентов активности олова воспользуемся уравнением Гиббса – Дюгема
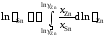 .
.
В
отсутствии аналитических зависимостей
(см. примеры 2.57 – 2.59) воспользуемся
графическим вычислением интеграла по
площади фигуры под кривой «зависимости»
хZn/хSn
от lnZn.
Величину нижнего предела интегрирования
определяем либо экстраполяцией графика
зависимости Zn
= f(хZn)
до значения хZn
= 0 (см. рис. 2.9), либо графика зависимости
хZn/хSn
от lnZn
до значения
хZn/хSn
= 0 (см. рис. 2.10). С учетом найденной величины
 =
1,39 (ln
=
1,39 (ln =
0,329) расчетное уравнение примет вид
=
0,329) расчетное уравнение примет вид
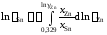 .
.
Рис. 2.9. Определение
коэффициента активности цинка
в
бесконечно разбавленном растворе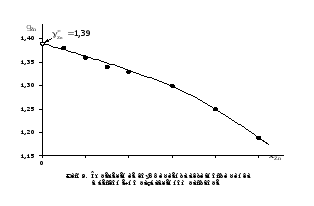
Рис. 2.10. Определение
коэффициентов активности олова
методом
графического интегрирования
График, иллюстрирующий процедуру вычислений, представлен на рис. 2.10. Возможны два варианта расчета. В одном расчет проводится для любых заданных концентраций раствора по точкам кривой. Если же экспериментальные точки незначительно отклоняются от кривой, возможен расчет по этим точкам, то есть с использованием данных таблицы. Покажем это на примерах расчета для первых трех растворов (см. точки 1, 2 и 3 на рис. 2.10). Имеем
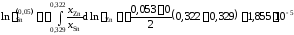 ;
;
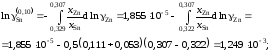
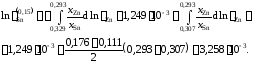
Для коэффициентов активности и активностей имеем
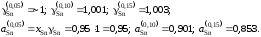
Результаты расчетов сведены в табл. 2.13 и из них следует, что расплав Sn –Znхарактеризуется положительными отклонениями от закона Рауля.