
- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 1
- •Содержание
- •Часть 1
- •Часть 2
- •Предисловие
- •Введение
- •1 Углеводороды
- •1.2 Алкены (этиленовые углеводороды или олефины)
- •1.3 Диеновые углеводороды (алкадиены)
- •1.4 Алкины (ацетиленовые углеводороды)
- •1.5 Алициклические углеводороды
- •1.6 Ароматические углеводороды
- •2 Гидроксисоединения
- •2.1 Спирты
- •2.1.1 Одноатомные спирты
- •2.1.1.1 Насыщенные одноатомные спирты
- •2.1.1.2 Ненасыщенные одноатомные спирты
- •2.1.2 Многоатомные спирты
- •2.1.2.1 Гликоли
- •2.1.2.2 Глицерин
- •2.2 Фенолы и ароматические спирты
- •2.2.1 Фенолы
- •2.2.2 Ароматические спирты
- •3 Простые эфиры
- •3.1 Алифатические простые эфиры
- •3.2 Циклические простые эфиры или органические окиси (эпоксисоединения)
- •4 Карбонильные соединения (альдегиды и кетоны, оксосоединения )
- •4.1 Насыщенные карбонильные соединения
- •4.2 Ненасыщенные карбонильные соединения
- •4.3 Ароматические карбонильные соединения
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 1
1.5 Алициклические углеводороды
Алициклическими называются соединения, включающие в свой состав цикл из углеродных атомов, за исключением большого класса ароматических соединений. Приставка «али» дана за сходство химических свойств этих веществ с алифатическими соединениями. Это сходство проявляется, прежде всего, в химическом поведении алициклических соединений.
Простейшими углеводородами алициклического ряда являются циклоалканы, т.е. насыщенные циклические углеводороды. Они имеют также и другие названия: полиметиленовые углеводороды или нафтены.
Помимо циклоалканов существуют и ненасыщенные циклические углеводороды: циклоолефины, циклодиолефины, циклоацетилены и т.д.. При замещении водородных атомов на различные функциональные группы образуются алициклические галогенпроизводные, спирты, кислоты, карбонильные соединения и другие.
Изомерия и номенклатура
Изомерия алициклоалканов весьма своеобразна. Она определяется размером циклов, числом, взаимным расположением, видом и строением заместителей.
Изомеры С6Н12 с различным размером циклов:

Изомеры С10Н20 с различными заместителями:

Для алициклических соединений чрезвычайно важное значение имеют геометрическая, оптическая и конформационная изомерия.
Геометрическая изомерия имеет место при наличии в кольце не меньше двух заместителей. Геометрическая, или цис-транс-изомерия обусловлена различным расположением заместителей по отношению к плоскости кольца (по одну или по разные стороны).

Названия моноциклических соединений строятся так же как и названия соответствующих алифатических с добавлением приставки цикло-. За основу соединения принимается цикл. Если направления отсчёта неэквивалентны, то выбирают вариант, в котором заместители имеют меньшие номера.



Алициклические соединения с несколькими циклами могут быть отнесены к разным группам:
– с изолированными циклами

– с циклами, соединенными одной простой связью

– с циклами, имеющими один общий атом углерода (спирановые)

– с циклами, имеющими два общих атома углерода

– с числом общих атомов больше двух (так называемые мостиковые)

В названиях соединений последних двух групп учитываются все атомы углерода, входящие в циклы. В скобках указывается число атомов углерода, находящихся между общими углеродами, узловыми (т.е. в мостиках). Нумерация идёт от одного из общих узловых углеродов вдоль наиболее длинного мостика, переходя затем на более короткий.
Способы получения
Крупнейшим источником алициклических соединений является нефть. Однако в нефти присутствуют почти исключительно пяти- и шестичленные циклы. Остальные циклы термодинамически мало- устойчивы. Алициклические соединения могут быть получены из соединений с открытой цепью замыканием её в цикл, из ароматических соединений, чаще всего их гидрированием, а также из других алициклических соединений с иными функциональными группами обычными известными методами.
Вот несколько общих методов синтеза алициклических соединений.
– Из дигалогенпроизводных (Г. Густавсон)

Особенно легко этим методом получаются циклопропансодер-жащие соединения.
– Для получения соединений с пяти, шести или более членами в цикле используют декарбоксилирование солей двухосновных кислот.

Существует и целый ряд специфических синтезов, в которых получаются циклы только одного размера или определённые соединения (например, реакция диенового синтеза приводит к образованию шестичленного цикла).
Физические свойства
Циклоалканы обычно имеют свойства, близкие к свойствам алканов. Циклические соединения, как правило, имеют более высокие температуры кипения и плавления, а также плотности по сравнению с соответствующими алифатическими. Из изомеров выше кипит соединение с большим циклом (табл. 3).
Таблица 3 – Температуры кипения соответствующих алифатических и алициклических углеводородов
|
Алифатический углеводород |
Температура кипения,°С |
Алициклический углеводород |
Температура кипения,°С |
|
Пропан |
– 42,2 |
Циклопропан |
– 33,0 |
|
Бутан |
– 0,5 |
Циклобутан |
13,0 |
|
Пентан |
36,2 |
Циклопентан |
49,3 |
|
– |
– |
Метилциклобутан |
36,8 |
|
Гексан |
68,7 |
Циклогексан |
80,7 |
|
– |
– |
Метилциклогексан |
71,9 |
Циклоалканы не растворимы в воде и хорошо растворимы в органических растворителях.
Химические свойства
Циклоалканы с большими циклами по своим химическим свойствам похожи на алканы. Они сравнительно инертны и вступают в реакции замещения. Однако при замыкании углеродных цепочек алифатических соединений в цикл происходит сближение атомов с усилением их внутримолекулярных взаимодействий, а в некоторых случаях и искажения валентных углов. Цикл при этом оказывается напряженным, что вносит определённое своеобразие в химическое поведение этих соединений. Циклоалканы сильно различаются между собой по устойчивости циклических систем различного размера. В качестве интегральной эффективной характеристики энергетического состояния циклических соединений в сравнении их с алифатическими аналогами используется величина энергии напряжения, EH. Она находится как разность экспериментальной энтальпии образования циклического соединения и энтальпии образования гипотетического ненапряжённого соединения с той же структурой, найденной расчётными методами. Для ряда циклоалканов значения энергий напряжения циклов приведены ниже (табл. 4).
Таблица 4 – Энергии напряжения некоторых незамещенных циклоалканов
|
Число атомов углерода в цикле |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
EH, кДж·моль-1 |
115,5 |
111,3 |
25,1 |
0,8 |
26,8 |
41,4 |
53,5 |
52,7 |
Из приведённых данных по энергиям напряжения циклических систем видно, что наиболее напряженными и, следовательно, наименее устойчивыми являются трёх- и четырёхчленные циклы. Во многих реакциях циклы этих соединений раскрываются, и по свободным валентностям происходит присоединение реагента. Наиболее устойчив шестичленный цикл (EH = 0,8 кДж·моль-1). Его энергия напряжения так же, как энергия циклов С14 – С15 и больше, невелика и близка к энергетическому уровню нециклических алканов с нормальной цепью. Циклические системы этих соединений в реакциях, как правило, сохраняются, при этом протекают реакции замещения.
Рассмотрим причины различия в стабильности циклов разного размера. В 1885 году немецкий химик А.Байер предложил так называемую теорию «углового напряжения». Согласно этой теории прочность циклов связана со степенью отклонения направлений валентностей углеродного атома при образовании плоских циклов от нормального положения (нормальному расположению направлений связей соответствует тетраэдрический угол между ними в 109°28').

Отсюда следует, что для замыкания цикла из трёх атомов углерода направления каждой валентности должны отклоняться на

При образовании плоского циклобутанового кольца угол отклонения каждой валентности составит 9°44'. Замыкание пятичленного цикла почти не требует отклонения (угол отклонения 0°44').

Для шести- и восьмичленных циклов угол отклонения составит 5°36' и 12°51' соответственно.
Угол отклонения, по Байеру, является мерой «напряжения», или мерой неустойчивости цикла. Теория Байера хорошо объясняет малую устойчивость 3-х и 4-х-членных циклов. Однако согласно теории углового напряжения шестичленный цикл должен быть менее устойчив, чем пятичленный, высшие циклы неустойчивы так же как и трёхчленный. Это противоречит приводимым ранее термодинамическим данным по энергиям напряжения циклов.
Сакс и Мор показали, что шестичленные и высшие циклы могут существовать без напряжения, т.к. атомы углерода кольца не лежат в одной плоскости, как это подразумевалось по теории Байера. При сохранении валентных углов, близких к тетраэдрическим (109 °C…110 °C) шестичленные циклы могут иметь две пространствен-ные конфигурации – конформации «кресла» и «ванны».

Из всех возможных пространственных конфигураций атомов циклогексана лишь эти две являются наиболее устойчивыми. В то же время, конформации «кресла» и «ванны» энергетически неравноценны. Термодинамические исследования указывают, что конформация «кресло» примерно на 28,9 кДж∙моль-1 энергетически более выгодна, чем конформация «ванна». Это означает, что при комнатной температуре лишь одна из тысячи молекул циклогексана будет находиться в форме «ванны» Таким образом, при обычных условиях циклогексан практически полностью представлен одной конформацией «кресла». Эта конформация имеет ту интересную особенность, что внециклические связи С–Н в ней ориентированы по отношению к псевдоплоскости цикла двояким образом: шесть связей С–Н перпендикулярны к ней и, следовательно, параллельны друг другу, а шесть других таких же связей почти лежат в псевдоплоскости (точнее образуют с ней одинаковые острые углы – 19°28'). Первые шесть связей называются аксиальными (обозначаются буквой а), а вторые – экваториальными (е). (Под псевдоплоскостью понимают плоскость, проходящую через средины всех связей С–С молекулы циклогексана).
Полное внутреннее вращение вокруг одинарных связей на 360° в цикле без его разрыва невозможно. Однако частичное одновременное кручение узлов относительно друг друга с преодолением некоторого потенциального барьера может происходить. В результате этого при обычных условиях возможна так называемая инверсия цикла, когда аксиальные связи становятся экваториальными и наоборот.
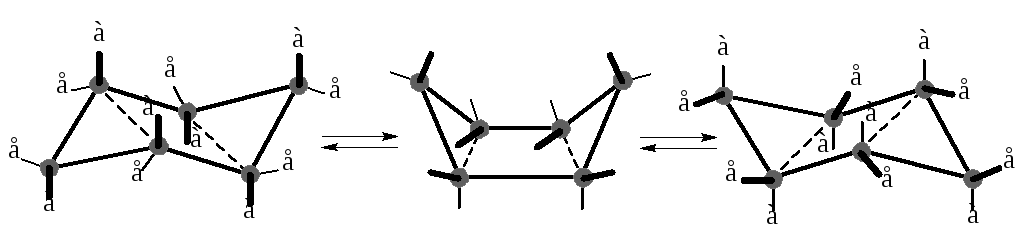
Обе равновесные ядерные конфигурации циклогексана, получающиеся в результате инверсии креслообразной формы через промежуточное образование формы «ванна», ничем не отличаются друг от друга, т.е. можно говорить об одной конформации «кресла».
Однако, если происходит инверсия монозамещённого циклогексана, то возникают две конформации с аксиальным и экваториальным расположением заместителя. Эти конформации, как и поворотные изомеры соединений с открытой цепью, отличаются по своим свойствам и устойчивости. Так, экваториальная конформация хлорциклогексана энергетически на 1,67 кДж∙моль-1 выгоднее аксиальной.

При наличии двух заместителей у разных атомов углерода цикла возникает геометрическая изомерия. Заместители могут быть расположены по одну сторону от псевдоплоскости – цис-изомер – и по разные – транс-изомер. В обоих случаях возможна инверсия конформации «кресло», которая может приводить к конформационной изомерии.

Энергетически более выгодным является транс-расположение заместителей, т.к. взаимное отталкивание атомов заместителей в этом случае наименьшее.
Согласно Байеру, плоское пятичленное кольцо менее напряжено, чем плоское шестичленное. В действительности менее напряжённым является шестичленный цикл (смотри термодинамические данные). Причиной этому является взаимное отталкивание водородных атомов соседних углеродов циклопентана, которое называется торсионным, или «питцеровским» напряжением. Этот вид взаимодействия непосредственно несвязанных атомов через пространство проявляется, когда расстояние между их центрами в молекуле приближается к сумме ван-дер-ваальсовских радиусов этих атомов. В плоской молекуле циклопентана пять пар водородных атомов будут иметь заслонённую конформацию этана. В результате «питцеровское» напряжение составит 68 кДж∙моль-1. Чтобы уменьшить такое напряжение, циклопентан принимает неплоскую конформацию «конверт». При этом возросшее угловое напряжение (18,0 кДж∙моль-1) оказывается с избытком компенсированным значительным уменьшением напряжения заслонения (32,6 кДж∙моль-1). Общее напряжение снижается, таким образом, на 14,6 кДж∙моль-1, и атомы водорода выходят из заслонённого состояния.

Циклобутановое кольцо аналогично циклопентановому также неплоско.

Напряжение в больших циклах даже меньше, чем в циклогексане. Уменьшению его способствуют большие пространственные размеры колец, что влечёт за собой уменьшение торсионного напряжения и неплоскостность кольца, что снижает угловые напряжения.
Химические свойства
– Галогенирование
Трёхчленный цикл при действии галогенов раскрывается, протекает реакция присоединения:

Циклопентан, циклогексан и их алкильные производные вступают в реакции замещения с сохранением циклов.

Соединения с четырёхчленным циклом реагируют по обоим направлениям.
– Действие галогеноводородов
Циклопропановые углеводороды вступают в реакцию присоединения с раскрытием кольца:

Циклы С4 и выше с галогеноводородами не реагируют.
– Окисление
При действии сильных окислителей в жёстких условиях все циклоалканы дают двухосновные кислоты с тем же числом углеродных атомов. Цикл при этом разрывается:

– Гидрирование
Циклоалканы С3, С4, С5 при повышенной температуре и давлении в присутствии катализаторов (Pt, Pd, Ni) подвергаются гидрированию с раскрытием цикла. Циклопропан гидрируется легко, циклопентан – в жёстких условиях, при высоких температурах.
Соединения с циклогексановым кольцом при нагревании с катализаторами гидрирования отщепляют водород с образованием в конечном итоге ароматических соединений. Эта реакция ароматизации имеет чрезвычайно большое значение. Посредством этой реакции из отдельных фракций нефти можно получить индивидуальные ароматические углеводороды (бензол, толуол, ксилолы и т.д.), а также обогащать низкосортные бензины ароматическими углеводородами, имеющими высокие октановые числа, и, следовательно, повышать качество топлива. Промышленный процесс ароматизации нефтяных фракций называется риформингом или, если в качестве катализатора используется платина – платформингом. Для риформинга наиболее характерны следующие реакции:
а) дегидроциклизация преимущественно в углеводороды циклогексанового ряда:

б) изомеризация циклов:

в) дегидрирование с образованием в конечном итоге ароматических углеводородов:

Такая направленность процесса в сторону образования ароматических соединений объясняется большой энергетической устойчивостью их за счёт сопряжения. В исследовании химии алициклических соединений, в том числе и реакции ароматизации циклоалканов, огромное значение имеют труды русских и советских учёных: В.В. Марковникова, Н.Д. Зелинского, Б.А. Казанского, А.Ф. Платэ, С.С. Намёткина и других.
За исключением некоторых специфических реакций производные алициклических углеводородов – галогенпроизводные, спирты, амины, карбонильные и карбоксильные соединения и т.д. – имеют те же химические свойства, что и аналогичные производные алифатических углеводородов.
