
- •Методические рекомендации для студентов к лабораторному практикуму
- •Тема: Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа. Метод нейтрализации
- •1.Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
- •Экспериментальная часть
- •Экспериментальные данные и результаты измерений
- •Экспериментальные данные и результаты измерений
- •Тема: Тепловые эффекты химических реакций. Термодинамические характеристики химических и биохимических процессов
- •Практическая часть
- •Экспериментальная часть Лабораторная работа. Определение стандартной теплоты (энтальпии) реакции нейтрализации
- •Экспериментальные данные и результаты измерений
- •Тема: Кинетика химических и биохимических реакций. Химическое равновесие
- •1. Основные понятия химической кинетики:
- •Практическая часть
- •Экспериментальная часть
- •Зависимость скорости разложения от ее концентрации //
- •Тема: Коллигативные свойства растворов неэлектролитов и электролитов
- •1. Вода как универсальный биологический растворитель.
- •2. Коллигативные свойства растворов (определение, виды).
- •2. Экспериментальная часть
- •Криоскопическим методом
- •Экспериментальные данные и результаты измерений
- •Тема: Протолитические равновесия и процессы. Водородный показатель. Гидролиз
- •1. Электролиты сильные и слабые.
- •3.Гидролиз (определение, причина и следствие, смещение равновесия гидролиза).
- •Экспериментальная часть
- •Реакция среды при гидролизе солей
- •Тема: Буферные системы, классификация и механизм действия
- •2. Экспериментальная часть
- •Ацетатного буферного раствора по кислоте и щелочи
- •Экспериментальные данные и результаты измерений
- •Тема: Физикохимия дисперсных систем. Растворы вмс
- •Практическая часть
- •Экспериментальная часть
Методические рекомендации для студентов к лабораторному практикуму
(в количестве 7 тем)
Дисциплина – химия
Специальность /Направление подготовки – стоматология 060201
Разработчик ____________ Сергеева С.А.
(подпись)
Тема: Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа. Метод нейтрализации
Цель темы: Определение количество растворенного вещества, используя различные способы выражения концентрации. Знакомство с общими приемами титриметрии, приготовлением и стандартизацией титранта, применением кислотно-основных индикаторов, получение навыков измерения объемов с заданной точностью, отбора аликвот, осуществления процесса титрования.
Исходный уровень. При изучении данного материала студенты опираются на знания химии довузовского этапа: «Растворы, растворимость веществ, тепловые эффекты при растворении. Влияние различных факторов на растворимость. Способы выражения концентрации веществ в растворе. Теория электролитической диссоциации Аррениуса (ТЭД). Химические реакции и закономерности их протекания».
Основные учебно-целевые вопросы:
1.Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
2.Растворы (определение, классификация).
2.1.Механизм процессов растворения. Термодинамический подход к процессу растворения.
Растворимость газов в жидкостях. Закон Генри-Дальтона. Растворимость газов в крови. Кессонная болезнь.
Способы выражения концентрации растворов (массовая, мольная и объемная доли растворенного вещества, молярная концентрация, молярная концентрация эквивалента, титр раствора).
Взаимосвязь разных способов выражения концентрации растворов.
3.Титриметрический метод анализа (понятие и виды).
3.1.Расчеты в титриметрии. Закон эквивалентов.
3.2.Оборудование титриметрического анализа: мерные и вспомогательные менее точные посуды. Техника работы в объемном анализе (наблюдение за правильностью установки мениска при работе с пипеткой, мерной колбой и бюреткой, правила наливание раствора пипеткой, проверка емкости мерной посуды).
4. Метод кислотно-основного титрования (определение, основное уравнение).
4.1. Ацидиметрия и алкалиметрия: исходные вещества и рабочие тированные растворы; кривые титрования, скачок титрования, точка эквивалентности; индикаторы и интервалы их перехода: метилоранж, фенолфталеин, принцип выбора индикаторов для титрования.
4.2. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами.
Практическая часть
Ситуационные задачи
Расчет по массовой доле веществ в растворе
Задача
№1.В медицине издавна борную кислоту
/![]() /
(сассолин) применяют в виде 2-3% растворов
для полоскания горла, в мазях и присыпках,
т.к. она обладает антисептическими
свойствами. Но, в настоящее время в связи
с выявленными побочными явлениями
внесены ограничения к ее применению.
Сколько граммов
/
(сассолин) применяют в виде 2-3% растворов
для полоскания горла, в мазях и присыпках,
т.к. она обладает антисептическими
свойствами. Но, в настоящее время в связи
с выявленными побочными явлениями
внесены ограничения к ее применению.
Сколько граммов![]() и воды нужно для приготовления 250 г
раствора с массовой долей борной кислоты
3%?
и воды нужно для приготовления 250 г
раствора с массовой долей борной кислоты
3%?
Ответ.
![]() г.,
г.,![]() 242,5
г.
242,5
г.
Расчеты при разбавлении и смешивании растворов с различной массовой долей растворенного вещества
Задача
№2. Натрия
нитрит /![]() /
в весьма редких случаях применяют внутрь
при отравлении цианидами. В этом случае
его вводят внутривенно в виде 1-2 %
раствора. Какую массу воды следует
добавить к 50 г раствора
/
в весьма редких случаях применяют внутрь
при отравлении цианидами. В этом случае
его вводят внутривенно в виде 1-2 %
раствора. Какую массу воды следует
добавить к 50 г раствора![]() с
массовой долей 11%, чтобы получить раствор
с массовой долей 1% (0,01)?
с
массовой долей 11%, чтобы получить раствор
с массовой долей 1% (0,01)?
Ответ.
![]() =500
г.
=500
г.
Расчет по молярной концентрации раствора
Задача
№3. В медицине
калия хлорид /![]() /
применяется при нарушении сердечного
ритма, особенно в связи с интоксикацией
сердечными гликозидами, когда происходит
обеднение клеток миокарда ионами K+.
Сколько граммов
/
применяется при нарушении сердечного
ритма, особенно в связи с интоксикацией
сердечными гликозидами, когда происходит
обеднение клеток миокарда ионами K+.
Сколько граммов
![]() необходимо для приготовления 1 л раствора
с
необходимо для приготовления 1 л раствора
с![]() моль/л?
Опишите процесс приготовления этого
раствора (см. рисунок 1).
моль/л?
Опишите процесс приготовления этого
раствора (см. рисунок 1).
Ответ.
![]() 149,12
г.
149,12
г.

Расчет по молярной концентрации эквивалента
Задача
№4. Перманганат
калия /![]() /
применяют в медицинской практике как
антисептическое средство наружно в
водных растворах для промывания ран,
полоскания полости рта и горла, а также
для смазываний язвенных и ожоговых
поверхностей. Рассчитайте сколько
граммов
/
применяют в медицинской практике как
антисептическое средство наружно в
водных растворах для промывания ран,
полоскания полости рта и горла, а также
для смазываний язвенных и ожоговых
поверхностей. Рассчитайте сколько
граммов![]() необходимо
взять для приготовления 2 л раствора с
С(
необходимо
взять для приготовления 2 л раствора с
С(![]() )=
0,5 моль/л, если анализ будет проводиться
в кислой среде?
)=
0,5 моль/л, если анализ будет проводиться
в кислой среде?
Ответ.
![]() 6,53
г.
6,53
г.
Связь между разными способами выражения концентрации
Задача
№5. Вычислите
молярную, эквивалентную молярную и
моляльность раствора серной кислоты с
![]() и
и![]()
![]() .
.
Ответ.
![]()
![]() моль/л;
моль/л;![]() 2,18
2,18![]() ;
;![]() моль/кг.
моль/кг.
Расчет для приготовления растворов лекарственных препаратов при введении больному
Задача №6. Больному при угнетении дыхания и кровообращения различного происхождения необходимо ввести 100 мг лекарственное средство 4-этил-4-метил-2,6-пиперидиндион (бемегрида). Сколько мл этого раствора с массовой долей 0,5% необходимо ввести больному?
Ответ. Больному надо ввести 20 мл бемегрида.
Вычисления по результатам прямого титрования
Задача
№7. В медицине
кислоту хлористоводородную разведенную
применяют внутрь в каплях или в виде
микстуры (чаще вместе с пепсином) при
недостаточной кислотности желудочного
сока и ее обычно назначают совместно с
препаратами железа, так как она
способствует улучшению их всасывания.
Какова молярная концентрация эквивалента
и титр хлороводородной кислоты, если
на нейтрализацию 20 мл ее раствора по
реакции
![]() израсходовано 30 мл раствора гидроксида
натрия С
израсходовано 30 мл раствора гидроксида
натрия С![]() моль/л
моль/л
Ответ.
![]() 0,15 моль/л;
0,15 моль/л;![]() г/мл.
г/мл.
Контрольные вопросы и задачи
Что такое раствор? Какие свойства воды делают ее универсальным растворителем?
Какими энергетическими эффектами сопровождается процесс растворения веществ?
Что называется парциальным давлением газа? Дайте формулировку закона парциальных давлений Дальтона.
Объясните характер изменения растворимости газов в жидкостях при изменении парциального давления газов и температуры системы. Приведите примеры. Что такое кессонная болезнь (для ответа см. приложение 2 и 3).
Дайте определение, укажите размерность и обозначение каждого из следующих типов концентраций: молярная концентрация, эквивалентная молярная концентрация (нормальность), моляльность (мольно-массовая концентрация).
В чем заключается сущность процесса титрования? Что такое точка эквивалентности?
Для чего при титровании применяются индикаторы? Какие индикаторы вы знаете?
Рассчитайте молярную массу эквивалента для серной кислоты, фосфорной кислоты, гидроксида калия, сульфата алюминия, карбоната натрия, хлорида меди (II), сульфата меди (II).
Какой массы медный купорос
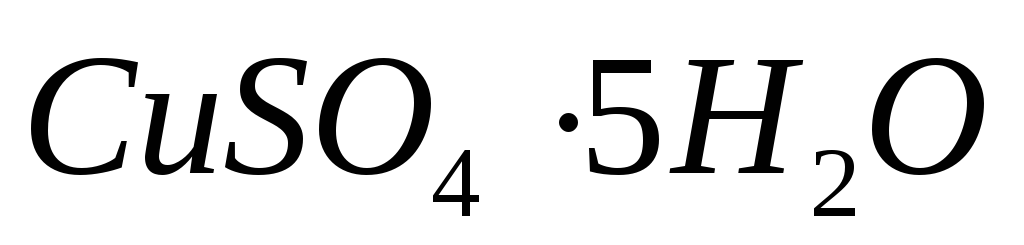 надо
добавить к раствору объемом 0,5 л, в
котором массовая доля
надо
добавить к раствору объемом 0,5 л, в
котором массовая доля
 4%
(ρ=1,040 г/мл), для того, чтобы увеличить
ее до 16%?
4%
(ρ=1,040 г/мл), для того, чтобы увеличить
ее до 16%?Какая масса кристаллогидрата

 потребуется для приготовления раствора
массой 1750 г, если его моляльность должна
быть равна 0,2 моль/кг?
потребуется для приготовления раствора
массой 1750 г, если его моляльность должна
быть равна 0,2 моль/кг?Определить молярную концентрацию эквивалента и титр раствора пероксида водорода, если на титрование 5,0 мл этого раствора израсходовалась 6.5 мл 0,0208 М раствора КMnO4.
