
- •Содержание
- •Общие методические указания
- •Модуль 1. Особенности силикатных материалов и процессов их синтеза
- •Задание 1. Термодинамика реакций в силикатных системах
- •Лабораторная работа № 1
- •Изучение химического равновесия в гетерогенной системе
- •(Расчет термодинамических характеристик реакции
- •Разложения карбоната кальция)
- •Лабораторная работа № 2 Кинетика гетерогенной химической реакции (расчет кинетических характеристик реакции разложения карбоната кальция)
- •Модуль 2. Фазовые равновесия в силикатных системах и диаграммы состояния
- •Задание 2. Диаграммы состояния двухкомпонентных систем Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Задание 3. Диаграммы состояния трехкомпонентных систем
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 11
- •Расчет термодинамических характеристик кристаллизующихся веществ по данным термического анализа
- •Список литературы
Лабораторная работа № 2 Кинетика гетерогенной химической реакции (расчет кинетических характеристик реакции разложения карбоната кальция)
Цель работы: исследовать влияние различных факторов (температуры, размера зерна) на скорость разложения карбоната кальция. Получить экспериментальные данные для оценки кинетических характеристик реакции.
Приборы и реактивы
Печь трубчатая.
Реометр.
Керамические лодочки.
Карбонат кальция.
Методика выполнения работы и ее обоснование
Процесс разложения карбоната кальция
CaCO3(т) = CaO(т) + CO2(г)
является гетерогенным, и протекает в несколько последовательных этапов:
1. Кристаллохимическое превращение CaCO3 в CaO;
2. Десорбция СО2 с реакционной поверхности;
3. Диффузия CO2 в ядро газового потока.
По механизму протекания этих элементарных стадий их можно объединить в две группы: диффузионную и адсорбционно-химическую или кинетическую.
Реакции типа А(т) = В(т) + С(г), у которых химическое взаимодействие не осложнено диффузионными процессами, называются топохимическими. Для топохимических реакций характерно нарастание скорости реакции в начальный момент процесса и достижение ею предельного значения с последующим спадом до нуля. Одним из основных признаков топохимических реакций служит S-образный вид кинетической кривой.
Реакция начинается не на всей поверхности исходного твердого вещества, а на отдельных точках, линиях и участках тела, так называемых потенциальных центрах реакции, откуда реакция постепенно распространяется вглубь кристалла. Центрами реакции являются места на поверхности кристалла CaCO3, где связи с ближайшими частицами ослаблены. К таким активным местам относятся вершины углов, ребра и некоторые точки на гранях кристалла. Особенно реакционноспособными оказываются участки с различного рода поверхностными дефектами.
Так как процесс протекает только на границе раздела фаз, а граница раздела фаз вначале мала, то и скорость процесса мала. По мере достройки зародышей новыми образованиями оксида кальция поверхность раздела фаз на каждом зародыше увеличивается и, следовательно, увеличивается и скорость процесса. Фронт реакции на каждом зародыше увеличивается и затем сливается в единый фронт реакций. В это время скорость процесса достигает максимума. Однако, ввиду того, что кусочки карбоната кальция имеют конечные размеры, начиняя с некоторого момента времени, величина поверхности начинает убывать вплоть до нуля.
Как уже было отмечено, разложение карбоната кальция включает в себя адсорбционно-химические стадии и диффузионные, протекающие последовательно. Наблюдаемая скорость процесса будет определяться скоростью самой медленной стадии:
ωнабл. = ωмедл. стадии. (2.1)
При низких температурах, когда энергия реагирующих молекул мала, самым замедленным этапом является кристаллохимическое превращение, осуществляемое со значительной энергией активации:
![]() .
(2.2)
.
(2.2)
где
![]() –
парциальное давление СО2
на
поверхности CaCO3,
–
парциальное давление СО2
на
поверхности CaCO3,
![]() –парциальное
давление СО2
в газовой фазе.
–парциальное
давление СО2
в газовой фазе.
При высоких температурах, когда энергия реагирующих молекул значительная, самым медленным является этап диффузии CO2 из зоны реакции:
![]() .
(2.3)
.
(2.3)
Это изменение соотношения скоростей вытекает из разной степени влияния температуры на скорость кристаллохимического превращения и скорость процесса диффузии.
В связи с тем, что объём реактора небольшой, можно считать, что воздух быстро заменяется СО2 и разложение идет в атмосфере СО2.
При этом
![]() ;
;
![]()
Для описания кинетики реакции разложения карбоната кальция можно использовать уравнение Б.В.Ерофеева:
![]() ,
(2.4)
,
(2.4)
где α – степень превращения,
k – константа скорости реакции,
t – время от начала реакции,
n – показатель степени, определяемый опытным путем.
Практическое использование уравнения (2.4) возможно после его двойного логарифмирования, приводящего к равенству вида
ln [–ln (1 – α)] = ln k + n ln t. (2.4)
Уравнение (2.4) является уравнением прямой. Величины k и n находят графически, откладывая на оси ординат ln [–ln (1 – α)], а на оси абсцисс – ln t. По величине тангенса угла наклона полученной прямой к оси ln t определяют n. А из величины отрезка, отсекаемого на оси ординат, находят значение константы скорости k. Зная константы скоростей, точнее ln k1 и ln k2 для двух температур (T1 и T2) и при постоянном n, можно рассчитать энергию активации по уравнению Аррениуса:
![]() ,
(2.5)
,
(2.5)
где Е – энергия активации, Дж/моль;
А – постоянный коэффициент, или предэкспоненциальный множитель;
R – универсальная газовая постоянная, равная 8,31 Дж/(мольК).
После
логарифмирования отношения двух форм
уравнения (2.5) при
![]() и
и![]() получим
получим
![]() .
(2.6)
.
(2.6)
Зная константы
скорости
![]() и
и![]() при
при![]() и
и![]() ,
можно рассчитать энергию активации
,
можно рассчитать энергию активации
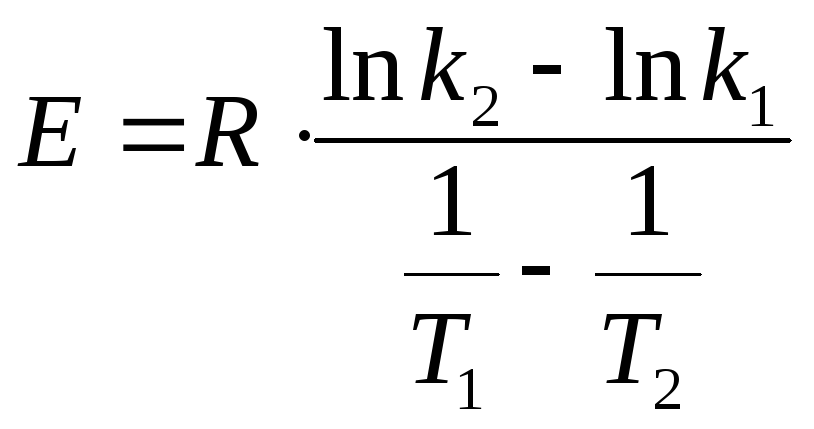 .
(2.7)
.
(2.7)
Порядок выполнения работы
По заданию преподавателя отбирают навеску карбоната кальция определенной крупности, засыпают ее в керамическую лодочку. Разогревают печь до заданной температуры.
Лодочку толкателем помещают в реактор из кварца, закрывают реактор резиновой пробкой со вставленной в нее стеклянной трубкой и таким образом соединяют реактор с реометром. Отмечают, на какую глубину нужно поместить реактор в печь, чтобы лодочка находилась в средней зоне печи и соединительная пробка была достаточно удалена от нагревателя. При достижении заданной температуры в печи реактор вводят в печь до отметки и включают секундомер.
Скорость разложения карбоната кальция определяют по скорости выделения двуокиси углерода. Для этого через каждые 20 с записывают время и показания уровня жидкости в реометре (∆h, мм вод. ст.). По окончании опыта реактор открывают и частично вытаскивают из печи. Берут в одну руку "толкатель", в другую керамическую плитку, подставленную под самый конец реактора, и извлекают толкателем лодочку из реактора на эту плитку.
Результаты опытов заносят в таблицу и строят график
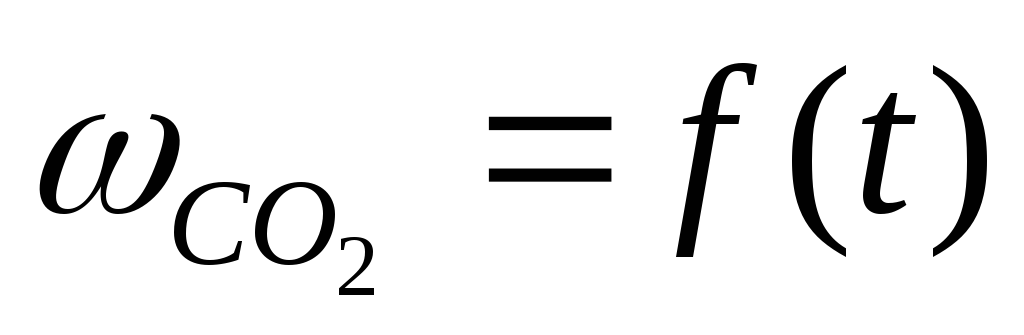 ,
(
,
( –
скорость выделения CO2).
На графике
выбирают
во всем диапазоне 6 – 8 точек и рассчитывают
степень превращения карбоната (α) за
различные промежутки времени как
отношение
–
скорость выделения CO2).
На графике
выбирают
во всем диапазоне 6 – 8 точек и рассчитывают
степень превращения карбоната (α) за
различные промежутки времени как
отношение
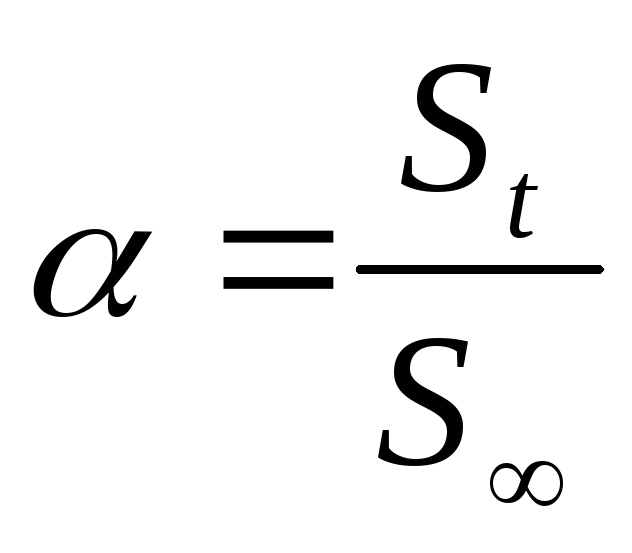 (St
– площадь
под кривой
(St
– площадь
под кривой
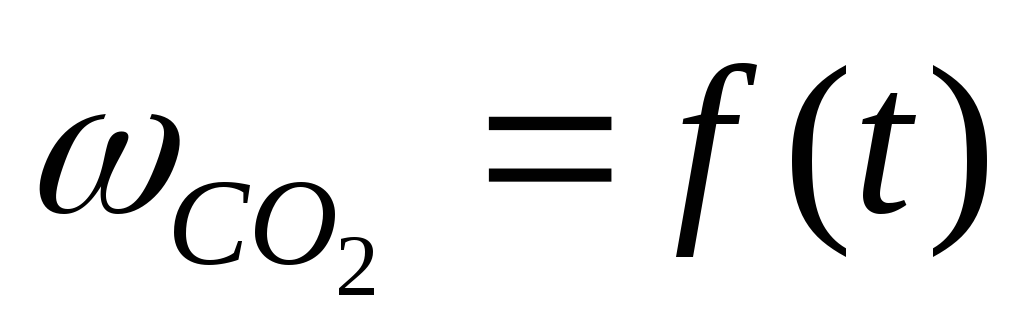 ,
ограниченная координатой t).
Строят график зависимости
,
ограниченная координатой t).
Строят график зависимости
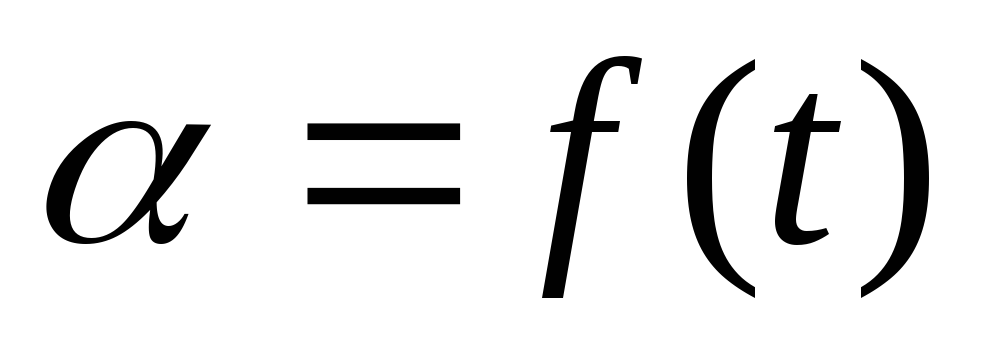 .
.Рассчитывают ln [–ln (1 – α)], строят график зависимости ln [–ln (1 – α)] = f (ln t), находят константы в уравнении Б.В.Ерофеева.
Проводят опыт при другой температуре (согласно п. 1 – 3). Рассчитывают энергию активации.
Для оценки влияния размера зерна CaCO3 на скорость его разложения проводят аналогичные опыты с образцами другой крупности (по заданию преподавателя).
Рекомендуемый вид таблицы
Температура опыта, ºС: ______________
Фракция CaCO3: ____________________
Навеска CaCO3, г: __________________
-
t,
c
∆h,
мм
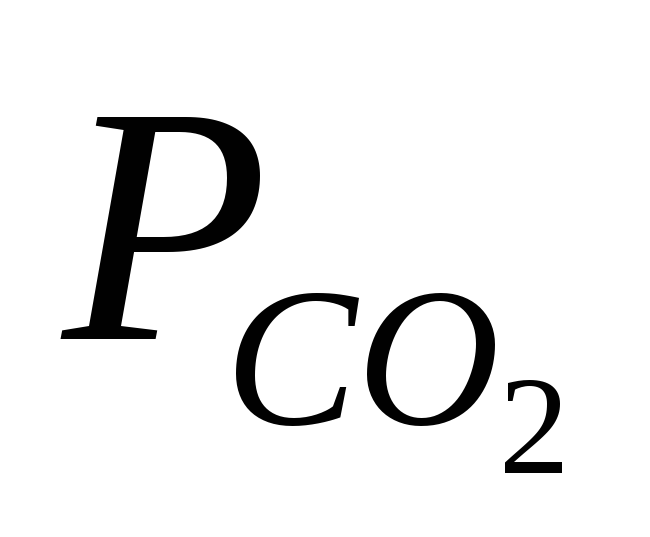 ,
,Па
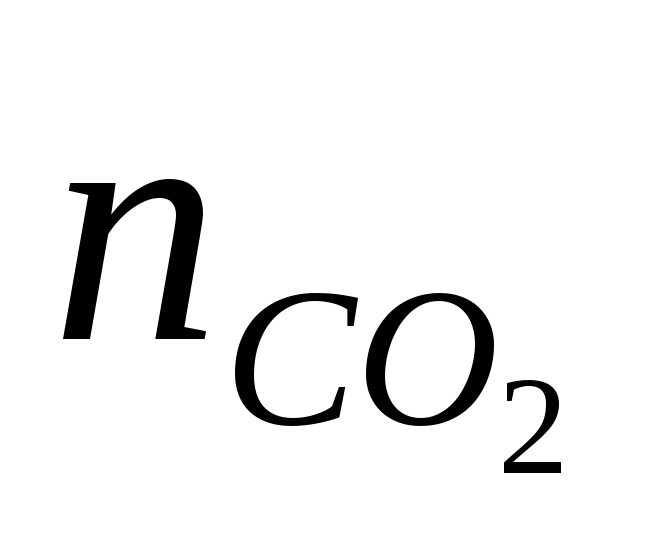
моль
ω,
моль∙с–1
α
ln [–ln (1 – α)]
ln t
