
- •Содержание
- •Общие методические указания
- •Модуль 1. Особенности силикатных материалов и процессов их синтеза
- •Задание 1. Термодинамика реакций в силикатных системах
- •Лабораторная работа № 1
- •Изучение химического равновесия в гетерогенной системе
- •(Расчет термодинамических характеристик реакции
- •Разложения карбоната кальция)
- •Лабораторная работа № 2 Кинетика гетерогенной химической реакции (расчет кинетических характеристик реакции разложения карбоната кальция)
- •Модуль 2. Фазовые равновесия в силикатных системах и диаграммы состояния
- •Задание 2. Диаграммы состояния двухкомпонентных систем Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Задание 3. Диаграммы состояния трехкомпонентных систем
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 11
- •Расчет термодинамических характеристик кристаллизующихся веществ по данным термического анализа
- •Список литературы
Задание 1. Термодинамика реакций в силикатных системах
Выполните следующие девять заданий для данной реакции (табл. 1) (справочные величины, необходимые для расчетов, возьмите в табл. 2).
По значениям стандартных энтальпий образования участвующих в реакции веществ (
 )
вычислите тепловой эффект реакции при
стандартных условиях (
)
вычислите тепловой эффект реакции при
стандартных условиях ( ).
Выделяется или поглощается тепло при
протекании реакции? Эндо - или
экзотермической является данная
реакция?
).
Выделяется или поглощается тепло при
протекании реакции? Эндо - или
экзотермической является данная
реакция?Выведите функциональную зависимость изменения молярной изобарной теплоемкости для реакции от температуры: DC0p = f(T).
Пользуясь законом Кирхгофа и установленной функциональной зависимостью DC0p = f (T) вычислите тепловой эффект реакции при температуре T и стандартном давлении (
 ).
Как влияет увеличение температуры на
величину теплового эффекта реакции?
).
Как влияет увеличение температуры на
величину теплового эффекта реакции?Что характеризует энтропия системы? Качественно оцените знак изменения энтропии (DS) при протекании реакции. Объясните полученный результат.
По значениям стандартных энтропий участвующих в реакции веществ (
 )
вычислите изменение энтропии реакции
при стандартных условиях (
)
вычислите изменение энтропии реакции
при стандартных условиях (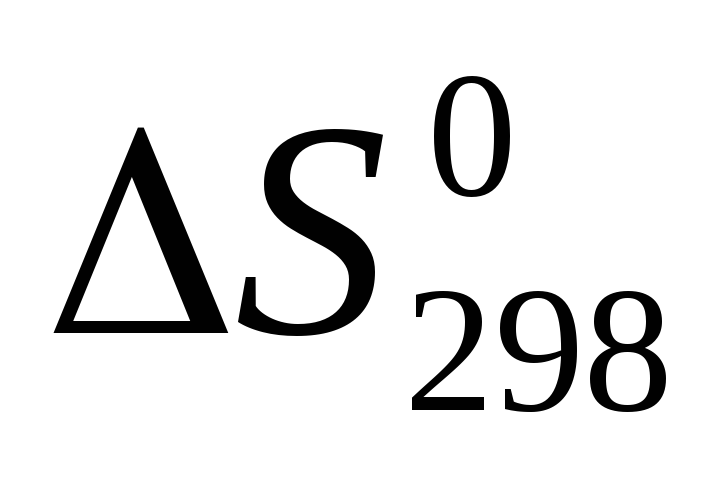 ).
).Используя функциональную зависимость DC0P = f (T) вычислите изменение энтропии реакции при температуре T и стандартном давлении (
 ).
Как влияет повышение температуры на
величину DS0?
).
Как влияет повышение температуры на
величину DS0?Вычислите изменение энергии Гиббса реакции, протекающей при стандартных условиях (
 ).
Возможно ли самопроизвольное протекание
процесса при стандартных условиях?
Определите температуру (T0)
(если такая имеется), выше которой
реакция меняет свое направление.
).
Возможно ли самопроизвольное протекание
процесса при стандартных условиях?
Определите температуру (T0)
(если такая имеется), выше которой
реакция меняет свое направление.Вычислите изменение энергии Гиббса реакции, протекающей при стандартном давлении и температуре T (
 ),
считая, что
),
считая, что и
и  не
зависят от температуры (метод Улиха).
Постройте график зависимости
не
зависят от температуры (метод Улиха).
Постройте график зависимости
 от температуры. Сделайте вывод о влиянии
температуры на вероятность самопроизвольного
протекания процесса в прямом направлении.
от температуры. Сделайте вывод о влиянии
температуры на вероятность самопроизвольного
протекания процесса в прямом направлении.Вычислите изменение энергии Гиббса реакции (
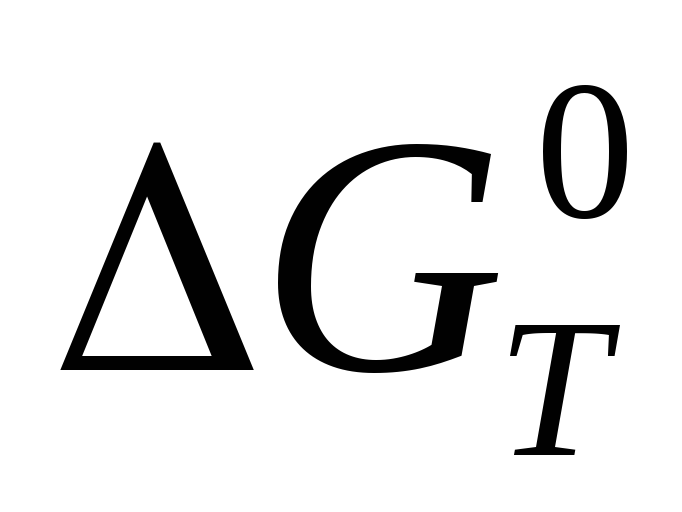 )
при температуреT
и стандартном давлении, учитывая
зависимость
)
при температуреT
и стандартном давлении, учитывая
зависимость  и
и
 от
температуры. Сравните полученные
значения
от
температуры. Сравните полученные
значения
 с величиной изменения энергии Гиббса,
рассчитанной по методу Улиха, и оцените
их расхождение.
с величиной изменения энергии Гиббса,
рассчитанной по методу Улиха, и оцените
их расхождение.
Таблица 1
|
Номер варианта |
Реакция |
Т, К |
|
1 |
СаО(т) + SiO2(кварц) = СаО·SiO2(т) |
1000 |
|
2 |
3СаО(т) + 2SiO2(кварц) = 3СаО·2SiO2(т) |
1000 |
|
3 |
MgO(т) + Al2O3(корунд) = MgO·Al2O3(т) |
1500 |
|
4 |
MgO(т) + SiO2(кварц) = MgO·SiO2(т) |
1000 |
|
5 |
2MgO(т) + SiO2(кварц) = 2MgO·SiO2(т) |
1000 |
|
6 |
СаО(т) + Al2O3(корунд) = СаO·Al2O3(т) |
800 |
|
7 |
3СаО(т) + Al2O3(корунд) = 3СаO·Al2O3(т) |
800 |
|
8 |
СаО(т) + 2Al2O3(корунд) = СаO·2Al2O3(т) |
800 |
|
9 |
FeО(т) + SiO2(кварц) = FeО·SiO2(т) |
1100 |
|
10 |
2FeО(т) + SiO2(кварц) = 2FeО·SiO2(т) |
1100 |
|
11 |
2СаО(т) + SiO2(кварц) = 2СаО·SiO2(т) |
1000 |
|
12 |
Na2О(т) + SiO2(кварц) = Na2О·SiO2(т) |
900 |
Таблица 2
|
Вещество |
Н0f,298,
|
S0298,
|
Коэффициенты уравнения С0P
=
f
(T),
| ||
|
а |
b103 |
с110–5 | |||
|
Al2O3(корунд) |
1670,69 |
50,92 |
114,55 |
12,89 |
–34,31 |
|
СаО(т) |
–635,10 |
38,07 |
49,62 |
4,52 |
–6,95 |
|
SiO2(кварц) |
–910,94 |
41,84 |
46,99 |
34,31 |
–11,30 |
|
Na2О(т) |
–417,98 |
75,06 |
77,11 |
19,33 |
–12,59 |
|
FeО(т) |
–264,85 |
60,75 |
50,80 |
8,61 |
–3,31 |
|
MgO(т) |
–601,49 |
27,07 |
48,98 |
3,14 |
–11,44 |
|
СаО·SiO2(т) |
–1636,52 |
82,04 |
111,51 |
15,07 |
–27,29 |
|
2СаО·SiO2(т) |
–2309,58 |
127,67 |
151,74 |
36,96 |
–30,31 |
|
3СаО·2SiO2(т) |
–3826,17 |
210,97 |
267,90 |
37,88 |
–69,49 |
|
СаO·Al2O3(т) |
–2322,39 |
114,21 |
150,74 |
41,78 |
–33,33 |
|
3СаO·Al2O3(т) |
–3558,10 |
205,53 |
260,70 |
19,17 |
–50,11 |
|
СаO·2Al2O3(т) |
–3994,70 |
177,91 |
276,66 |
22,94 |
–74,51 |
|
MgO·SiO2(т) |
–1549,87 |
67,81 |
102,77 |
19,84 |
–26,08 |
|
2MgO·SiO2(т) |
–2178,94 |
95,02 |
140,90 |
27,38 |
–35,66 |
|
MgO·Al2O3(т) |
–2299,30 |
80,70 |
154,19 |
26,81 |
40,98 |
|
Na2О·SiO2(т) |
–1559,70 |
113,86 |
130,35 |
40,18 |
–27,08 |
|
FeО·SiO2(т) |
–1207,03 |
96,28 |
158,40 |
17,00 |
–27,30 |
|
2FeО·SiO2(т) |
–1500,05 |
145,25 |
152,83 |
39,18 |
–28,04 |
Пример 1.1. Выведите функциональную зависимость изменения молярной изобарной теплоемкости от температуры (DC0p = f(T)) для реакции С(графит) + CO2(г) = 2CO(г). Вычислите тепловой эффект реакции при 500 К, если при стандартных условиях он равен 172,5 кДж.
Решение. Зависимость Cp реагирующих веществ от температуры представлена для неорганических веществ уравнениями вида
Cp = a + bT + c1T –2,
поэтому величину DСP рассчитывают по уравнению
DCP = Da + DbT +Dc1T –2 .
Выпишем из справочника [9] температурные коэффициенты в уравнениях теплоемкости для веществ, участвующих в реакции.
|
Вещество |
Коэффициенты
уравнения С0P
=
f
(T),
| ||
|
а |
b103 |
с110–5 | |
|
С(графит) |
16,86 |
4,77 |
–8,54 |
|
СО(г) |
28,41 |
4,10 |
–0,46 |
|
СО2(г) |
44,14 |
9,04 |
–8,53 |
Вычислим их изменения:
Da = 2. 28,41 – 44,14 – 16,86 = -4,18;
Db = (2. 4,10 – 9,04 – 4,77).10–3 = -5,61.10–3;
Dc1 = [2. (–0,46) – (-8,53) – (-8,54)] .105 = 16,15.105.
Функциональная зависимость изменения молярной изобарной теплоемкости от температуры для данной реакции имеет вид:
DCP = -4,18 -5,61.10–3T + 16,15.105T –2 .
Для расчета теплового эффекта реакции воспользуемся уравнением Кирхгофа в интегральной форме:
![]() .
.
После подстановки зависимости DCP от T в уравнение Кирхгофа и интегрирования получим:
![]()

Пример 1.2.
Изменение энтропии реакции С(графит)
+ CO2(г)
= 2CO(г)
при стандартных условиях (![]() )равно 175,46
)равно 175,46![]() .
Используя функциональную зависимость
теплоемкостей реагирующих веществ от
температуры (см. пример 1), вычислите
изменение энтропии при температуре
500 К (
.
Используя функциональную зависимость
теплоемкостей реагирующих веществ от
температуры (см. пример 1), вычислите
изменение энтропии при температуре
500 К (![]() ).
).
Решение. Изменение энтропии реакции при заданной температуре находим по уравнению
![]()
После подстановки DCP = Da + DbT +Dc1T –2 и интегрирования получим:
![]()
Значения Da,
Db
и Dc1
рассчитаны в примере 1. Величина
![]() равна:
равна:
![]() =
178,03
=
178,03![]() .
.
Пример 1.3.
Рассчитать
изменение энергии Гиббса реакции
при температуре 500 К и стандартном
давлении (![]() ):
а) по уравнению Улиха, считая, что
):
а) по уравнению Улиха, считая, что![]() и
и
![]() не зависят от
температуры; б) учитывая зависимость
не зависят от
температуры; б) учитывая зависимость
![]() и
и
![]() от
температуры.
от
температуры.
Решение.
а) Рассчитаем изменение энергии Гиббса реакции по уравнению Улиха (приближенный расчет):
![]() .
.
Значения
![]() и
и![]() возьмем в примерах
1 и 2.
возьмем в примерах
1 и 2.
![]() 84770
Дж.
84770
Дж.
б) Более точно
величину
![]() рассчитаем по уравнению:
рассчитаем по уравнению:
![]() .
.
Значения
![]() и
и![]() возьмем в примерах
1 и 2.
возьмем в примерах
1 и 2.
![]() 84385
Дж.
84385
Дж.
