
Расчет электронных характеристик молекул полуэмпирическим методом Хюккеля
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Государственное образовательное учреждение высшего профессионального образования
«Оренбургский государственный университет»
Кафедра химии
Г.И. КОБЗЕВ
РАСЧЕТ ЭЛЕКТРОННЫХ ХАРАКТЕРИСТИК МОЛЕКУЛ ПОЛУЭМПИРИЧЕСКИМ МЕТОДОМ ХЮККЕЛЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ПРАКТИЧЕСКИМ РАБОТАМ ПО КУРСУ
«КВАНТОВАЯ ХИМИЯ»
Рекомендовано к изданию Редакционно-издательским советом государственного образовательного учреждения высшего профессионального образования
«Оренбургский государственный университет»
Оренбург 2004
3
ББК 24.5 К 55
УДК 544.18
Рецензент доктор химических наук, профессор А.В. Стряпков
Кобзев Г.И.
К55 Расчет электронных характеристик молекул полуэмпирическим методом Хюккеля: Методические указания к выполнению практических занятий.- Оренбург ГОУ ОГУ, 2004.-29 с.
Практические занятия по квантовой химии предполагают проведение расчетов электронных характеристик молекул простейшим из полуэмпирическим методов в π - приближении Хюккеля. Метод позволяет на простых примерах рассмотреть структуру молекулярных орбиталей и рассчитав индексы электронной структуры судить о химических свойствах молекул и их реакционной способности.
Методические указания предназначены для выполнения практических работ по дисциплине «Квантовая химия» для студентов, специальностей 011000, при изучении дисциплин “Квантовая химия”, “Строение вещества”, специальных курсов связанных с изучением и применением расчетных методов квантовой химии.
ББК 24.5
© Кобзев Г.И., 2004 © ГОУ ОГУ, 200
4
Содержание
Введение …………………………………………………………………………… 4
1Расчет электронных характеристик молекул методом Хюккеля…..…..…5
1.1Приближения Хюккеля……………..……………………………………….5
1.2 Расчет химических систем…………..………………………………...........6 1.2.1 Этилен -
С2Н4……………………..………………………………………….6
1.2.2 Аллильный радикал -
С3Н5……..…………………………………………..7 1.2.3 Бутадиен – С4Н6………………………..…………………………………….8
1.2.4 Третбутильный радикал С(СН3)3…..……………………………………...10
1.3 Применение отдельных элементов симметрии для понижения порядка
детерминанта…………..…………………………………………...……….11
1.3.1 Бутадиен – С4Н6………………………..…………………………………...11 1.3.2 Бензол – С6Н6………………..……………………………………………..12 1.3.3 Н3 – линейная структура…………..……………………………………….13
1.3.4 Н3 + – линейная структура………..………………………………………...14 1.3.5 Н3 −, – линейная
структура………..………………………………………..14 1.3.6 Н3, Н3 +, Н3 −– структуры в виде равностороннего
треугольника…..……15 1.3.7 Пентадиенильный анион…………………………………………..……….16
1.4 Альтернантные углеводороды
(АУ)…………...………………………….17
1.4.1 Расчет коэффициентов АО на не связывающей МО для не четных АУ..17
1.5Приближенный расчет энергии первой полосы поглощения
альтернантныху глеводородов………………………….………………...18 1.5.1 Расчет энергии первой полосы поглощения бензола…………………....18 1.5.2 Расчет энергии первой полосы поглощения нафталина…….…………..19
5
1.5.3 Расчет энергии первой полосы поглощения антрацена…….…………...19
1.6 Расчет электронных характеристик содержащих в своем составе
гетероатомы……………………………….……………………...………...19 1.6.1 Расчет молекулы формальдегида……….…………………………………20
1.6.1.1 Расчет дипольного момента формальдегида……………………………..21 1.6.2 Расчет системы (NR2)2CO на примере молекулы мочевины
(NH2 )2CO…….………………...……………………………………………22 1.6.2.1 Расчет дипольного момента молекулы мочевины
(NH2)2CO……………23 1.7 Индуктивный π эффект в альтернантных углеводородах, атом-
атомная
поляризация |
....................................................................................................24 |
|
1.7.1 Расчет атом-атомной поляризации в |
|
бутадиене…………………….……26 |
1.7.2 |
Расчет индуктивного π эффекта в молекуле пропеналя |
|
СН2СНСНО…..27 |
1.8Практические задания для самостоятельной работы
студентов……..…28 2 Основная рекомендуемая литература…………………………………….29
3 Дополнительная литература……………………………………………....29
Список использованных источников………………………………………30
Введение
В зависимости от степени аппроксимации параметров возникающих при приближенном решении уравнения Шредингера для многоцентровых, многоэлектронных систем квантово-химические методы подразделяют на эмпирические (все параметры взяты из экспериментальных и спектроскопических данных), полуэмпирические (часть параметров зануляется, часть параметров заменяется числовыми величинами из эксперимента и часть оставшихся интегралов вычисляется), не эмпирические (все интегралы, возникающие при решении уравнения Шредингера вычисляются).
6
Расчет электронных характеристик молекул и комплексов столкновений может быть проведен, например различными методами молекулярной механики или динамики, полуэмпирическими или неэмпирическими методами ab initio.
В методах молекулярной механики атомы рассматриваются как Ньютоновские частицы, находящиеся в силовом поле и взаимодействие, между которыми описывается потенциальной энергией. Потенциальная энергия зависит от длин связей, углов между связями, углов кручения и от взаимодействия несвязанных молекулярных фрагментов с помощью электростатических сил, Ван-дер-ваальсовых сил или взаимодействий обуславливающих водородные связи. В зависимости от приближений используемых при расчете силового поля и от гармонических функций описывающих это поле встречаются различные модификации. Например, MM+, AMBER, BIO и т.д.
Полуэмпирические методы квантовой химии в зависимости от применения нулевого дифференциального и аппроксимации остовных, кулоновских и обменных интегралов входящих в матричные элементы оператора Фока имеют разные модификации. Это хорошо известные методы МОО ССП INDO/1,2,S, CNDO/1,2, MINDO/1,2,3, MNDO, AM1, PM3, MP2,
Хюккеля и ряд других. Каждый из методов позволяет в результате расчета получить набор тех или иных электронных или спектральных характеристик значения, которых хорошо совпадают с экспериментом.
Например, полуэмпирический метод Хюккеля является π - приближением поскольку при расчете структуры молекулярных орбиталей (МО) используются коэффициенты 2р атомных орбиталей (АО) расположенных перпендикулярно линии соединяющей ядра или плоскости молекулы. Наиболее достоверные результаты получаются для молекул с сопряженными связями для молекул обладающих ароматическими свойствами. При этом, в методе Хюккеля, первое возбужденное синглетное и первое триплетное состояния не различимы по энергии.
1Расчет электронных характеристик молекул методом Хюккеля.
1.1Приближения Хюккеля
Одним из способов приближенного решения уравнения Шредингера является вариационный принцип. Согласно этому принципу энергия вычисленная с любой пробной функцией всегда больше истинной энергии. Е > Е0
7
Математически процедура вычисления минимальной энергии сводится к нахождению производной от энергии по параметрам, через которые выражается пробная функция.
Запишем уравнение Шредингера в общем виде:
Н Ψ = ЕΨ (1)
Домножая это уравнение слева и справа на Ψ* и интегрируя обе части, получим:
|
|
|
ψ *HψdV |
|
|
Е = |
|
∫ |
|
(2) |
|
|
ψ *ψdV |
||||
|
|
|
∫ |
|
|
Представляя Ψ в виде линейной комбинации функций χµ |
|
||||
Ψi = ∑ Сiµχµ |
(3) |
||||
|
|
µ |
|
|
|
и вычисляя производные от Е по параметрам Сiµ |
|
||||
|
∂E |
= 0 |
|
(4) |
|
|
∂Ciµ |
|
|||
|
|
|
|
|
|
приходим к системе линейных, однородных уравнений (секулярные уравнения):
∑ Сiν(Нµν - εiSµν) = 0 |
(5) |
ν |
|
Уравнение (5) имеет единственное решение если детерминант данной |
|
системы равен нулю: |
|
(Нµν - εiSµν) = 0 |
(6) |
Приближения Хюккеля является π приближением и позволяют заменить матричные элементы Нµν кулоновским или резонансным интегралом α и β
значения которых выбираются из спектроскопических данных, а . Sµν - интеграл перекрывания заменяется на символ Кронекера
Нµµ = α
Нµν = β, если атомы, на которых локализованы атомные π - орбитали химически связаны
Нµν = 0, если атомы химически не связаны
Sµν = δµν (0 – если µ ≠ν, 1 - µ =ν)
1.2 Расчет химических систем
1.2.1 Этилен - С2Н4
Атомы водорода при расчете методом Хюккеля не учитываются, поэтому схему , или как говорят граф, можно изобразить следующим образом
С1 •________• С2
8

Молекулярная орбиталь для этилена в приближении Хюккеля представляется в виде суммы двух атомных орбиталей 2Pz (ось z перпендикулярна плоскости молекулы).
ψ = С1χ1 + С2χ2
Система уравнений (5) запишется в виде:
С11(Н11 - εS11) + С12(Н12 - εS12) = 0
С21(Н21 - εS21) + С22(Н22 - εS22) = 0
В этом уравнении неизвестными являются коэффициенты С11, С12, С21,
С22 и энергии молекулярных орбиталей εi . |
|
||||
Согласно приближениям Хюккеля |
|
||||
Н11 |
= Н22 = α |
|
(для углерода – С |
α= -5,6 e.V) |
|
Н12 |
Н21 = β |
|
(для связи С-С |
β= -4,9 e.V) |
|
S12 = S21 = 0.28 |
возьмем S12 = S21 = 0 |
||||
С1(α - ε) + С2(β) = 0 |
|
|
|||
С1(β) + С2(α - ε) = 0 |
|
|
|||
Обозначим |
α −ε |
= Х, тогда система уравнений перепишется в виде: |
|||
β |
|||||
С1х + С2 = 0 С1 + С2х = 0
Выписывая детерминант данной системы, и решая его получим:
Х |
1 |
Х2 – 1 = 0 |
|
= 0, |
|
1 |
Х |
|
х1 = 1, х2 = -1
Подставляя эти значения, для Х в систему уравнений получим значения для коэффициентов
С1 = С2 = 1/ 
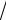 2 , для Х = 1 и С1 = 1/
2 , для Х = 1 и С1 = 1/ 
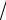 2 С2 = -1/
2 С2 = -1/ 
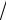 2 для Х
2 для Х
= -1
Вычисленные коэффициенты позволяют записать молекулярные
орбитали: |
|
Ψ1 = 1/ 2 (χ1 + χ2) |
|
Ψ2= 1/ 2 (χ1 − χ2) |
|
ε1 = α +β = -5,6 – 4,9 = 10, 5 eV |
ПИ = -10,5 eV = ε1 |
ε2 = α -β = -5,6 – (-4,9) = 0, 7 eV |
СЭ = - 0,7 eV = ε2 |
Где ПИ и СЭ - потенциал ионизации и сродство к электрону соответственно.
9

Электронная плотность на каждом атоме равна 1 |
|
|
|
|
|
||||||||||||||||
qi = Pµµ =∑ ni • Сiµ2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
i |
|
) • (1/ |
|
) + 0 • (1/ |
|
|
|
|
) • (1/ |
|
|
|
|
|
||||||
q1 = 2(1/ |
|
|
|
|
|
|
|
|
) = 1 |
||||||||||||
2 |
2 |
2 |
2 |
||||||||||||||||||
q2 = 2(1/ |
|
) • (1/ |
|
) + 0 • (-1/ |
|
|
|
|
) • (-1/ |
|
|
|
) = 1 |
||||||||
2 |
2 |
|
2 |
2 |
|||||||||||||||||
порядок связи Pµν =∑ niСiµСiν |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
P12π = 2(1/ |
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
) • (1/ |
|
)+ 0(1/ |
|
) • (1/ |
|
) = 1 |
||||||||||||
|
|
2 |
2 |
2 |
2 |
||||||||||||||||
Учитывая, что P12σ = 1 получим P12π + σ = P12σ = P12π = 2, что |
|||||||||||||||||||||
свидетельствует о том, что в этилене двойная связь. |
|
|
|
|
|
||||||||||||||||
Х |
1 |
|
|
|
Х2 – 1 = 0 |
|
|
Х1,2 = ± 1 |
|
|
|
|
|
||||||||
|
= 0, |
|
|
|
|
|
|
|
|
|
|
||||||||||
1 |
Х |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.2.2 Аллильный радикал - С3Н5
Схему можно нарисовать следующим образом:
С1 •________• С2 ________• С3
Уравнения Хюккеля для С3Н5 запишутся в виде:
С1х + С2 = 0 С1 + С2х + С3 = 0
С2 + С3х = 0
Выписывая детерминант этой системы, и решая его, получим четыре значения Х.
Распределяя значения Х в порядке возрастания, получим:
Х |
1 0 |
Х3 – 2Х = 0 |
||||
1 |
Х 1 = 0, |
|||||
0 |
1 Х |
|
|
|
||
Х1 = - |
|
, Х2 = 0, |
Х3 = + |
|
, |
|
2 |
2 |
|||||
Подставляя поочередно данные значения Х в систему уравнений Хюккеля получим для каждого Х свой набор коэффициентов. Молекулярные орбитали радикала С3Н5 будут выглядеть следующим образом:
Ψ1 = 1/ 2 (χ1 + 
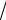 2 χ2 + χ3) Ψ2= 1/
2 χ2 + χ3) Ψ2= 1/ 
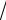 2 (χ1 − χ3)
2 (χ1 − χ3)
Ψ3 = 1/ 2 (χ1 − 
 2 χ2 + χ3)
2 χ2 + χ3)
ε1 |
= α +1,41β |
|
ε2 |
= α |
ПИ = ε2 |
ε3 = α -1,41β = |
СЭ = ε3 |
|
10
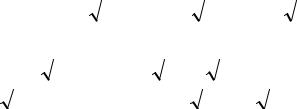
Еполн= ∑ ni • εi = 2(α +1,41β) +1(α) = 3α +2,82β
i
Энергия локализации в аллильном радикале равна одной энергии
молекулы этилена (Энергия локализации молекулы равна Еэтилен • (число двойных связей в молекуле)).
Елок= 2(α +β) = 2α +2β Еделок= Еполн − Елок = 3α +2,82β − 2(α +β) = α +0,82β
Электронные плотности на каждом атоме
P11 = P22 = P33 =1 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
P12π = 2(1/2)( |
|
) + 0(1/ |
|
|
|
)(0) = |
|
|
= P23π |
|||||||||||
2 |
2 |
2 |
||||||||||||||||||
Индекс свободной валентности Fµ на каждом атоме составляет: |
||||||||||||||||||||
F1 |
= F3 = |
|
− P12π = |
|
− |
|
|
|
= |
1,73 − 1,41 = 0,32 |
||||||||||
3 |
3 |
2 |
||||||||||||||||||
F2 |
= |
|
− (P12π + P23π) = |
|
− 2 |
|
|
= 1,73 − 2 •1,41 = -1,09 |
||||||||||||
3 |
3 |
|
2 |
|||||||||||||||||
Следовательно в аллильном радикале между первым и вторым атомами углерода, и между вторым, и третьим атомами углерода порядок связи одинаковый, и равен 1,44
Индекс свободной валентности указывает, что атака по концевым атомам в данной системе более предпочтительна, чем по среднему атому.
1.2.3 Бутадиен – С4Н6
Схему можно нарисовать следующим образом:
С1 •________• С2 ________ С3 •________• С4
Уравнения Хюккеля для С2Н4 запишутся в виде:
С1х + С2 = 0 С1 + С2х + С3 = 0
С2х + С3х + С4 = 0 С3 + С4х = 0
Выписывая детерминант этой системы и решая его получим четыре значения Х.
Распределяя значения Х в порядке возрастания, получим:
Х1 = -1,62, Х2 = -0,62, Х3 = + 0,62, Х4 = -1,62
Подставляя поочередно данные значения Х в систему уравнений Хюккеля для бутадиена, получим для каждого Х свой набор коэффициентов. Молекулярные орбитали будут выглядеть следующим образом:
Ψ1 = 0,37χ1 + 0,68χ2 + 0,68χ3 + 0,37χ4 Ψ2= 0,68χ1 + 0,37χ2 − 0,37χ3 + 0,68χ4 Ψ3 = 0,68χ1 − 0,37χ2 − 0,37χ3 + 0,68χ4
11

Ψ4= 0,37χ1 − 0,68χ2 + 0,68χ3 − 0,37χ4 |
|
|
ε1 |
= α +1,62β |
ПИ = -9,0 eV = ε2 |
ε2 |
= α +0,62β = -5,6 – 3,4 = -9,0 eV |
|
ε3 = α -0,62β = -5,6 – (-3,4) = +2,2 eV |
СЭ = +2,2 eV = ε3 |
|
ε4 |
= α - 1,62β |
|
Еполн= ∑ ni • εi = 2(α +1,62β) +2(α +0,62β) = 4α +4,48β
i
Еполн=4 • (-5,6) + 4,48 • (-3,4) = 37,632 eV
Энергия локализации в молекуле бутадиена равна двум энергиям
молекулы этилена (Энергия локализации молекулы равна Еэтилен • (число двойных связей в молекуле)).
Елок= 2(α +β) • 2 = 4α +4β = 4• (-9,0) = 36 eV
Еделок= Еполн − Елок = 4α +4,48β − 4(α +β) = 0,48β = 1,632
eV
Электронные плотности на каждом атоме |
||||||||||
P11 = P22 = P33 = P44 =1 |
||||||||||
P12π = P34π = 0,888, |
|
P23π = 0,446 |
||||||||
Индекс свободной валентности Fµ на каждом атоме составляет: |
||||||||||
F1 |
= F4 |
= |
|
|
|
− P12π = |
|
− 0,88 = 0,85 |
||
3 |
3 |
|||||||||
F2 |
= F3 |
= |
|
|
− (P12π + P23π) = |
|
− (0,88 + 0,44)= 0,41 |
|||
|
3 |
3 |
||||||||
Следовательно в бутадиене между первым и вторым атомами углерода порядок связи равен не двум, как записано в классической структурной формуле по Бутлерову, а 1,88, в то время, как между вторым и третьим атомами углерода связь С-С не одинарная, а составляет 1,44.
Индекс свободной валентности указывает, что атака по концевым атомам в бутадиене более благоприятна, чем по атомам находящимися в середине.
1.2.3 Третбутильный радикал С(СН3)3
Схему можно изобразить следующим образом:
С1 •________• С2 ________ •С3
____________• С4
Уравнения Хюккеля для С2Н4 запишутся в виде:
С1х + С2 = 0 С1 + С2х + С3 + С4 = 0
12
