
микрZanyatie_1_2_2
.pdfПримечание:
1Трехкратно исследуют по 100 мл отобранной пробы воды.
2Превышение норматива не допускается в 95 % проб, отбираемых в точках водоразбора наружной и внутренней водопроводной сети в течение 12 мес., при количестве исследуемых проб не менее 100 за год.
3Определяют только в системах водоснабжения из поверхностных источников перед подачей воды в распределительную сеть.
4Определение проводят при оценке эффективности технологии обработки воды.
Определение ОМЧ глубинным методом.
Методика. Водопроводную воду засевают в объеме 1 мл, воду открытых водоемов – в объемах 1,0; 0,1; 0,01 мл. Все пробы вносят в стерильные чашки Петри, после чего их заливают 10-12 мл расплавленным и остуженным до 45-500 С питательным агаром, который тщательно перемешивают с водой. Посевы инкубируют при 370 С в течение 24-48 ч. Воду из открытых водоемов засевают параллельно на две серии чашек, одну из которых инкубируют при 370 С в течение суток, а другую – 2 суток при 200 С. Затем подсчитывают количество выросших на поверхности и в глубине среды колоний и высчитывают ОМЧ.
Определение БГКП Метод мембранных фильтров
Для определения БГКП этим методом используют фильтровальный аппарат Зейтца, который перед началом исследований протирают тампоном, смоченным в спирте, стерилизуют прокаливанием и устанавливают на колбе Бунзена.
Затем в прибор помещают нитрацеллюлозный или ацетатцеллюлозный мембранный фильтр с диаметром пор не более 0,45 мкм. Такие фильтры предварительно стерилизуют методом кипячения. Выбранный для исследования объем воды пропускают через фильтр, присоединяя аппарат к вакуумному насосу. Если анализируют несколько проб воды, то для каждой из них используют отдельный мембранный фильтр. Перед фильтрованием новой пробы аппарат стерилизуют. После пропускания через них воды фильтры помещают на поверхность среды Эндо в чашки Петри, располагая их на питательной среде фильтрующей стороной вверх. Чашки затем инкубируют в термостате 24 ч при 37ºС . В состав среды Эндо входят лактоза, индикатор и МПА и поэтому БГКП образуют на ней колонии красного цвета с металлическим отливом. Подсчитывают количество таких колоний, готовят из них мазки и окрашивают по Граму, а также проверяют оксидазную активность. Оксидазоотрицательные бактерии, разлагающие лактозу до кислоты и газа, обнаруженные на фильтре, позволяют дать положительный ответ о наличие в воде БГКП. При анализе питьевой воды вычисляют количество БГКП, содержащихся в 100 мл.
Для дифференциации ОКБ (общих колиформных бактерий) и ТКБ (термотолерантных колиформных бактерий) каждую выросшую на фильтре колонию БГКП засевают в две пробирки с лактозной средой. Одну из пробирок предварительно прогревают до 44ºС с тем, чтобы инактивировать ОКБ. Затем эту пробирку инкубируют при этой же температуре в течение 24 ч (для подтверждения наличия ТКБ). Вторую пробирку с посевом ставят в термостат при температуре 37ºС на 48 ч, чтобы убедиться в наличии ОКБ.
11
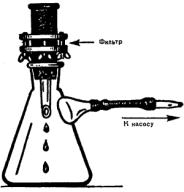
Колба Бунзена
Рис. 4. Фильтр Зейтца и колба Бунзена для фильтрации воды
Бродильный (титрационный) метод
Этот метод известен также под названием: «двухфазный бродильный метод». Для установления содержания колиформных бактерий в воде, исследуемые пробы засевают в глюкозо-пептонную среду (ГПС) для подращивания микроорганизмов. Объемы воды при этом определяются в зависимости от водоисточника и предполагаемой степени его загрязненности.
1 этап исследования. (1 фаза) Исходный объем воды делят на несколько порций, которые засевают в различные объемы питательной среды. Например, посев воды с исходным объемом 300 мл производят следующим образом: два объема по 100 мл засевают в два флакона с 10 мл питательной среды, а 10 объемов по 10 мл той же пробы воды засевают в 10 пробирок, содержащих по 1 мл питательной среды. Посевы инкубируют в термостате при 43ºС в течение 7 -12 ч. Указанная температура подавляет рост сапрофитных микроорганизмов, но не влияет на колиформные бактерии.
На 2 этапе (2 фаза) из флаконов и пробирок, при наличии в них признаков роста (помутнение, газообразование) делают высевы петлей на чашки Петри со средой Эндо, разделенной на 3-4 сектора, и помещают их в термостат при 37ºС на 18-20ч для того, чтобы получить рост изолированных колоний. Емкости с посевами воды в среде ГПС, на которых через 7-12 ч не было признаков роста, оставляют в термостате еще на 24 - 48 ч. Отсутствие роста в них через 48 ч свидетельствует об отсутствии в воде БГКП. При просмотре посевов на среде Эндо обращают внимание на колонии красного, розового, бледно-розового цвета с металлическим блеском. Делают из них мазки, окрашивают по Граму и проверяют оксидазную активность, позволяющую дифференцировать ОКБ от других грамотрицательных бактерий. Наличие грамотрицательных, оксидазоотрицательных палочек свидетельствует о наличие в воде БГКП. Для определения термотолерантных колиформных бактерий по 2-3 лактозоположительные колонии из каждого сектора со среды Эндо засевают в пробирки с любой средой, содержащей лактозу, предварительно нагретой до 44ºС и помещают в термостат на 24 ч при той же температуре. Образование в пробирках кислоты и газа свидетельствует о том, что в исследуемой пробе присутствуют термотолерантные колиформные бактерии (ТКБ). Это позволяет сделать вывод о свежем фекальном загрязнении воды.
12
к работе № 3
Микрофлора почвы
Состав микрофлоры определяется климатическими, почвенно-географическими условиями и зависит от комплекса факторов – содержания источников питания, влажности, рН, аэрации, структуры почвы, способов обработки, взаимоотношений между микроорганизмами и др.
Основную массу почвенных микроорганизмов составляют сапрофитные и лишь незначительное количество приходится на долю патогенных видов.
Санитарно-микробиологическое состояние почвы оценивается на основании наличия бактерий - показателей фекального загрязнения. Почвы, с преобладанием сани- тарно-показательных бактерий, расцениваются как санитарно-неблагополучные, загрязненными фекалиями человека или животных. Присутствие в почве бактерий группы ки-
шечной палочки (БГКП или колиформных) и энтерококков (разновидность Streptococcus faecalis) указывает на свежее фекальное загрязнение. Наличие бактерий родов Citrobacter и Enterobacter - на несвежее, a Clostridium perfringens - на давнее фекальное загрязнение. Более точная оценка проводится с помощью определения индекса БГКП - количество бактерий группы кишечной палочки (БГКП), обнаруженных в 1 г почвы, перфрингенс-титра - масса почвы (в граммах), в которой обнаружена 1 особь Clostridium perfringens, общей численности сапрофитных, термофильных и нитрифицирующих бактерий (ОМЧ) в 1 г почвы.
Патогенные микроорганизмы выявляют в объектах внешней среды чаще всего для того, чтобы оценить эпидемиологическую ситуацию и принять необходимые меры для ликвидации ис-
точников инфекции. В зонах активного земледелия почву исследуют на содержание в ней спор возбудителей столбняка, чтобы провести своевременно профилактику лиц, работающих в земледелии.
Нормативы: чистая почва: коли-титр - 1 и выше; перфрингенс-титр - 0,001 и выше;
ОМЧ- 100-1000.
Загрязненная почва: коли-титр - 0,9 - 0,01; перфрингенс-титр - 0,009-0,0001; ОМЧ- 1000-100000.
Сильно загрязненная почва: коли-титр - 0,0009 и ниже; перфрингенс-титр -0,00009 и
ниже; ОМЧ - 100000-4000000.
Метод учета ОМЧ на мясопептонном агаре
Почву берут на глубине 10-15 см стерильным ножом (из разных мест не менее 10 проб) в стерильную банку. Образцы почвы, доставленные в лабораторию, освобождают от крупных примесей – стекол, камней, корней и др. Крупные комочки почвы измельчают, затем образцы пропускают через сито с диаметром отверстий не более 3 мм, объединяют и из этой смеси берут навеску 10г.
Приготовленную навеску вносят в колбу с 90 мл стерильной дистиллированной воды и тщательно перемешивают взбалтыванием в течение 5-10 мин. Такая обработка необходима для того, чтобы извлечь микроорганизмы из комочков земли и с поверхности почвенных частиц. Полученную равномерную взвесь отстаивают 2 мин и затем готовят из нее ряд 10-кратных разведений, последовательно перенося стерильной пипеткой по 1 мл в пробирки с 9 мл стерильной дистиллированной воды. Схема последовательных разведений почвы представлена на схеме. При приготовлении разведений взвесь переносят в каждую последующую пробирку новой стерильной пипеткой. Таким образом, готовят
13
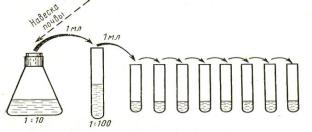
разведения до 1:1000000 и более в зависимости от того, из каких почв были взяты пробы для исследования, и их предполагаемой заселенности микроорганизмами. Для посева используют не менее двух различных разведений (обычно используют два последних, максимальных). Из каждого выбранного разведения по 1 мл вносят в 2 стерильные чашки Петри (для получения средних показателей) и заливают 15-20 мл расплавленного и охлажденного до 45ºС МПА. Осторожно передвигая чашки по поверхности стола, перемешивают агар с внесенными в него разведениями почвы. После застывания питательной среды чашки инкубируют в термостате при температуре 30-35ºС в течение 24 - 48 ч. Количество микроорганизмов, содержащихся в 1г исследуемой почвы, определяют следующим образом. Подсчитывают количество колоний, выросших на каждой из двух чашек, суммируют полученные результаты и делят на 2, вычисляя среднеарифметический показатель, и умножают его на степень разведения. Для подсчета берут чашки, на которых выросло от 50 до 150 колоний. Пример. В чашках, засеянных почвенной суспензией, взятой из разведения 1: 10000, выросли в среднем 75 колоний. 75 умножаем на степень разведения - 10000 и получаем результат - 750000 бактерий. То есть такое количество микроорганизмов содержится в 1 г исследуемого образца почвы.
Схема последовательных разведений почвы.
Определение общего количества бактерий группы кишечной палочки - БГКП
Методика. Различные разведения почвенной суспензии засевают по 1 мл в пробирки со средой Кесслера (1л дистиллированной воды, 10 г пептона, 50 мл бычьей желчи, 10 г лактозы; рН 7,4-7,6; 4 мл 1% водного раствора генцианового фиолетового). Разливают в пробирки с поплавками. Инкубируют при 43°С 48 часов. При получении в средах газообразования и помутнения производят высев петлей на среду Эндо. Отбирают типичные для кишечной палочки колонии, делают мазки, окрашивают по Граму, микроскопируют. При выявлении в мазках Гр- палочек ставят пробу на оксидазу. Если проба отрицательная (изменение окраски на синий цвет) проверяют ферментативные свойства выделенной культуры посевом на полужидкую среду с глюкозой. Появление в среде кислоты и газа подтверждает наличие Е. coli.
Определение наличия Cl. perfringens
Для определения перфрингенс-титра различные разведения почвенной суспензии засевают в пробирки со стерильной железосульфитной средой Вильсон-Блера. Инкубация при 43°С 48 часов. Учитывают результаты по образованию черных колоний Cl. perfringens в агаровом столбике среды. Мазки окрашивают по Граму, микроскопируют (Гр+ крупные палочки со спорами овальной формы, центрального или субтерминального расположе-
ния), вычисляют перфрингенс-титр (наибольшее разведение посевного материала, по-
сев которого приводит к почернению и разрыву среды впервые 12 часов роста при
430 С).
14
к работе № 4
Микрофлора рук и предметов окружающей среды
Санитарный надзор за состоянием объектов общественного питания и пищеблоков в лечебных и детских учреждениях осуществляется взятием смывов с рук обслуживающего персонала, посуды, поверхности столов, досок и т. д.
При взятии смыва с рук пользуются стерильными ватными тампонами, которые перед употреблением смачивают в среде Кесслера, содержащейся в пробирке, в которой находится тампон. Смывы делают с обеих рук, тщательно протирая ладони, межпальцевые промежутки и подногтевые пространства сначала левой руки, а затем правой.
С исследуемых предметов стерильным ватным тампоном, увлажненным изотоническим раствором NaCl, делают смыв. Тампон помещают в среду Кесслера или втирают в поверхность среды Эндо. Для исследования гладких поверхностей и тканей смывы с делают с помощью трафаретов из проволоки, имеющих площадь 25 см2. Посевы выдерживают в термостате при температуре 43° С в течение суток. При наличии брожения в среде Кесслера делают высев на среду Эндо. Колонии, подозрительные на кишечную палочку, подвергают дальнейшей идентификации.
Микрофлора пищевых продуктов
Санитарно-микробиологическая оценка пищевых продуктов включает определение общего микробного числа и санитарно-показательных микроорганизмов, а также патогенных возбудителей.
Нормативы:
молоко и напитки - ОМЧ не более 75000 в 1 мл, коли-титр - не менее 3; мясо, колбасные изделия и мясные продукты - БГКП не должны содержаться в 1 г, сальмо-
неллы не должны содержаться в 25 г, протей - в 0,1 г, коагулазоположительные стафилококки - в 0,1 г, сульфитредуцирующие клостридии - в 0,1 г; в консервах не должен быть обнаружен ботулотоксин и клостридиум ботулинум.
Методика. Исследование молока. Для определения ОМЧ пастеризованное молоко разводят стерильным изотоническим раствором NaCl 1:10, 1:100, 1:1000 и по 1 мл разливают на дно стерильных чашек, заливают расплавленным, остуженным агаром. Инкубируют в термостате при 37°С в течение 24 часов. Подсчитывают количество выросших колоний.
Для определения коли-титра цельное пастеризованное молоко забирают в 6 пробирок со средой Кесслера: в 3 пробирки вносят по 1 мл, в остальные по 0,1 мл (разводят в 10 раз стерильной водой). Инкубируют при 43°С 24 часа. Из забродивших проб делают посевы на среду Эндо и идентифицируют БГКП. При обнаружении Гр- палочек ставят пробу на оксидазу и производят посев на среду с глюкозой и среду Козера (1л дистиллированной воды, 10 г фосфата однозамещенного калия, 0,2 г сульфата магния, 2,5-3,0 г цитрата натрия, 10 мл 0,5% спиртового раствора бромтимолового синего). При наличии кислоты и газа на среде с глюкозой и отсутствии роста на среде Козера, согласно ГОСТу 9225-68, учитывают только цитратонегативные разновидности кишечной палочки. Коли-титр вычисляют по справочной таблице.
Определение коли-титра в пастеризованном молоке, сливках, кефире и других молочных продуктах
|
Кишечная палочка обнаружена в объемах, мл |
|
Коли-титр, |
|||
|
|
|
|
|
|
мл |
1,0 |
1,0 |
1,0 |
0,1 |
0,1 |
0,1 |
|
- |
- |
- |
- |
- |
- |
Более 3,0 |
+ |
- |
- |
- |
- |
- |
3.0 |
|
|
|
15 |
|
|
|
+ |
+ |
- |
- |
- |
- |
Менее 3,0 |
+ |
+ |
+ |
- |
- |
- |
Более 0,3 |
+ |
+ |
+ |
+ |
- |
- |
0,3 |
+ |
+ |
+ |
+ |
+ |
- |
Менее 0,3 |
+ |
+ |
+ |
+ |
+ |
+ |
Менее 0,3 |
Исследование напитков определяют ОМЧ и коли-титр по методикам исследования питьевой воды. Лимонад нейтрализуют 10% раствором гидрокарбоната натрия (проверка рН лакмусовым индикатором). Коли-титр определяют методом мембранных фильтров.
Исследование мяса - определяют количество бактерий в мазках-отпечатках из кусочков 2x1,5x2,5 см. Окраска по Граму. Мясо свежее - если в поле зрения не более 10 бактериальных клеток.
Для определения ОМЧ, БГКП, сальмонелл, бактерий рода Протеус, коагулазоположительных стафилококков и клостридии из глубинных участков стерильно берут навески мяса 20 г и добавляют 80 мл стерильного физ. раствора, гомогенизируют в электрическом смесителе. 0,1 и 0,01 г продукта засевают на МПА, инкубируют 48 часов и подсчитывают количество колоний.
Определение БГКП в 1 г продукта. 5 мл взвеси засевают на среду Кода (питательный бульон, сульфанол, лактоза, бромтимоловый синий), инкубируют 18 часов. Лак+ БГКП меняют синий цвет среды на темно-зеленый или ярко-желтый.
Определение сальмонелл проводят посевом на среды Мюллера, Кауфмана или селенитовый бульон.
Протей выделяют по методу Шукевича, клостридии - на среде Вильсон-Блера, коагулазоположительные стафилококки на желточно-солевом агаре.
Исследование консервированных продуктов. Для выявления ботулинического токсина пробы консервов фильтруют и с фильтратом ставят реакцию нейтрализации токсина антитоксической противоботулинической сывороткой типов А,В,С,Е и F на белых мышах. В консервах не допускается присутствие ботулинического токсина,
Cl. botulinum, Cl. perfringens и других патогенных бактерий. Присутствие сапрофитных аэробных бацилл допустимо при герметичности и отсутствии бомбажа.
|
Микробиологические критерии доброкачественности |
||||
|
|
Количество продукта, в котором не допускается присут- |
|||
Вид продукта |
ОМЧ |
|
ствие бактерий |
|
|
|
(КОЕ/г(мл)) |
БГКП |
S. aureus |
Клостридии |
Патогенные |
|
|
|
|
|
(в том числе |
|
|
|
|
|
сальмонеллы) |
Молоко сырое |
3×105 |
- |
- |
- |
- |
Молоко пасте- |
5×104 |
1 см3 |
1 см3 |
- |
- |
ризованное |
|
|
|
|
|
Кисломолочные |
- |
- |
1 см3 |
- |
- |
напитки |
|
|
|
|
|
Мясо заморожен- |
1×104 |
0,01 г |
- |
- |
- |
ное |
|
|
|
|
|
Колбасные изде- |
1×103 |
1 г |
1 г |
0,01 г |
25,0 г |
лия вареные |
|
|
|
|
|
16
