
В. А. Миронова - Методические указания к выполнению лабораторных работ
.pdfПриложение 5
Термодинамические свойства некоторых простых веществ и химических соединений при стандартных условиях
Вещество |
Состоян |
H0298 |
S0298, |
Вещество |
Состоя |
H0298 |
S0298, |
|
ие |
кДж/моль |
Дж/моль К |
|
ние |
кДж/моль |
Дж/моль К |
|
|
|
|
|
|
||
Al |
К |
0 |
28,32 |
HI |
Г |
25,94 |
206,3 |
Al2O3 |
К |
-1675 |
50,94 |
H2S |
Г |
-20,9 |
205,7 |
AlCl3 |
К |
-697,4 |
167,2 |
I2 |
Г |
62,25 |
260,58 |
Br2 |
Ж |
0 |
152,3 |
KCl |
К |
-435 |
82,5 |
C |
Графит |
0 |
5,74 |
KClO3 |
К |
-391,2 |
143 |
C |
Алмаз |
1,897 |
2,38 |
Mg |
К |
0 |
32,55 |
CO |
Г |
-110,5 |
197,4 |
MgO |
К |
-601,24 |
26,94 |
CO2 |
Г |
-393,5 |
213,6 |
MgCl2 |
К |
-641,83 |
89,54 |
CH4 |
Г |
-74,85 |
186,2 |
MgCO3 |
К |
-1113 |
65,7 |
C2H2 |
Г |
226,75 |
200,8 |
Mn |
К |
0 |
31,7 |
C2H4 |
Г |
52,3 |
219,4 |
MnO |
К |
-384,93 |
60,25 |
C2H6 |
Г |
-84,68 |
229,5 |
MnCl2 |
К |
-482 |
117 |
CaO |
К |
-635,5 |
39,75 |
N2 |
Г |
0 |
191,5 |
Ca(OH)2 |
К |
-986,6 |
83,4 |
NO |
Г |
90,37 |
210,62 |
CaCO3 |
К |
-1207,1 |
92,88 |
NO2 |
Г |
33,89 |
240,45 |
Cl2 |
Г |
0 |
223 |
N2O4 |
Г |
9,37 |
304,3 |
Cu |
К |
0 |
33,3 |
NaCl |
К |
-410 |
72,2 |
CuCl |
К |
-134,5 |
91,5 |
NaHCO3 |
К |
-947,7 |
102,1 |
F2 |
Г |
0 |
202,7 |
Na2CO3 |
К |
-1130,9 |
136 |
Fe |
К |
0 |
27,55 |
O2 |
Г |
0 |
205,03 |
FeO |
К |
-263,68 |
58,19 |
O3 |
Г |
142,3 |
237,6 |
Fe2O3 |
К |
-821,32 |
89,96 |
Pb |
К |
0 |
64,81 |
Fe3O4 |
К |
-1117,7 |
146,4 |
PbO |
К |
-219,3 |
66,1 |
Fe(OH)2 |
К |
-561,7 |
88 |
PbSO4 |
К |
-920,6 |
148,6 |
Fe(OH)3 |
К |
-826,6 |
105 |
SO2 |
Г |
-296,9 |
248,8 |
H2 |
Г |
0 |
130,6 |
SO3 |
Г |
-395,3 |
256,2 |
H2O |
Г |
-241,84 |
188,74 |
Ti |
К |
0 |
30,3 |
H2O |
Ж |
-285,84 |
69,96 |
TiCl4 |
Ж |
-800 |
252 |
H2O |
К |
-291,85 |
39,33 |
Zn |
К |
0 |
41,6 |
H2O2 |
Г |
-136,1 |
232,9 |
ZnCl2 |
К |
-415 |
108 |
HCl |
Г |
-92,3 |
186,7 |
ZnO |
К |
-384 |
43,94 |
HF |
Г |
-268,81 |
173,81 |
|
|
|
|
Условные обозначения: к – кристаллическое, г – газообразное, ж - жидкое
71
|
|
|
Приложение 6 |
|
Энтальпии растворения некоторых солей при 20оС |
||||
|
|
|
|
|
Вещество |
Hраств. , |
Вещество |
|
Hраств. , |
|
кДж/моль |
|
|
кДж/моль |
Na2CO3(т) |
-23,31 |
Na2CO3 • 10H2O(т) |
|
+67,35 |
Na2SO4(т) |
-2,30 |
Na2SO4 • 10H2O(т) |
|
+78,54 |
CaCl2(т) |
-75,32 |
CaCl2 • 6H2O(т) |
|
+19,09 |
CuSO4(т) |
-66,53 |
CuSO4 • 5H2O(т) |
|
+11,93 |
ZnSO4(т) |
-77,16 |
ZnSO4 • 7H2O(т) |
|
+17,84 |
Na2HPO4(т) |
-23,61 |
Na2HPO4 • 12H2O(т) |
|
+95,58 |
Примечание: Значения энтальпий растворения относятся к растворению 1 моля вещества в 400 (в некоторых случаях и большем числе) молей воды. При дальнейшем разбавлении растворов значения энтальпий растворения практически существенно не изменяются.
72
Приложение 7
Порядок выполнения расчетной работы: «Определение термодинамических функций химической реакции»
1. Записать уравнение химической реакции и условия задания в соответствии с номером варианта (прил. 1).
аА + вВ ↔ сС + dD
Температура:_______
Масса (или объем):_______
2. Выписать значения Н0обр. и S0. для исходных реагентов и продуктов реакции (прил. 2):
Вещество |
Н0обр, кДж/моль |
S0, Дж/моль·K |
A |
|
|
|
|
|
B |
|
|
|
|
|
C |
|
|
|
|
|
D |
|
|
|
|
|
3. Применив следствие закона Гесса, рассчитать стандартное изменение энтальпии реакции
H 0 х.р (c H 0C d H 0 D ) (a H 0 A b H 0 B ).
4. Вычислить изменение энтропии реакции в стандартных условиях:
S 0 х.р (c S 0C d S 0 D ) (a S 0 A b S 0 B ).
5. Пользуясь соотношением GT Hх.р T Sх.р , вычислить изменение потенциала Гиббса при стандартной температуре 298 К.
6. Вычислить GТ при заданной температуре, полагая, что Н0 и S0 не зависят от температуры
GT Hх.р T Sх.р
7. Используя полученные значения G0298 и GT , рассчитать константу
химического равновесия (Kр) при 298 К и заданной температуре из уравнения:
GT 2,303 R T lg Кp
8. Определить температуру, при которой наступает состояние химического равновесия при GT = 0.
При химическом равновесии GT = 0, следовательно, | H 0 | = |T S 0 |.
Таким образом, T H .
p S
73
9. Рассчитать количество теплоты, поглощенной или выделенной в ходе
реакции на заданный объем (массу или количество) вещества:
H Qn ν ,
где Q – тепловой эффект реакции; n – стехиометрический коэффициент
(заданного вещества); ν – количество вещества, ν Mm , здесь m – заданная масса вещества, М – молярная масса вещества
или
ν V ,
Vm
где V – заданный объем газообразного вещества; Vm – молярный объем газа
(22,4 моль/л).
10. Сделать вывод, является ли рассматриваемая реакция самопроизвольной в прямом направлении. Проанализируйте влияние величины Hреак. , ΔSреак и изменения температуры на величину GT .
74
Приложение 8
Стандартные электродные потенциалы некоторых окислительно-восстановительных систем
Окисленная |
Восстановленная |
Уравнение реакции |
Е . В |
Форма |
Форма |
|
|
SO32 - |
S(тв) |
SO32 - + 4e- + 3H2O S + 6OH- |
-0,90 |
SO42 - |
SO32 - |
SO42 - +2e- +H2O SO32 - +2OH- |
-0,90 |
NO3- |
NO2(г) |
NO3- + e-+H2O NO2 + 2OH- |
-0,85 |
2H2O |
H2 + 2OH- |
2H2O +2e- H2 +2OH- |
-0,83 |
Fe(OH)3 |
Fe(OH)2 |
Fe(OH)3 + e- Fe(OH)2 + OH- |
0,56 |
S |
S2 - |
S +2e- S2 - |
-0,48 |
NO2- |
NH3 |
NO2- +6e- + 6H2O NH4OH +7OH- |
-0,16 |
NO3- |
NO |
NO3- + 3e- +2H2O NO + 4OH- |
-0,14 |
CrO42 - |
Cr(OH)3 |
CrO42 - +2e- +4H2O Cr(OH)2 +5OH- |
-0,12 |
2H+ |
H2 |
2H+ +2e- H2 |
0,00 |
NO3- |
NO2- |
NO3- +2e- +H2O NO2- +2OH- |
+0,01 |
S(n) |
H2S |
S +2e- + 2H+ H2S |
+0,14 |
Sn4 + |
Sn2 + |
Sn4 ++ 2e- Sn2 + |
+0,15 |
Co(OH)3 |
Co(OH)2 |
Co(OH)3 +e- Co(OH)2 +OH- |
+0,20 |
SO42 - |
SO32 - |
SO42 - +2e-+ 4H+ H2SO32 - + H2O |
+0,20 |
Ni(OH)3 |
Ni(OH)2 |
Ni(OH)3 +e- Ni(OH)2 +2OH- |
+0,51 |
ClO4- |
Cl- |
ClO4- + 8e- +4H2O Cl- + 8OH- |
+0,51 |
I2 |
2I- |
I2 + 2e- 2I- |
+0,53 |
MnO4- |
MnO42 - |
MnO4- + e- MnO42 - |
+0,54 |
MnO4- |
MnO2(тв) |
MnO4- +3e- +2H2O MnO2 + 4OH- |
+0,57 |
MnO42 - |
MnO2(тв) |
MnO42 -+ 2e- +2H2O MnO2 +4OH- |
+0,58 |
PbO2 |
Pb(тв) |
PbO2 +4e- +4H+ Pb +2H2O |
+0,68 |
O2 |
H2O2 |
O2 +2e-+2H= H2O2 |
+0,68 |
Fe3 + |
Fe2 + |
Fe3 + + e- Fe2 + |
+0,77 |
NO3- |
NO2(г) |
NO3- + e- +H+ NO2 +H2O |
+0,81 |
Br2((ж) |
2Br- |
Br2 + 2e- 2Br- |
+1,07 |
O2 +4H+ |
2H2O |
O2 + 4H+ + 4e- 2H2O |
+1,23 |
MnO2(тв) |
Mn2 + |
MnO2 + 2e- + 4H+ Mn2 + +2H2O |
+1,28 |
ClO4- |
Cl- |
ClO4- +2e- + 8H+ Cl- + 4H2O |
+1,34 |
75
Окисленная |
Восстановленная |
Уравнение реакции |
Е . В |
Форма |
Форма |
|
|
Cl2(г) |
2Cl- |
Cl2 + 2e- 2Cl- |
+1,36 |
Cr2O72 - |
2Cr3 + |
Cr2O72 - +6e- +14H+ 2Cr3 + + 7H2O |
+1,36 |
ClO3- |
Cl- |
ClO3- + 6e- +6H+ Cl- + H2O |
+1,45 |
PbO2(тв) |
Pb2 + |
PbO2 + 2e- +4H+ Pb2 + +2H2O |
+1,46 |
HClO |
Cl- |
HClO +2e- +H+ Cl- +H2O |
1,50 |
MnO4- |
Mn2 + |
MnO4- + 5e- +8H+ MnO + 4H2O |
+1,52 |
MnO4- |
MnO2(тв) |
MnO4- + 3e- + 4H+ MnO2 + 2H2O |
+1,67 |
H2O2 |
H2O |
H2O2 + 2e- + 2H+ 2H2O |
+1,77 |
S2O82 - |
SO42 - |
S2O82 - +2e- 2SO42 - |
+2,05 |
O3(г) |
O2(г) |
O3 +2e- +2H- O2 +H2O |
+2,85 |
F2(г) |
2F- |
F2 + 2e- 2F- |
+2,85 |
Обозначение: г- газ, ж – жидкость, тв – твердое вещество.
76
Приложение 9 Ряд стандартных электродных потенциалов металлов.
Электродный |
Е , В |
Электродный |
Е , В |
Электродный |
Е , В |
процесс |
|
процесс |
|
процесс |
|
|
|
|
|
|
|
Li =Li= + e- |
-3,045 |
Mn = Mn2 + +2e- |
-1,179 |
H2 = 2H+ +2e- |
0,000 |
K = K+ + e- |
-2,924 |
V = V2 + + 2e- |
-1,175 |
Ge = Ge2+ +2e- |
+0,050 |
Cs = Cs+ + e- |
-2,923 |
Zn = Zn2 + + 2e- |
-0,763 |
Sb = Sb3 ++ 3e- |
+0,150 |
Ba = Ba2 + + 2e- |
-2,905 |
Cr = Cr3 + + 3e- |
-0,744 |
Bi = Bi3 + + 3e- |
+0,215 |
Sr = Sr2 + + 2e- |
-2,888 |
Fe = Fe2 + + 2e- |
-0,440 |
Cu = Cu2 ++2e- |
+0,337 |
Ca = Ca2 + +2e- |
-2,866 |
Cd = Cd2 + +2e- |
-0,403 |
Ru = Ru2 + +2e- |
+0,450 |
Na = Na+ +e- |
-2,714 |
Co = Co2 + + 2e- |
-0,277 |
Ag = Ag+ +e- |
+0,799 |
Mg = Mg2 + + 2e- |
-2,363 |
Ni = Ni2 + +2e- |
-0,250 |
Hg = Hg2++ 2e- |
+0,850 |
Sc = Sc3 + + 3e- |
-2,077 |
Mo = Mo3 + + 3e- |
-0,200 |
Os = Os2 ++2e- |
+0,850 |
Be = Be2 ++ 2e- |
-1,847 |
Sn = Sn2 + 2e- |
-0,136 |
Pb=Pb2 ++2e- |
+0,987 |
Al = Al3 + + 3e- |
-1,663 |
Pb = Pb2 + + 2e- |
-0,126 |
Pt = Pt2 + +2e- |
+1,188 |
Ti = Ti2 + + 2e- |
-1,603 |
W = W3 + + 3e- |
-0.050 |
Au = Au3 + +3e- |
+1,498 |
77
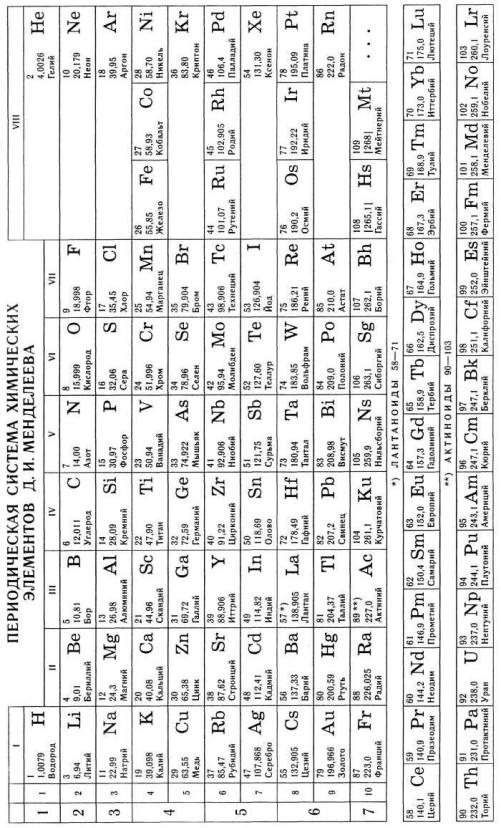
Приложение 10
78
