
В. А. Миронова - Методические указания к выполнению лабораторных работ
.pdfЛабораторная работа № 5
РАСТВОРЫ ЭЛЕКТРОЛИТОВ И ГИДРОЛИЗ СОЛЕЙ
Цель работы: изучить основные свойства растворов электролитов и особенности гидролиза солей.
ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Вещества, проводящие электрический ток, принято делить на проводники первого и второго рода. К проводникам первого рода относят металлы и полупроводники, в которых электропроводность осуществляется отрицательно заряженными частицами - электронами; к проводникам второго рода – электролиты.
Электролитами называются вещества (твердые и жидкие), содержащие положительно и отрицательно заряженные ионы, существующие независимо от внешних электрических и магнитных полей.
Следовательно, в проводниках второго рода электропроводность осуществляется за счет положительно и отрицательно заряженных ионов.
Образование ионов в электролитах происходит в результате диссоциации - распада ионных соединений и веществ с ковалентной полярной связью под действием температуры (плавление) или растворителя (растворение). Существуют твердые электролиты (например, оксид циркония ZrO2 с добавками CaO, V2O2), в которых под действием температуры происходит диссоциация связи металл — кислород, и ионы кислорода O-2 и металла Me+n обретают способность перемещаться в электрическом поле. К жидким электролитам относятся расплавы оксидов и солей и растворы солей, кислот и оснований. Несмотря на различные способы образования, все электролиты обладают рядом общих свойств.
Теория электролитической диссоциации (ТЭД).
Основы ТЭД заложил шведский физикохимик Сванте Аррениус (1887). Согласно ТЭД, при растворении в воде электролиты под действием полярных молекул воды распадаются на положительные ионы - катионы
(например, Ca2+, Na+., H+.) - и отрицательные ионы - анионы (например, OH-, SO32 -, SO42 -)
Количественно этот процесс характеризуется степенью диссоциации
:
=отношению числа распавшихся молекул к общему числу молекул электролита в растворе.
Величина изменяется от нуля до единицы. Степень диссоциации зависит от природы электролита, его концентрации в растворе и температуры. По степени диссоциации в растворе все электролиты можно условно разделить на две группы:
- сильные электролиты обладают степенью диссоциации 1, которая почти не зависит от концентрации раствора. К ним относятся
41
водные растворы большинства солей, щелочи III и растворы сильных кислот
HNO3, HCl и др.;
-у слабых электролитов < 1 и уменьшается с ростом концентрации.
Кним относятся вода, ряд слабых кислот, основания р-, d- и f- элементов.
Между этими двумя группами нет четкой границы. Одно и то же вещество, в зависимости от природы растворителя, может быть как сильным, так и слабым электролитом.
Процесс диссоциации одноосновной кислоты НСl можно выразить уравнением:
HCl H+. + Cl-.
Многоосновные кислоты, основания металлов, имеющих степень окисления +2 и выше, диссоциируют ступенчато. Например, диссоциация ортофосфорной кислоты происходит в три ступени:
H3PO4 H2PO4- + H+. - 1 ступень;
H2PO4- HPO42 - + H+. - 2 ступень;
HPO42 - PO43 - + H.+ - 3 ступень.
Суммарный процесс диссоциации ортофосфорной кислоты можно записать в виде уравнения:
H3PO4 3H. + PO43 -.
Как всякая химическая реакция, диссоциация является обратимым процессом, который при достижении равновесия можно охарактеризовать
константой диссоциации:
K |
[H ]3 |
[PO43 ] |
||
[H3 PO4 |
] |
|||
|
||||
В случае ступенчатой диссоциации каждая ступень имеет свою константу диссоциации. Например, для раствора ортофосфорной кислоты при температуре 25 °С:
K |
[H ][H |
PO |
] |
|
7,1 10 3 |
|||||||||
|
|
|
|
2 |
4 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||
1 |
|
|
|
|
|
[H3PO4 ] |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
K |
[H ][HPO2 ] |
1,9 10 6 |
||||||||||||
|
|
|
|
4 |
|
|
|
|
||||||
|
[H PO ] |
|
|
|
|
|||||||||
|
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
2 |
|
4 |
|
|
|
|
|
|
|
|
|
[H |
][PO3 |
] |
3,5 10 13 |
|||||||
K |
|
|
|
|
|
4 |
|
|||||||
3 |
|
[HPO2 ] |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
Константа диссоциации убывает с ростом номера ступени диссоциации потому, что с повышением отрицательного заряда кислотного остатка возрастает энергия, необходимая для отрыва от него положительно заряженного иона водорода. Константа диссоциации зависит от температуры и природы электролита, но, в отличие от степени диссоциации, не зависит от концентрации.
42
Ионное произведение воды. Химически чистая вода является слабым электролитом. Условно реакция диссоциации молекул воды записывается таким образом:
H2O H+ + OH-.
При температуре 22 °С концентрация ионов мала: [Н+] = [ОН-]= 10-7 моль/л, поэтому концентрацию недиссоциированных молекул воды можно считать постоянной величиной: [H2O] = const. Тогда постоянным будет и произведение ионов - ионное произведение воды
ПРводы:
ПРводы =[H+] [OH-] = 10-14
Водородный показатель. Соотношением концентраций ионов водорода и гидроксида характеризуется основность и кислотность раствора. Чистая вода, в которой концентрации ионов [Н+] и [ОН-] равны, считается
нейтральной |
средой. |
В |
кислых |
растворах |
[Н+] |
|
10-7моль/л, |
а [ОН-] |
10-7моль/л, |
в |
основных |
растворах |
[Н+] |
|
10-7 моль/л, |
а [ОН-] 10-7моль/л. Для удобства основность или кислотность водных сред принято количественно характеризовать водородным показателем рН - отрицательным десятичным логарифмом концентрации ионов водорода в растворе:
pH = - lg[H+].
Очевидно, что для чистой воды рН = 7, для кислых сред рН 7, а для основных рН > 7.
Задача. Вычислить рН 0,01 М раствора соляной кислоты Решение:
[H+] = CHCL =0,01 = 10-2 моль/л, pH = -lg[H+] = lg 10-2 = 2,
pH = 2
Гидролиз солей. Гидролизом называют процесс разложения водой веществ, составные части которых в этом процессе соединяются с составными частями воды. При гидролизе солей продукты их диссоциации (анионы Аn- и катионы Kt+) взаимодействуют с продуктами диссоциации воды с образованием слабого электролита-основания или кислоты по схеме:
An- +H2O =HAn +OH-; Kt+ + H2O = KtOH + H+.
Гидролизу подвергаются соли, образованные либо сильной кислотой и слабым основанием, либо сильным основанием и слабой кислотой, либо слабым основанием и слабой кислотой
Как и любой другой химический процесс, гидролиз можно представить в виде молекулярных и ионных уравнений
Гидролиз по катиону. Для примера рассмотрим гидролиз СuCl2 - соли, образованной сильной кислотой HCI и слабым многокислотным
43
основанием Сu(ОН)2. В обычных условиях гидролиз этой соли идет ступенчато. Гидролиз по катиону представляется молекулярным уравнением (первая ступень):
CuCl2 + H2O CuOHCl +HCl, pH 7;
в ионно-молекулярной форме:
Cu2 + + 2Cl- + H2O (CuOH)+ H+ + 2Cl- , pH 7.
Сокращенное ионно-молекулярное уравнение гидролиза имеет вид:
Cu2 + + H2O (CuOH)+ + H+, pH 7.
В растворе возникает избыток ионов водорода Н+, поэтому раствор CuCI2 - соли сильной кислоты и слабого основания - имеет кислую реакцию (рН 7).
Гидролиз по аниону. Рассмотрим гидролиз соли, образованной сильным основанием и слабой многоосновной кислотой, например Na2S. В обычных условиях реализуется только первая ступень гидролиза таких солей по аниону. Суммарное молекулярное уравнение этого процесса имеет вид:
Na2S + 2H2O NaHS +NaOH, pH 7,
или в ионно-молекулярной форме:
2Na+ +S2 - + H2O 2Na+ + HS- +OH-, pH 7.
Сокращенное ионно-молекулярное уравнение имеет вид:
S2 - +H2O HS- + OH-, pH 7.
В растворе Na2S появляется избыток ионов ОН-. Обобщая, можно заключить, что в результате гидролиза раствор соли сильного основания и слабой кислоты имеет щелочную реакцию (рН 7).
Рассмотрим теперь гидролиз соли, образованной слабым основанием и слабой кислотой, например (NH4)2S. Гидролиз таких солей часто протекает необратимо, т. е. сопровождается полным разложением соли.
Суммарное молекулярное уравнение гидролиза сульфида аммония
(NH4)2S:
(NH4)2S +2H2O 2NH4OH +H2S.
Ионно-молекулярное уравнение гидролиза:
2(NH4)+ + S2 - +2H2O 2NH4OH +H2S.
Реакция растворов солей, образованных слабой кислотой и слабым основанием, зависит от соотношения констант диссоциации кислоты и основания, образующих соль.
При составлении ионно-молекулярных уравнений гидролиза растворов солей необходимо помнить, что формулы веществ, выпадающих в осадок, газообразных, малодиссоциирующих, записывают в молекулярном, а не в ионном виде.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются, т. е. раствор такой соли имеет нейтральную
44
реакцию, рН = 7. Например, при растворении K2SO4 гидролиза не происходит:
K2SO4 +2H2O 2KOH + H2SO4;
2K+ +SO42 - + 2H2O 2K+ + 2OH- + 2H+ + SO42 –;
2H2O 2OH- + 2H+.
Ионы К+ и SO42 - остаются в растворе в виде гидратированных ионов. Слабых электролитов, веществ, выпадающих в осадок, и газообразных соединений в этом процессе не образуется.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Исследование электропроводимости растворов электролитов
Всухой стаканчик внесите немного хлорида натрия NaCl. Опустите в соль электроды для проверки электропроводности. Не прикасаясь к электродам, включите прибор в сеть. Проводит ли сухая соль электрический ток? Отключите прибор от сети. В другой стаканчик налейте 20-30 мл дистиллированной воды. Поместите в воду электроды прибора. Уберите руки
ивключите прибор в сеть. Проводит ли дистиллированная вода электрический ток? Внесите в стаканчик 5-6 микрошпателей соли NaCl. Что наблюдается? Запишите результаты опыта и объясните, почему сухая соль и дистиллированная вода не проводят электрический ток, а раствор соли – проводит.
Вчетыре стаканчика емкостью 50 мл налейте по 10 мл следующих веществ: в первый - 0,1 %-ный раствор соляной кислоты; во второй - 0,1%-ный раствор гидроксида натрия; в третий - концентрированную уксусную кислоту; в четвертый - концентрированный раствор гидроксида аммония. Определите электропроводность каждого из этих растворов, погружая в них электроды. После каждого испытания промывайте электроды
встаканчике с дистиллированной водой!
По степени накала лампочки сделайте вывод о силе исследованных кислот и основания.
Слейте вместе содержимое стаканчиков с уксусной кислотой и гидроксидом аммония и определите электропроводность этой смеси. Почему степень накала лампочки в этом случае отличается от ее накала при определении электропроводности уксусной кислоты и гидроксида аммония, взятых отдельно? Опишите наблюдаемые явления и сделайте выводы об их причинах.
Опыт 2. Понижение степени диссоциации слабого электролита
К разбавленному раствору уксусной кислоты СН3СООН (4-6 капель), окрашенному каплей метилового оранжевого в розовый цвет, прибавьте 3-4 микрошпателя ацетата натрия CH3COONa. Что происходит с окраской метилового оранжевого? Почему? На изменение концентрации
45
каких ионов указывает изменение окраски метилового оранжевого (прил. 4)? Напишите уравнение диссоциации кислоты при добавлении к ней ацетата натрия. Как изменяется при этом степень диссоциации СН3СООН и концентрация ионов Н+?
Опыт 3. Гидролиз солей. Определение рН раствора при помощи универсального индикатора
Приготовьте в трех пробирках растворы солей, указанных в таблице 5.1. Для этого в каждую пробирку налейте до 1/4 объема дистиллированной воды и добавьте по одному микрошпателю кристаллов солей.
|
|
|
|
|
Таблица 5.1 |
№ |
Формула |
Окраска |
Окраска |
PH растворы по |
Реакция |
п/п |
соли |
лакмуса |
фенол- |
универсальной |
среды: |
|
|
|
фталеина |
индикаторной бумаге |
кислая, |
|
|
|
|
|
щелочн., |
|
|
|
|
|
нейтр. |
1 |
NaCl |
|
|
|
|
2 |
Al2(SO4)2 |
|
|
|
|
3 |
Na2CO3 |
|
|
|
|
Поместите на индикаторную бумагу по 2 капли каждого раствора. Сравните окраску еще сырого пятна, полученного на бумаге, с цветовой шкалой. На последней указано, при каких значениях рН индикаторная бумага окрашивается в тот или иной цвет. Сделайте вывод о величине рН данного раствора и укажите реакцию среды.
Испытайте реакцию среды в каждой пробирке с помощью лакмуса и фенолфталеина. Результаты опыта занесите в табл. 5.1.
Напишите ионные и молекулярные уравнения реакции гидролиза указанных солей без учета ступенчатого гидролиза.
Опыт 4. Влияние температуры на степень гидролиза
Налейте в пробирку до половины ее объема дистиллированной воды и растворите в ней два микрошпателя ацетата натрия. Напишите ионное и молекулярное уравнения гидролиза этой соли. С помощью универсальной индикаторной бумаги определите рН среды. Добавьте в пробирку 2-3 капли фенолфталеина, при этом жидкость остается бесцветной, так как концентрация ионов гидроксида недостаточна для того, чтобы вызвать изменения окраски фенолфталеина. Осторожно нагрейте пробирку на спиртовке, не доводя содержимое до кипения. Что произошло? Объясните наблюдаемое явление. Какой вывод можно сделать? В каком направлении смещается направление гидролиза? Укажите причины влияния температуры на степень гидролиза
На основании данного опыта сделайте вывод о том, при каком температурном режиме необходимо хранить растворы солей, подверженных гидролизу.
46
Контрольные вопросы
1.Что называется раствором? Перечислите виды растворов.
2.Что называется электролитом? Какие виды электролитов вы знаете?
3.Что называется степенью электролитической диссоциации? От чего она зависит?
4.Как определяется константа диссоциации и от чего она зависит?
5.Что такое рН среды? Как ее можно определить экспериментально?
6.Что называется гидролизом соли? От чего зависит степень гидролиза? Что необходимо делать для понижения степени гидролиза солей?
7.Кислая или щелочная среда наблюдается при растворении в воде
следующих солей: Al(NO3)3, K2CO3, ZnSO4, Li2S? Ответ подтвердите соответствующими молекулярными и ионно-молекулярными уравнениями.
8.При сливании растворов CrCl3 и Nа2СОз образуется осадок. Объясните причину и напишите соответствующие уравнения в молекулярном и ионно-молекулярном виде.
Литература
1.Коровин, Н. В. Общая химия. С. 204-250
2.Фролов, В. В. Химия. С. 176-216
47

Лабораторная работа №6 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Цель работы: экспериментально ознакомиться с принципом построения ряда активности металлов, работой гальванического элемента и процессом электролиза.
Теоретические сведения
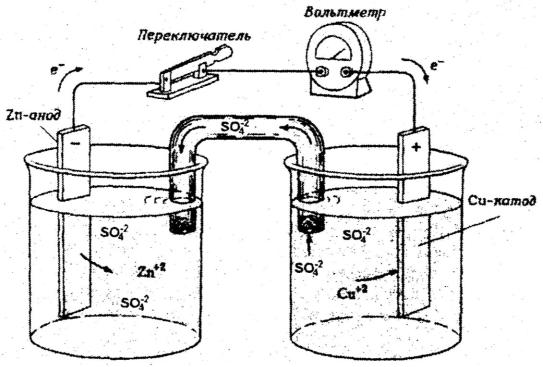
Электрохимическими называются процессы, связанные с взаимным превращением электрической и химической энергий. Преобразование энергии химической (окислительно-восстановительной) реакции в электрическую осуществляется в гальванических элементах. Если взять два металла с различными электродными потенциалами, соединить их проводом, опустить в растворы их солей, соединенных между собой электролитическим ключом, то получится гальванический элемент (рис. 6.1).
Интенсивность реакции окисления-восстановления, протекающей в гальваническом элементе, характеризуется величиной разности потенциалов -
электродвижущей силой гальванического элемента (ЭДС).
Электрод, на котором происходит процесс окисления, называется анодом, а электрод, на котором происходит процесс восстановления, называется катодом.
Электродный потенциал металла определяется процессом перехода ионов металла в раствор (окисление) и обратным процессом присоединения ионами металла электронов (восстановление), т.е. окислительновосстановительным равновесием:
Me0 Men + +ne-.
ЭДС гальванического элемента можно Нернста:
E E0 RTnF ln
вычислить по уравнению
C1
C2
где E - ЭДС гальванического элемента; E0 - стандартная ЭДС; R - универсальная газовая постоянная, равная 8,316 Дж/(моль·К); Т - температура, К; п — число электронов, переносимых в окислительновосстановительной реакции; F- постоянная (число Фарадея), равная 96500 К; C1 и C2 - концентрации ионов соответствующих металлов в растворе. Стандартную ЭДС гальванического элемента можно подсчитать, если из стандартного электродного потенциала катода вычесть стандартный электродный потенциал анода:
E0 = E0катода - E0 анода
Стандартным электродным потенциалом Е° называется потенциал растворения металла, погруженного в раствор собственного иона с концентрацией (или активностью), равной единице (г•ион/л). Измерение Е°
48
производится по сравнению с нормальным водородным электродом, потенциал которого условно принят равным нулю (приложение 7).
Рис.6.1 Схема гальванического элемента Даниэля-Якоби
Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получим электрохимический ряд стандартных электродных потенциалов металлов (прил. 8). В этот ряд всегда помещается водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот. Положение того или иного металла в ряду напряжения и характеризует его способность к окислительновосстановительным взаимодействиям в водных растворах при стандартных условиях.
Величина ЭДС работающего гальванического элемента всегда меньше, чем рассчитанная по формуле Нернста, вследствие поляризации электродов (изменения их потенциалов при работе гальванического элемента). Наибольшее значение при работе гальванических элементов имеет катодная поляризация, возникающая за счет накопления избыточных электронов на катоде, после чего его потенциал становится более отрицательным. Разность между фактическим потенциалом катода и теоретическим электродным потенциалом называется перенапряжением на катоде. Величина перенапряжения зависит от материала катода, состояния его поверхности, температуры и плотности тока.
Точное измерение ЭДС гальванического элемента требует применения специальных приборов, обеспечивающих протекание через гальванический элемент ничтожно малого тока. Если допустить протекание значительного тока, то напряжение гальванического элемента понижается, так как он
49
обладает внутренним сопротивлением. Кроме того, вокруг электродов происходит изменение концентрации ионов в растворе.
Экспериментально установлено, что ЭДС гальванического элемента зависит не от размера и формы твердых электродов, а от концентрации ионов. Если концентрации реагентов повышаются относительно концентраций продуктов, то это приводит к повышению степени самопроизвольности протекающей в гальваническом элементе реакции и возрастанию его ЭДС и наоборот. Во время работы гальванического элемента происходит расходование реагентов и образование продуктов. Связанное с этим уменьшение концентраций реагентов и возрастание концентраций продуктов вызывает постепенное уменьшение ЭДС элемента.
Если систему, состоящую из двух электродов и раствора или расплава электролита, включить в цепь постоянного тока, то у электродов начинают протекать реакции окисления-восстановления: у анода восстановитель отдает электроны (в сеть) и окисляется; у катода окислитель присоединяет электроны (из сети) и восстанавливается.
Процесс окисления-восстановления, который осуществляется под действием постоянного электрического тока, называется электролизом. Химические реакции, протекающие при электролизе, зависят от растворенного электролита, растворителя и материала электродов. Химические превращения за счет внешней электрической энергии, осуществляются в электролизерах.
Различают электролиз с инертными и активными анодами. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза (платина, иридий, графит, уголь, в определенных условиях - железо, никель, золото, свинец, алюминий и др.), а активным - анод, материал которого может окисляться в ходе электролиза.
Какие электрохимические процессы будут протекать у электродов, прежде всего зависит от соотношения электродных потенциалов соответствующих электрохимических систем (прил. 7 и 8)
На катоде восстанавливаются электрохимические системы, имеющие наибольшее значение электродного потенциала, а на аноде окисляются электрохимические системы с наименьшим электродным потенциалом.
50
