
- •Мпс россии
- •1. Введение
- •2. Физические основы механики
- •Основные механические модели
- •1. Материальная точка.
- •2. Абсолютно твердое тело.
- •2.1. Кинематика материальной точки
- •Основные кинематические уравнения равнопеременного движения:
- •Движение материальной точки по окружности. Угловая скорость и угловое ускорение и их связь с линейными характеристиками движения
- •Для характеристики изменения вектора скорости на величину δv введем ускорение :
- •Угловая скорость и угловое ускорение
- •2.2. Динамика материальной точки и поступательного движения твердого тела
- •Взаимодействие тел. Второй закон Ньютона. Сила. Масса. Импульс. Центр масс
- •2.3. Законы сохранения в механике
- •Момент силы. Момент импульса. Закон сохранения момента импульса
- •Энергия. Работа. Мощность
- •Консервативные и неконсервативные силы
- •Закон сохранения энергии
- •2.4. Принцип относительности в механике
- •2.5. Элементы релятивистской динамики (специальной теории относительности)
- •2.6. Элементы механики твердого тела
- •2.7. Элементы механики сплошных сред
- •Упругое тело. Деформация. Закон Гука
- •3. Электричество и магнетизм
- •3.1. Электростатика
- •Закон Кулона
- •Электрическое поле
- •Принцип суперпозиции электрических полей
- •Поток вектора напряженности электрического поля
- •Теорема Остроградского – Гаусса и ее применение к расчету полей
- •Поле равномерного заряженной бесконечной прямолинейной нити
- •Поле равномерно заряженной плоскости
- •Работа сил электростатического поля при перемещении заряда. Потенциал
- •Связь между напряженностью и потенциалом электростатического поля
- •Идеальный проводник в электростатическом поле
- •Электроемкость уединенного проводника конденсатора
- •Энергия заряженного проводника
- •Энергия электрического поля. Объемная плотность энергии
- •3.2. Постоянный электрический ток
- •Закон Ома
- •Дифференциальная форма закона Ома
- •Закон Джоуля-Ленца
- •Закон Джоуля-Ленца в дифференциальной форме.
- •Правила Кирхгофа для разветвленных цепей.
- •3.3. Магнитное поле
- •Момент сил, действующих на виток с током в магнитном поле
- •Принцип суперпозиции магнитных полей
- •Закон Био-Савара-Лапласа и его применение к расчету магнитных полей
- •Взаимодействие параллельных токов
- •Контур с током в магнитном поле. Магнитный поток
- •Работа перемещения проводника и контура с током в магнитном поле
- •Явление электромагнитной индукции. Закон Фарадея
- •Явление самоиндукции
- •Токи замыкания и размыкания в цепи
- •Явление взаимоиндукции
- •Энергия магнитного поля
- •3.4. Статические поля в веществе Диэлектрики в электрическом поле
- •Магнитные свойства вещества
- •3.5. Уравнения Максвелла
- •Электромагнитные волны
- •3.6. Принцип относительности в электродинамике
- •3.7. Квазистационарное магнитное поле
- •4. Физика колебаний и волн
- •4.1. Кинематика гармонических колебаний
- •Сложение гармонических колебаний
- •4.2. Гармонический осциллятор
- •Свободные затихающие колебания
- •Логарифмический декремент затухания
- •4.3. Ангармонические колебания
- •4.4. Волновые процессы
- •4.5. Интерференция волн
- •Интерференция от двух когерентных источников
- •Стоячие волны
- •Интерференция в тонких пленках
- •4.6. Дифракция волн
- •Принцип Гюйгенса-Френеля
- •Дифракция Фраунгофера от одной щели
- •Дифракция от многих щелей. Дифракционная решетка.
- •4.7. Поляризация света
- •Поляризация при отражении света от диэлектрика
- •Двойное лучепреломление в анизотропных кристаллах
- •Закон Малюса
- •Степень поляризации
- •Вращение плоскости поляризации
- •4.8. Взаимодействие электромагнитных волн с веществом
- •5. Квантовая физика
- •5.1. Экспериментальное обоснование основных идей квантовой механики. Взаимодействие фотонов с электронами
- •Внешний фотоэффект
- •Эффект Комптона
- •Давление света
- •5.2. Корпускулярно – волновой дуализм
- •Соотношение неопределенностей
- •5.3. Квантовые состояния и уравнение Шредингера
- •5.4. Атом
- •Теория Бора для водородоподобных атомов.
- •5.5 Многоэлектронные атомы
- •5.6. Молекулы
- •5.7. Электроны в кристаллах
- •5.8. Элементы квантовой электроники
- •5.9. Атомное ядро
- •Радиоактивность. Закон радиоактивного распада
- •Закономерности α и β - распада
- •Ядерные реакции. Законы сохранения в ядерных реакциях
- •Реакция деления ядра. Цепная реакция. Ядерный реактор
- •Реакции синтеза. Термоядерные реакции
- •Элементарные частицы
- •6. Статистическая физика и термодинамика
- •6.1. Элементы молекулярно-кинетической теории
- •Модель идеального газа
- •Число степеней свободы молекул
- •Среднее число столкновений и средняя свободного пробега молекул
- •Явления переноса
- •Электрический ток в вакууме. Термоэлектронная эмиссия
- •Электрический ток в газах
- •6.2. Основы термодинамики Внутренняя энергия идеального газа. Работа
- •Внутренняя энергия идеального газа
- •Первый закон термодинамики
- •Изопроцессы
- •Термодинамические процессы, циклы
- •Круговые процессы. Второе начало термодинамики.
- •Цикл Карно
- •Фазовые превращения
- •Реальные газы. Уравнение Ван – дер – Ваальса
- •6.3. Функции распределения. Закон Максвелла для распределения молекул по скоростям
- •Барометрическая формула (распределение Больцмана)
- •Порядок и беспорядок в природе. Синергетика
- •Магнетики в тепловом равновесии. Ферромагнетизм
- •7. Заключение Современная физическая картина мира
6.2. Основы термодинамики Внутренняя энергия идеального газа. Работа
Термодинамика в отличие от молекулярно-кинетической теории, изучает физические свойства макроскопических тел (термодинамических систем), не вникая в их молекулярное строение. Термодинамический метод базируется на законе сохранения и превращении энергии.
Физические величины, характеризующие термодинамическую систему, называются термодинамическими параметрами. К ним относятся: объем, давление, температура, концентрация и др. Любое изменение в термодинамической системе, связанное с изменением ее параметров, называетсятермодинамическим процессом, а уравнение, связывающее между собой параметры системы, называетсяуравнением состояния. Примером такого уравнения является уравнение Менделеева - Клапейрона (6.1)
Внутренняя энергия идеального газа
Важнейшей характеристикой термодинамической системы является ее внутренняяэнергияU, складывающая из потенциальной энергии взаимодействия частиц системы и кинетической энергии их теплового движения.
Внутренняя энергия является функцией состояния системы, т.е. в каждом состоянии система обладает вполне определенным значением внутренней энергии, не зависящим от того, каким путем система перешла в это состояние.
Так как в
идеальном газе потенциальная энергия
молекул равна нулю (считается, что
молекулы между собой не взаимодействуют),
то внутренняя энергия идеального газа
равна полной кинетической энергии всех
его молекул. Обозначив внутреннюю
энергию одного моля газа через Uμ,
а среднюю кинетическую энергию молекулы
через![]() ,
можем записать для одного моля газа:
,
можем записать для одного моля газа:
Uμ
= NA![]() (6.18)
(6.18)
где NA– число Авогадро.
Подставляя
значение
![]() из формулы (6.12), получим внутреннюю
энергию для одного моля газа:
из формулы (6.12), получим внутреннюю
энергию для одного моля газа:
![]() (6.19)
(6.19)
Если число молей
![]() ,
то для любого количества вещества
,
то для любого количества вещества
![]() (6.20)
(6.20)
Следовательно, внутренняя энергия газа пропорциональна его массе, числу степеней свободы молекулы и абсолютной температуре газа.
Первый закон термодинамики
Внутреннюю энергию термодинамической системы можно изменить за счет работы, которую либо внешние тела совершают над ней, либо сама система совершает над внешними телами. Например, приложив внешнюю силу, мы сжимаем газ, в результате чего его температура повышается, а, следовательно, увеличивается и внутренняя энергия. Внутреннюю энергию можно изменить также, передавая системе (или отнимая у нее) некоторое количество теплоты.
Согласно закону сохранения энергии, изменение внутренней энергии системы должно равняться сумме полученной ею теплоты и совершенной над ней работы. Эта формулировка закона сохранения энергии применительно к термодинамическим системам носит названиепервого закона термодинамики:
ΔU = Q – A
или
Q = ΔU + A (6.21)
Условимся считать, что теплота положительна Q>0 тогда, когда она сообщается системе, а работа положительна, когда система совершает ее над внешними телами.
В дифференциальной форме первый закон термодинамики имеет вид:
dQ=dU+dA
Необходимо
подчеркнуть, что в отличие от внутренней
энергии, являющейся функцией состояния,
работа и количество теплоты зависят не
только от начального и конечного
состояний системы, но и от пути, по
которому происходило изменение ее
состояния. Следовательно, величины dQиdА не являются полными
дифференциалами, по которым может
производиться интегрирование. Для того,
чтобы подчеркнуть это обстоятельство
для бесконечно малых приращений тепла
и работы применяют более корректное
обозначение
![]() Qи
Qи
![]() Aи тогда первый закон примет вид:
Aи тогда первый закон примет вид:
![]() Q=dU+
Q=dU+
![]() A(6.22)
A(6.22)
Найдем в общем виде работу, совершаемую газом, (рис.6.6, а). Если газ, расширяясь, перемещает поршень на расстояние dx, то он производит работу (см. формулу 2.19):
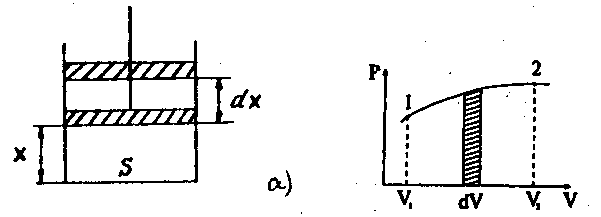
Рис.6.6
![]() A
= F · dx = P · S · dx = PdV,
(6.22)
A
= F · dx = P · S · dx = PdV,
(6.22)
где S– площадь поршня;Sdx=dV– изменение объема газа в цилиндре.
Полная работа, совершаемая газом при изменении его объема от V1доV2, равна:
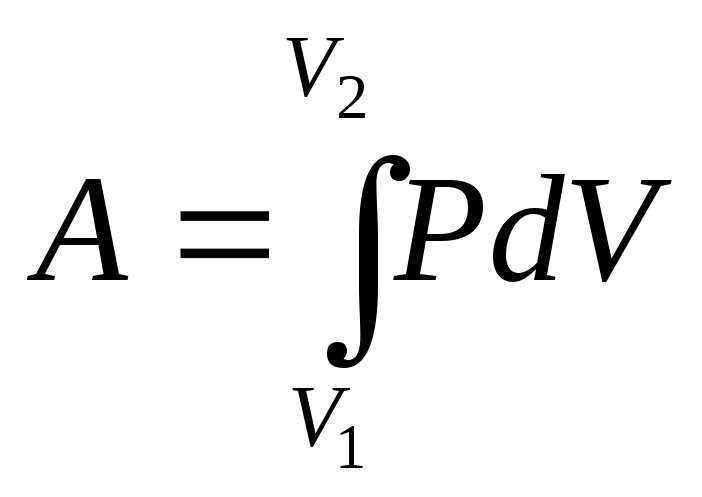 или
или (6.23)
(6.23)
Графически процесс изменения состояния газа при его расширении изображается участком кривой 1-2 в координатах Р – V(рис.6.6, б). Точки 1 и 2 соответствуют начальному и конечному состояниям газа. Элементарная работаPdVизображается заштрихованной площадью. Полная работа, определяемая формулой 6.23, изображается площадьюV1– 1 – 2 -V2под кривой 1 – 2.
Теплоемкость идеальных газов.
Количество тепла, которое надо сообщить телу, чтобы изменить его температуру на 1 К, называется теплоемкостьютела С.
Согласно этому определению
![]() ,
[С] = Дж/К
(6.24)
,
[С] = Дж/К
(6.24)
Теплоемкость единицы массы вещества называется удельной теплоемкостью Суд
![]()
![]() (6.25)
(6.25)
Теплоемкость одного моля называется молярной теплоемкостьюСм.
![]() ,
[См] = Дж/моль · К
(6.26)
,
[См] = Дж/моль · К
(6.26)
где ν = m/μ– число молей.
Как следует из формул (6.25) и (6.26), удельная теплоемкость связана с молярной соотношением:
См= Суд· μ (6.27)
Теплоемкость газа зависит от того, при каких условиях она определяется: при постоянном объеме или постоянном давлении. Покажем это, для чего запишем первый закон термодинамики с учетом формулы (6.22):
δQ = dU + PdV (6.28)
Если газ нагревается при постоянном объеме (изохорный процесс), то dV=0 и работа РdV= 0. В этом случае δQ=dU, т.е. передаваемое газу тепло идет только на изменение его внутренней энергии. Теплоемкость газа при постоянном объеме:
![]()
С учетом формулы (6.20)
![]() (6.29)
(6.29)
и тогда изохорная теплоемкость
![]() (6.30)
(6.30)
Для одного моля (m/µ = 1) молярная теплоемкость при постоянном объеме
![]() (6.31)
(6.31)
Теперь, с учетом равенства (6.28), найдем теплоемкость при постоянном давлении (изобарный процесс):
![]() (6.32)
(6.32)
(при этом учли, что dU/dT=CV). Из (6.32) следует, что СP>CV. Это объясняется тем, что при нагревании приP=constсообщенное газу тепло идет не только на увеличение его внутренней энергии, но и на совершение работы.
Для одного моляидеального газа уравнение Менделеева – Клапейрона имеет видPV=RTи потокуPdV=RdT. Учитывая это, получимуравнение Майера, выражающее связь междумолярнымитеплоемкостями при постоянном давлении и постоянном объеме:
Смр= Сmv+R(6.33)
Учитывая выражение (6.31) можно записать в виде
![]() (6.34)
(6.34)
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение СPк СV:
![]() (6.35)
(6.35)
Величина γ называется коэффициентом Пуассона,i– число степеней свободы молекул (см. рис.6.2).
Повышение температуры приводит, как отмечалось выше, к появлению колебательных степеней свободы, в результате чего теплоемкость возрастает. Наоборот, при низких температурах число степеней свободы уменьшается, так как «вымораживаются» вращательные степени свободы и теплоемкость газа уменьшается.
