
лабораторная эквивалент
.docЛабораторная работа № 1
Определение молярной массы эквивалента неизвестного металла
Закон эквивалентов: элементы соединяются друг с другом или замещают друг друга в химических реакциях в эквивалентных количествах:
Химическим эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает такое же количество водорода в соединениях. Масса одного моля эквивалента элемента или сложного вещества называется молярной массой эквивалента (Мэ) или эквивалентной массой (г/моль)
Молярная масса эквивалента элемента связана с его атомной массой (А) и валентностью соотношением:
![]()
Например, в оксидах N2O, NO2, N2O5 эквивалентная масса кислорода равна Мэ(О) = 16/2 = 8 г/моль, а эквивалентные массы азота соответственно равны: 14/1 = 14 г/моль, 14/4 = 3,5 г/моль, 14/5 = 2,8 г/моль.
Молярные массы эквивалентов сложных веществ вычисляют по формулам:
![]()
![]()
![]()
![]()
Если же приведены уравнения реакций, в которые вступают эти соединения, то в этом случае эквивалентная масса равна:
- кислоты равна ее молярной массе, деленной на число атомов водорода, участвующих в реакции, т.е. замещенных на катионы;
- основания равна его молярной массе, деленной на число гидроксильных групп, участвующих в реакции, т.е. замещаемых на кислотные остатки;
- соли равна ее молярной массе, деленной на число эквивалентов вещества реагирующих с 1 моль этой соли.
Примеры:
NaOH + 3H3PO4 = Na3PO4 + 3H2O, МЭ(H3PO4) = M/3;
KOH + H3PO4 = KH2PO4 + H2O, МЭ(H3PO4) = M/1;
Al(OH)3 + 2HNO3 = AlOH(NO3)2 + 2H2O, МЭ(Al(OH)3) = M/2;
Na2CO3 + HCl = NaHCO3 + NaCl, МЭ(Na2CO3) = M/1;
Na2CO3 + 2HCl = CO2 + 2NaCl + H2O, МЭ(Na2CO3) = M/2.
В общем случае эквивалентная масса сложного вещества равна сумме эквивалентных масс его составных частей. Например, МЭ (MgO) = МЭ (Мg) + МЭ (О) = 24/2 + 16/2 = 20 г/моль.
Для газообразных веществ используется также понятие эквивалентного объема (Vэ), который находят по формуле:
![]()
Например, молярный эквивалентный объем газообразного кислорода равен:
Vэ(О2)=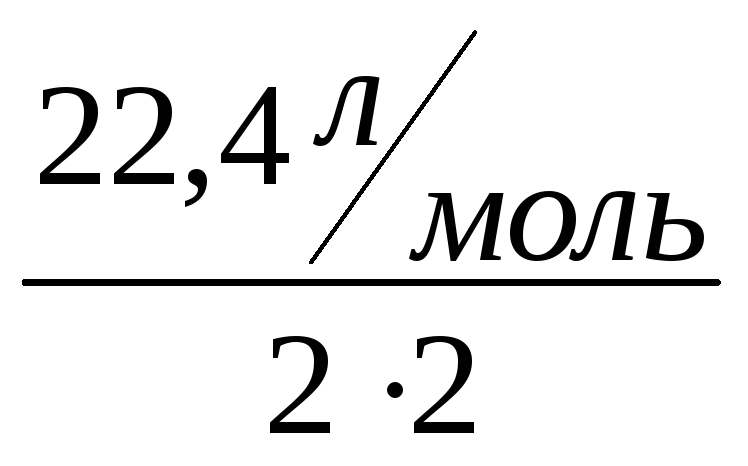 =5,6
л/моль,
=5,6
л/моль,
а
эквивалентный объем водорода Vэ(Н2)=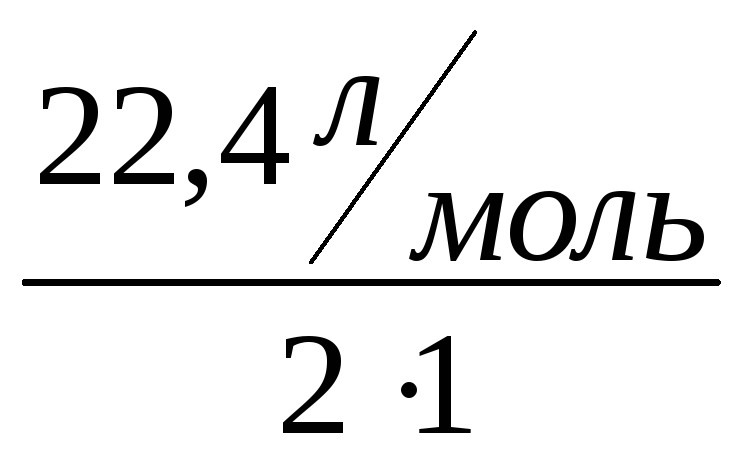 =11,2
л/моль.
=11,2
л/моль.
Практическая часть. Определение природы двухвалентного металла
Метод основан на реакции растворения металла в избытке кислоты и измерении объема выделившегося водорода. По объему водорода, применяя закон эквивалентов, вычисляют молярную массу эквивалента металла. Для проведения опыта в настоящей работе используется прибор, состоящий из бюретки и уравнительного сосуда, сообщающихся друг с другом посредством резиновой трубки. К верхнему концу бюретки с помощью трубки и пробки присоединяют двухколенную пробирку с исследуемым металлом. Уравнительный сосуд и бюретка наполнены водой.
Для проведения опыта в одно колено пробирки наливают через воронку 2-3 мл 2 н соляной кислоты. Капли кислоты не должны попадать на стенки второго колена пробирки. Навеску металла помещают во второе колено пробирки. Перемещая уравнительную склянку в вертикальном направлении, устанавливают уровень воды в бюретке вблизи нулевого деления, но не выше нуля. Пробирку с кислотой и металлом плотно присоединяют к прибору и проверяют систему на герметичность. Для этого опускают уравнительный сосуд так, чтобы уровень воды в нем был ниже уровня воды в бюретке, и в таком положении укрепляют его. При опускании уравнительного сосуда уровень воды в бюретке несколько понизится. Если через 1-2 минуты дальнейшего понижения не будет, прибор можно считать герметичным.
После испытания прибора на герметичность записывают показание бюретки. Затем наклоняют пробирку и металл попадает в кислоту. Тотчас начинается выделение водорода, и вода вытесняется из бюретки в уравнительный сосуд. По окончании реакции следует подождать 5-10 минут, чтобы газ в бюретке и пробирке принял температуру окружающего воздуха и записать новое показание бюретки. Экспериментальные данные записывают по форме:
-
Масса металла m,г
Показание бюретки до проведения реакции V1, мл
Показание бюретки после проведения реакции V2, мл
Объем выделившегося водорода V(Н2) = V2 – V1, мл
Температура опыта t,oC
Температура опыта T=t+273, K
Температура при нормальных условиях Т0, К
273
Универсальная газовая постоянная R, кДж/(моль.К)
8,31
Давление при нормальных условиях Р0, кПа
101,325
Давление насыщенного пара воды РН2О при температуре опыта (находят по таблице), Па
Атмосферное давление р, Па
Парциальное давление водорода РН2 = Р – РН2О, Па
Расчет молярной массы металла по экспериментальным данным
1 способ. по формуле объединенного закона Бойля-Мариотта и Гей-Люссака приводят объем выделившегося водорода к нормальным условиям:
![]() или
или
![]()
Далее по закону эквивалентов вычисляют значение молярной массы эквивалента металла. Так как реакция протекает с участием газообразного вещества, то используют следующую форму записи закона эквивалентов:
![]() или
или
![]()
Зная валентность металла, находят молярную массу металла:
![]()
По таблице Д.И. Менделеева определяют природу металла, находят табличное (теоретическое) значение его молярной массы и вычисляют относительную погрешность эксперимента:
![]()
2 способ. По уравнению Менделеева-Клайперона находят массу выделившегося водорода:
![]()
![]() или
или
![]()
По закону эквивалентов вычисляют значение молярной массы эквивалента металла:
![]() или
или
![]()
Дальнейшие вычисления проводят как в способе 1.
Таблица. Давление насыщенного водяного пара в зависимости от температуры
|
t,oC |
P(Н2О), кПа |
t,oC |
P(Н2О), кПа |
|
15 |
1,71 |
20 |
2,34 |
|
16 |
1,82 |
21 |
2,49 |
|
17 |
1,94 |
22 |
2,64 |
|
18 |
2,06 |
23 |
2,81 |
|
19 |
2,20 |
24 |
2,98 |
Примеры вычислений с использованием закона эквивалентов
Пример 1. При сжигании 2,28 г металла было получено 3,78 г его оксида. Определить молярную массу эквивалента металла.
Решение
Сначала находим массу кислорода, пошедшего на окисление металла: m(O2)=3,78 - 2,28 = 1,5 г. Далее по закону эквивалентов находим молярную массу эквивалента металла:
![]() ,
,
![]()
![]()
Пример 2. Вычислить молярную массу эквивалента металла, если установлено химическим анализом, что сульфид металла содержит 67,15% металла (по массе), а эквивалент серы равен 16.
Решение
67,15 массовой части металла соединяются с 32,85 части массы серы, а эквивалент металла соединяется с эквивалентом серы (закон эквивалентов). Отсюда
![]()
Пример 3. При взаимодействии 5 г металла с кислотой выделилось 2,8 л водорода (н.у.). Вычислить молярную массу эквивалента металла.
Решение
Так как реакция протекает с участием газообразного вещества, то используют следующую формулу:
![]()
Пример 4. Определить молярную массу эквивалента серной кислоты в следующих химических реакциях:
NaOH + H2SO4 = NaHSO4 + H2O (1)
PbCl2 + H2SO4 = PbSO4 + 2HCl (2)
Решение
В реакции (1) эквивалент NaOH численно равен его молярной массе, следовательно, по закону эквивалентов эквивалент NaOH взаимодействует с эквивалентом H2SO4 и эквивалент H2SO4 равен его молярной массе (98 г/моль).
В реакции (2) эквивалент PbCl2 равен М/2, следовательно, и эквивалент серной кислоты будет равен М/2 = 49 г/моль.
Задачи
-
1,96 г металла вытесняют из раствора кислоты 0,672 л водорода (н.у.). Вычислить молярную массу эквивалента металла.
-
Вычислить молярную массу эквивалента элемента, 1,2 г которого вытесняют из раствора кислоты при 20оС и 101,3 кПа 442 мл водорода.
-
Определить молярную массу эквивалента хлорида никеля, если 1,621 г хлорида взаимодействует без остатка с 1 г гидроксида натрия, молярная масса эквивалента которого равна 40.
-
На нейтрализацию 1 г кислоты израсходовано 0,313 г гидроксида натрия. Вычислить молярную массу эквивалента кислоты.
-
На восстановление 6,33 г оксида металла израсходовано 0,636 л водорода (н.у.) Определить молярную массу эквивалента металла.
-
Вычислить молярную массу эквивалента карбоната калия в следующих реакциях:
а) K2CO3 + HI → KHCO3 + KI; в)K2CO3 + 2HI → H2CO3 + 2KI
-
Какое количество водорода выделится в результате взаимодействия 9 г алюминия с избытком соляной кислоты?
-
Какая масса оксида получится при окислении 9 г алюминия?
-
Молярная масса эквивалента оксида равна 28 г/моль. Вычислите молярную массу эквивалента металла.
-
Вычислите эквивалент фосфорной кислоты при реакциях обмена, в результате которых образуются кислые и нормальные соли.
-
Исходя из молекулярных масс HNO3, H2SO4, HCl, Na2B4O7*10H2O, KOH, Ba(OH)2, BaSO4, FeSO4*7H2O, Na2CO3*10H2O вычислите их молярные массы эквивалентов.
-
Для нейтрализации щавелевой кислоты гидроксидом калия на 1,244 г кислоты потребовался 1 г КОН, молярная масса эквивалента которого 56 г/моль. Вычислить молярную массу эквивалента кислоты.
