
- •Міністерство освіти і науки, молоді та спорту україни
- •Загальні правила роботи в хімічній лабораторії
- •Навчальна програма для контролю знань студентів інженерно-технічного та фізичного факультетів з дисципліни "Загальна хімія"
- •Тематика лабораторних робіт:
- •Теми колоквіумів:
- •1. Атомно-молекулярне вчення стехіометричні закони та основні хімічні поняття
- •Лабораторна робота № 1
- •2. Енергетика хімічних процесів. Хімічна кінетика і рівновага
- •Лабораторна робота №2:
- •3. Розчини електролітів т неелектролітів. Гідроліз
- •Лабораторна робота № 3
- •4. Основи електрохімії. Окисно-відновні реакції
- •1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
- •2. Під час електролізу однакова кількість електрики виділяє на електродах еквівалентну кількість різних речовин.
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Лабораторна робота № 4
- •Список рекомендованої літератури
- •Термодинамічні параметри деяких речовин
Лабораторна робота №2:
Дослід 1. Залежнiсть швидкостi хімічної реакції вiд концентрації реагуючих речовин.
Залежнiсть швидкостi хімічної реакції вiд концентрації реагуючих речовин вивчають на прикладi самодовiльного розкладу тiосульфатної кислоти H2S2O3 при рiзних її концентрацiях, але при сталiй температурi. Одержання тiосульфатної кислоти з наступним самодовiльним розкладом відбувається згiдно рівнянь реакцiй:
Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4
H2S2O3 = H2SO3 + S
H2SO3 = SO2 + H2O
Швидкiсть всього процесу визначається швидкiстю найбільш повільної, у даному випадку другої реакції. Постановка дослiду ґрунтується на тому, що розклад тiосульфатної кислоти супроводжується видiленням еквівалентної кiлькостi колоїдної сiрки і по густинi її суспензії можна судити про кiлькiсть розкладеної тiосульфатної кислоти. Судити про густину суспензії можна з допомогою простого прийому: розглядаючи через розчин смужку кольорового паперу. При достатнiй густинi суспензії кольорова смужка паперу стає майже невидимою. Дослiд проводиться наступним чином: в пробiрку наливають розчин натрiй тiосульфату, при цьому позаду пробiрки тримають смужку кольорового паперу, потiм доливають розчин сульфатної(ортофосфатної) кислоти i вiдмiчають промiжок часу вiд моменту зливання розчинiв (початок реакції) до початку видимого зникнення кольорової смужки, що розглядається через шар рiдини (кiнець дослiду).
Необхідне обладнання та реактиви: склянка з 0,15 М розчином натрiй тiосульфату Na2S2O3 та піпеткою (3 мл); склянка з 0,15 М розчином сульфатної (ортофосфатної) кислоти та піпеткою (3 мл); склянка з дистильованою водою та піпеткою (3 мл); 4 чисті сухі пробірки, розміщені в штативі; смужка кольорового паперу.
Методика виконання досліду:
З допомогою пiпетки налийте в суху пробiрку (№1) (розташовану на фонi кольорової смужки паперу) 3 мл розчину натрiй тiосульфату, долийте туди ж 1 мл розчину сульфатної(ортофосфатної) кислоти, одразу ж почавши вiдлiк часу по секундомiру. У момент початку зникання смужки зупинiть секундомiр. Число секунд запишiть в журнал.
У три чистi i сухi пробiрки налийте розчин натрiй тiосульфату: в першу (№1) – 3 мл, в другу (№2)– 2 мл, в третю (№3) – 1 мл i долийте в них дистильованої води: в першу – 0 мл, в другу – 1 мл, в третю – 2 мл. Вмiст пробiрок перемiшайте обережним струшуванням. В кожну з пробiрок почергово долийте по 1 мл розчину сульфатної(ортофосфатної) кислоти, вiдмiчаючи по секундомiру час, який пройшов вiд моменту зливання розчинiв до моменту зникнення кольору смужки паперу.
Вiдмiтимо, що в дослiдах 1 i 2 вiдмiчався час, необхiдний для розкладу однiєї й тiєї ж кiлькостi H2S2O3 (при цьому густина суспензiї сiрки однакова), отже, змiна концентрацiї в цих дослiдах була однаковою, а час рiзний. Вiн тим бiльший, чим менша концентрацiя Н2S2O3. Величини, оберненi до цього часу, пропорцiйнi швидкостям відповідних реакцiй. Використовуючи результати вимiрiв, розрахуйте ці величини.
Таблиця 1. Залежнiсть швидкостi розкладу H2S2O3 вiд концентрацiї
|
№ пробір-ки |
Об’єми розчинів в пробірці:
|
Об’єм долитого розчину H2SO4 (Н3РО4) |
Концентрація С Na2S2O3 в пробірці, моль/л |
Час t до початку зникнення смужки, с |
Швидкість (величина, обернена до часу), 1/t |
|
1 |
3 мл розчину Na2S2O3 + 0 мл Н2О |
1 мл |
|
|
|
|
2 |
2 мл розчину Na2S2O3 + 1 мл Н2О |
1 мл |
|
|
|
|
3 |
1 мл розчину Na2S2O3 + 2 мл Н2О |
1 мл |
|
|
|
Результати приведіть в таблиці та побудуйте графік залежності швидкості реакції від концентрації.
На мiлiметровому паперi побудуйте графiк, відкладаючи на осi ординат величину, обернену часу (1/t), а на осi абсцис – концентрацiю (C). Данi для графiка берiть з попередньо складеної таблицi 1.
Дослiд 2. Залежнiсть швидкостi хімічної реакції вiд температури.
Вивчення залежностi швидкостi реакції вiд температури проводиться теж на прикладi самодовiльного розкладу тiосульфатної кислоти при однiй i тiй самій концентрації реагуючих речовин (Na2S2O3 i H2SO4), але при рiзнiй температурi.
Необхідне обладнання та реактиви: склянка з 0,15 М розчином натрiй тiосульфату Na2S2O3 та піпеткою (3 мл); склянка з 0,15 М розчином сульфатної (ортофосфатної) кислоти та піпеткою (1 мл); термостат, що являє собою стакан, закритий пробкою, в якiй є спецiальнi отвори для утримування пробiрок i термометра; відповідні сухі пробірки; термометр; смужка кольорового паперу; електроплитка.
Методика виконання досліду:
В одну пробiрку наливають 1 мл розчину Na2S2O3, в другу – 1 мл розчину H2SO4 (Н3РО4), пробiрки вставляють в отвори в пробцi, що закриває стакан, наповнений водою. Воду в стаканi нагрiвають з допомогою електроплитки, температуру води фiксують термометром. При досягненнi необхідної температури вмiст пробірок зливають i фiксують час, який проходить вiд моменту злиття вмiсту пробiрок до зникнення кольорової cмужки (t).
Вивчення залежностi проводьте при температурах 20, 30, 40оС. Для проведення дослiдiв щоразу берiть по 1 мл кожного розчину, тодi концентрацiя тiосульфатної кислоти в кожному дослiдi буде однакова. На основi результатiв дослiду вирахуйте значення 1/t для кожної температури., а також швидкість
Результати
приведiть в таблиці 2 та графічно,
вiдкладаючи на осi ординат1/t, а на осi
абсцис – температуру; розрахуйте
значення температурного коефіцієнту
швидкостi по формулi
=
![]() (різниця
температур t2–t1
=
10oC).
(різниця
температур t2–t1
=
10oC).
Таблиця 2. Залежнiсть швидкостi розкладу H2S2O3 вiд температури
|
№ пробірки |
Температура, оС |
Промiжок часу t вiд початку вiдлiку до зникнення кольорової смужки, сек |
Швидкість (величина, обернена до часу), 1/t |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
Дослiд 3. Вплив каталiзатора на швидкiсть хiмiчної реакцiї.
До 2 мл розчину ферум(ІІІ) хлориду долити 1 мл розчину калій роданіду. Розчин миттєво набуває яскравочервоного забарвленя – це якісна реакція на іон Fe3+.Одержаний розчин розлити у дві пробірки. До однієї з них долити пару крапель купрум сульфату (каталізатор), після чого в кожну пробірку внести розчин Na2S2O3, який відіграє роль відновника. Трьохвалентне залізо переходить до двохвалентного по схемі:
2Fe(SCN)3 + Na2S2O3 = Na2S4O6 + 2Fe(SCN)2 + 2NaSCN
Посвітління розчину пояснюється переходом Fe3+ → Fe2+, швидкість якого в обох пробірках різна. Пояснити чому.
Дослiд 4. Змiщення хімічної рiвноваги при змiнi концентрації реагуючих речовин.
У пробiрцi приготуйте сумiш дуже розбавлених розчинiв з 4 мл FeCl3 i 4 мл КSCN. При цьому утворюється Fe(SCN)3 згiдно рiвняння FeCl3+3КSCN = Fe(SCN)3+3КCl i розчин з майже безбарвного стає червоним. Утворений розчин перемiшайте скляною паличкою і розлийте порівну у 4 пробірки. У першу пробірку долити невелику кількість концентрованого розчину FeCl3, у другу – КSCN, у третю – насиченого розчину КCl, а четверту залишити для порівняння. Вiдмiтьте змiни в iнтенсивностi забарвлення. Дайте їм пояснення, використовуючи вираз константи хімічної рiвноваги i принцип Ле-Шательє:
k
=
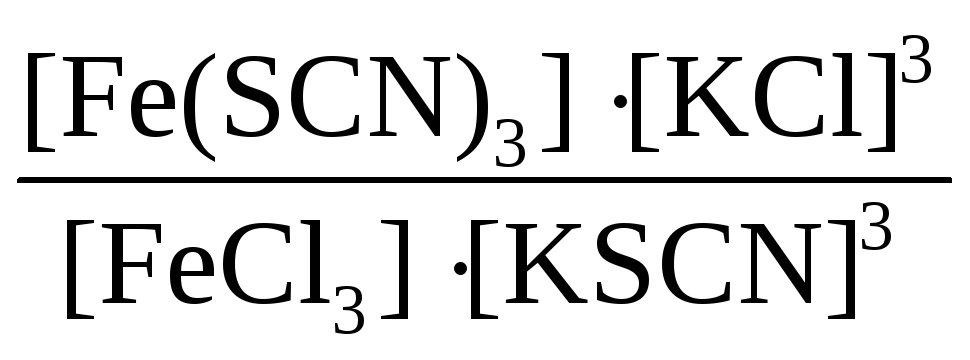
Дослiд 5. Вплив температури на змiщення хімічної рiвноваги.
Для досліду використовують дві сполучені колби, заповнені нітрогену(IV)оксидом – газом темно-бурого кольору. При охолодженні нітрогену(IV)оксид димеризується, і в результаті зворотної реакції встановлюється рівновага: 2NO2↔N2O4+54,39 кДж (N2O4 ‑ газ блідо жовтий, майже безбарвний).
Приготувати два стаканчики: один ‑ з гарячою, другий ‑ з холодною водою з льодом. Обережно занурити обидві колби в стакани з водою. Спостерігати зміну кольору газової суміші в колбах. В який бік змістилася рівновага у кожній із колб? Дати пояснення, виходячи із принципу Ле Шательє.
