
СтрБ3_4
.pdfПример фолдинга РНК-азы
(рибонуклеаза)
124 АК-остатка, 8 SH-групп, 4 –S-S- связи
1.Добавление мочевины и β- меркаптоэтанола: неактивный белок
2.Диализ: активный белок
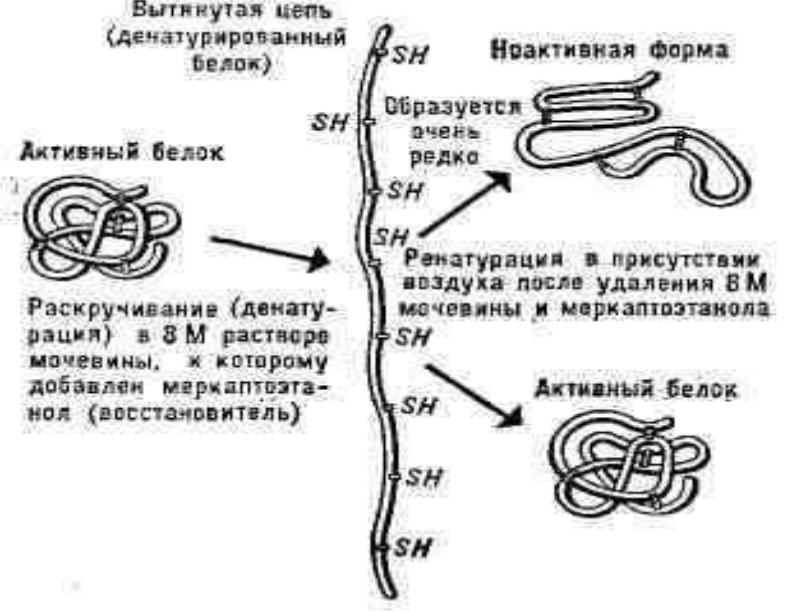
Два вывода:
•Вся информация о третичной структуре
белка (не имеющего небелкового компонента) заключена в его первичной структуре;
•Белок не только «знает», какую конформацию принять, но и делает это самопроизвольно
Это правило соблюдается только для нескольких малых белков!
Для правильной пространственной сборки большинства белков необходимы
специальные белки – шапероны и ферменты фолдазы
Они не определяют, какой должна быть пространственная структура белка (т.е. не являются «инструкторами»), но
создают условия для ее быстрого формирования
Нарушения в работе шаперонов может приводить к болезням Альцгеймера, Крейнцфельда-Якоба, коровье бешенство (губчатая энцефалопатия)
Прионы как антишапероны
PrPc – в мозге
(от англ. prion-related protein или protease-resistant protein)
открыты в 1982 году американским молекулярным биологом, профессором Стенли Прюзинером
Прио́ны (от англ. proteinaceous infectious particles — белковые заразные частицы) — особый класс инфекционных агентов белковой природы, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда высших животных (т. н. «медленные инфекции»
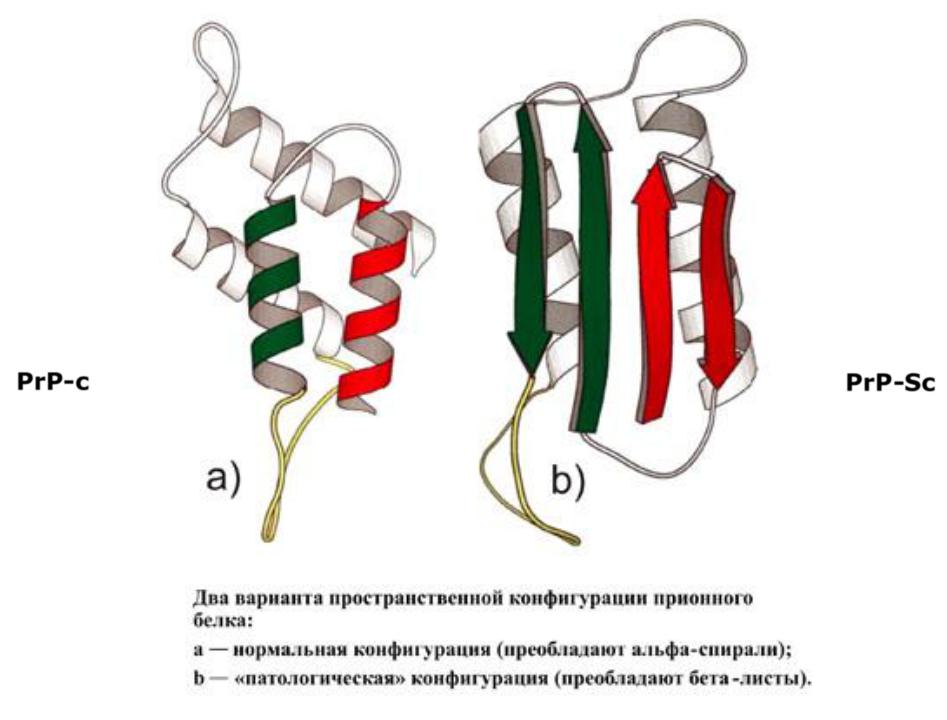
PrP-c |
PrP-Sc |
•Прионный белок, обладающий аномальной трёхмерной структурой, способен катализировать структурное превращение гомологичного ему нормального клеточного белка в себе подобный (прионный), присоединяясь к белку-
мишени и изменяя его конформацию. Как правило, прионное состояние белка характеризуется переходом α-спиралей белка в β-слои. Прионы — единственные инфекционные агенты, размножение которых происходит без участия нуклеиновых кислот.
