
- •Негосударственное образовательное учреждение
- •Общие методические указания
- •Правила оформления контрольной работы
- •Список литературы Основная
- •Дополнительная
- •Введение
- •Термодинамика и термохимия Основы термодинамики
- •Основные понятия и определения
- •Первый закон термодинамики
- •Основы термохимии
- •Второй закон термодинамики
- •Условия самопроизвольного протекания процессов
- •2. Процессы, протекающие при постоянном давлении и температуре.
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Основные газовые законы Идеальный газ
- •Уравнение состояния идеального газа
- •Газовые смеси. Закон Дальтона
- •Вариант 1.
- •Двухкомпонентные системы Жидкие бинарные системы
- •Концентрации растворов
- •Осмотическое давление растворов
- •Давление пара разбавленных растворов. Закон Рауля
- •Температуры кипения и замерзания идеального бинарного раствора с нелетучим растворённым веществом. Эбуллиоскопия. Криоскопия.
- •Вариант 1.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
- •Химическая кинетика Основные понятия
- •Зависимость скорости реакции от концентрации
- •Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции третьего порядка
- •Зависимость скорости реакции от температуры
- •Вариант 1.
- •Вариант 2.
- •Вариант 3.
- •Вариант 4.
- •Вариант 5.
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
- •Электрохимия Электрическая проводимость растворов электролитов
- •Вариант 1.
- •Вариант 1.
- •Вариант 2.
- •Вариант 3.
- •Вариант 4.
- •Вариант 5.
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
- •Коллоидная химия Поверхностные явления
- •Классификация дисперсных систем по агрегатному состоянию
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Коллоидное состояние вещества
- •Вариант 1
- •Вариант 1.
- •Вариант 1
- •Эбулиоскопические константы некоторых растворителей
- •Криоскопические константы некоторых растворителей
- •Константы диссоциации слабых кислот и оснований при 25ºС
- •Предельные подвижности ионов (См∙см∙моль-1) при 25ºС
- •Примерный перечень вопросов к зачету по дисциплине «Физическая и коллоидная химия»
Температуры кипения и замерзания идеального бинарного раствора с нелетучим растворённым веществом. Эбуллиоскопия. Криоскопия.
На основе закона Рауля можно установить:
1. изменение температуры кипения раствора по сравнению с температурой чистого растворителя при одинаковом внешнем давлении;
2. изменение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя при одинаковом внешнем давлении.
Жидкость закипает при той температуре, при которой давление насыщенного пара над ней становится равным внешнему (Р = Рвн).
Так как для раствора
с нелетучим растворённым веществом при
любой температуре Р всегда меньше, чем
Рi0,
температура кипения раствора (Ткип)
всегла выше, чем температура кипения
чистого растворителя (Т![]() ).
).
Установлено, что
ΔТкип = Ткип- Т![]() пропорционально моляльной (b)
концентрации раствора:
пропорционально моляльной (b)
концентрации раствора:
![]() ΔТкип = Е ·b, (77)
ΔТкип = Е ·b, (77)
где Е – коэффициент пропорциональности, называемый эбуллиоскопической постоянной.
Эбуллиоскопическая постоянная не зависит ни от природы растворённого вещества, ни от его концентрации, а определяется свойствами чистого растворителя:
Е =
 ,
(78)
,
(78)
где R– универсальная газовая постоянная;
Т![]() ,
,![]() - соответственно температура кипения
и удельная теплота испарения чистого
растворителя.
- соответственно температура кипения
и удельная теплота испарения чистого
растворителя.
Для воды Е равна 0,52 град · кг/моль.
Для раствора, содержащего m2 граммов растворённого вещества, молярной массой М2, вm1граммах Н2О, моляльность раствора рассчитывается по формуле:
b=
![]() .
(79)
.
(79)
Тогда температура кипения раствора определяется по формуле:
Ткип= Т![]() + Е
+ Е![]() ,
(80)
,
(80)
где Т![]() - температура кипения чистой воды,
значения её приведены в справочниках.
- температура кипения чистой воды,
значения её приведены в справочниках.
Если не известна молярная масса растворённого вещества (М2), то её находят по формуле:
М2 =![]() ,
(81)
,
(81)
![]() где
ΔТкип = Ткип- Т
где
ΔТкип = Ткип- Т![]() находят экспериментальным путём.
находят экспериментальным путём.
Метод исследования, основанный на экспериментальном определении температуры кипения раствора, называется эбуллиоскопией. Он применяется при изучении реальных разбавленных растворов.
Любая жидкость замерзает при той температуре, при которой давление насыщенного пара над ней становится равным давлению насыщенного пара над кристаллами.
Очевидно, что
температура замерзания раствора (Тз)
всегда меньше, чем температура замерзания
чистого растворителя (Т![]() ):
):
ΔТз= Т![]() - Тз > 0.
- Тз > 0.
Наблюдаемое понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя связано с концентрацией раствора уравнением:
ΔТз= Кb, (82)
где b– моляльность раствора, К – коэффициент пропорциональности, называемыйкриоскопической постоянной.
Криоскопическая постоянная не зависит ни от природы растворённого вещества, ни от его концентрации, а определяется свойствами чистого растворителя:
К =
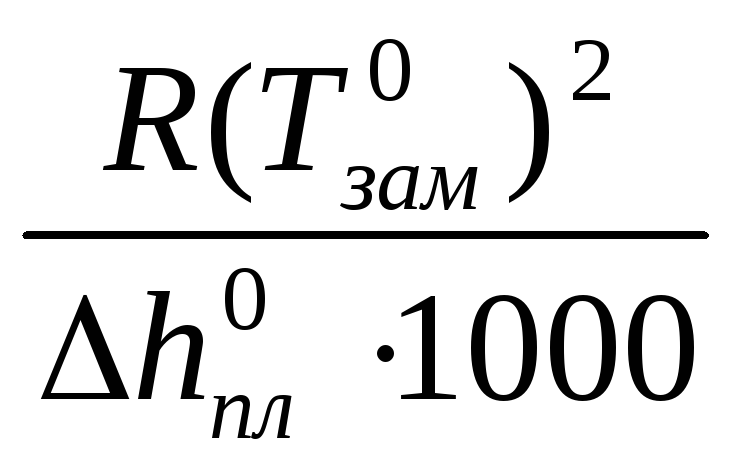
![]() ,
(83)
,
(83)
где Т![]() ,
,![]() - соответственно температура замерзания
и удельная теплота плавления чистого
растворителя.
- соответственно температура замерзания
и удельная теплота плавления чистого
растворителя.
Её физический смысл заключается в том, что она численно равна ΔТз раствора, моляльность которого равна 1 моль на 1 кг растворителя.
Для воды, как наиболее распространённого растворителя,
К![]() = 1,86
= 1,86![]() .
.
Определив опытным путём понижение температуры замерзания раствора и используя формулы (82) и (83), можно рассчитать молекулярный вес растворённого вещества – неэлектролита. Данный метод криоскопии широко применяется в лабораторной практике.
Пример 12.Выразить концентрацию водного раствора глицерина С3Н8О3в весовых процентах, если он замерзает при -0,52ºС.
Решение. Находим понижение температуры замерзания:
ΔТз= Т![]() - Тз= 0 – (- 0,52) = 0,52.
- Тз= 0 – (- 0,52) = 0,52.
По формуле (82) вычисляем моляльную концентрацию раствора:
b=
![]() моль
в 1000 г воды.
моль
в 1000 г воды.
Мм(С3Н8О3) = 92 г/моль, следовательно, в 1000 г воды содержится 0,280 моль ∙ 92 г/моль = 25,76 г глицерина.
Общая масса раствора равна 1000 + 25,76 = 1025,76 г глицерина.
Составляем пропорцию:
В 1025,76 г раствора содержится 25,76 г глицерина.
В 100 г раствора содержится xг глицерина.
х =
![]() 2,51 %.
2,51 %.
Пример 13. При какой примерно температуре должен замерзать 40%-ный водный раствор этилового спирта?
Решение. Используя формулы (82) и (79), получаем:
ΔТз= Кb= К![]() = 1,86
= 1,86![]() .
.![]() .
.
ΔТз= Т![]() - Тз, ΔТз= 0 – 26,95 = - 26,95 ºС.
- Тз, ΔТз= 0 – 26,95 = - 26,95 ºС.
