
- •Часть 1
- •Набережные Челны
- •Введение
- •Цели и задачи дисциплины
- •Общие методические указания
- •Структура и содержание дисциплины «физика»
- •Раздел 1. Физические основы механики
- •Тема 1.1. Элементы кинематики
- •Тема 1.2. Элементы динамики частиц
- •Тема 1.3. Законы сохранения в механике
- •Тема 1.4. Элементы механики твердого тела
- •Тема 2.3. Ангармонические колебания
- •Тема 3.3. Функциираспределения
- •Тема 3.4. Элементы физической кинетики
- •Тема 3.5. Распределение Гиббса
- •Тема 3.6. Порядок и беспорядок в природе
- •Раздел 4. Электричество и магнетизм
- •Тема 4.1. Электростатика
- •Тема 4.2. Постоянный электрический ток
- •Форма и содержание итогового контроля
- •Методические указания
- •К выполнению контрольной работы № 1
- •Физические основы механики, механические колебания и волны.
- •Основные законы и формулы
- •Примеры решения задач
- •Контрольная работа №1
- •Методические указания
- •К выполнению контрольной работы № 2
- •Статистическая физика и термодинамика
- •Основные законы и формулы
- •Примеры решения задач
- •Контрольная работа № 2
- •Методические указания к выполнению контрольной работы № 3 Электростатика, постоянный ток Основные законы и формулы
- •Примеры решения задач
- •Контрольная работа № 3
- •1. Основные физические постоянные
- •2. Некоторые астрономические величины
- •Часть 1
Примеры решения задач
Пример
1. Определить
количество вещества
![]() и
числоN
молекул углекислого газа массой m
= 200 г.
и
числоN
молекул углекислого газа массой m
= 200 г.
Решение.
Число
N
молекул,
содержащихся в газе массой m,
равно произведению постоянной Авогадро
на количество вещества
![]() :
:
N=![]() NA,
NA,
Количество вещества ν=m/μ , гдe, μ — молярная масса. Определяем молярную массу С02.
μ= 12+ 16* 2 = 44- 10-3 кг/моль;
![]() ;
;
N = 4, 5*6,02* 1023 = 27,09 • 1023 молекул.
Пример 2. Найти массу сернистого газа (SО2), занимающего объем 25 л при температуре 27 °С и давлении 101 кПа.
Решение. Из уравнения Клапейрона — Менделеева масса газа находится:
m=pVμ/RT.
Молярную массу сернистого газа определяем по данным таблицы Менделеева:
μ = 32+ 16* 2 = 64 *10~3 кг/моль. Вычисляем массу:
![]() =
0,065 кг.
=
0,065 кг.
Пример 3. В баллоне содержится m1 = 40 г кислорода и m2 = 240 г аргона. Давление смеси 2 МПа, температура 100 К. Определить объем баллона.
Решение. По закону Дальтона давление газовой смеси равно сумме парциальных давлений газов, входящих в смесь.
Парциальные давления кислорода Р} и аргона Р2 находятся из уравнения Клапейрона — Менделеева:
![]() ,
,
![]() .
.
Давление смеси газов:
p=p1+p2=(m1/μ1+m2/μ2)(RT/V).
Отсюда объем баллона:
V=(m1/μ1+m2/μ2)(RT/p)
Молярные массы определяем по данным таблицы Менделеева:
μ1= 32* 10-3 кг/моль;
μ2=40*10~3 кг/моль.
Вычислим объем:
![]()
Пример 4. В баллоне объемомV=10 л находится гелий под давлением p1 = 1 МПа и при температуре T1=300 К. После того, как из баллона выпущено m=10 г гелия, температура в баллоне понизилась до Т2=290 К. Определить давление р2 гелия, оставшегося в баллоне.
Решение. Применим уравнение Клапейрона — Менделеева к конечному состоянию газа:
p2V=(m2/μ)RT
где m2 — масса гелия в баллоне в конечном состоянии; μ— молярная масса гелия; R — универсальная газовая постоянная. Из этого уравнения выразим искомое давление:
p2=m2RT2/μV.
Масса гелия m2 определится:
m2=m1-m,
где m1 — масса гелия в начальном состоянии; m — масса гелия, взятого из баллона.
Масса гелия m1 находится из уравнения Клапейрона — Менделеева, записанного для начального состояния:
m1=μp1V/RT1.
Окончательно искомое давление выразится:
![]()
Проверим размерность искомой величины. Для этого подставим в правую часть единицы измерения величин. Первое слагаемое дает единицу давления. Для второго слагаемого:
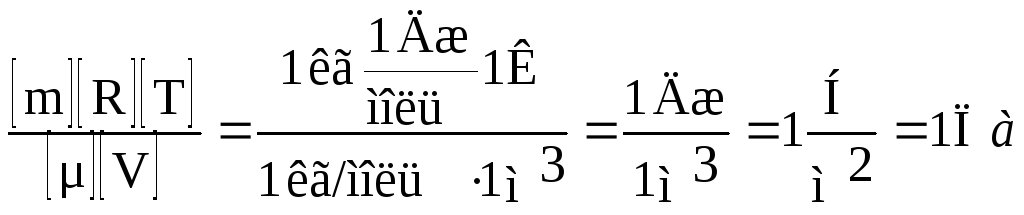
С учетом значения μ = 4*10~3 кг/моль вычислим давление p2
![]() 0,364
МПа.
0,364
МПа.
Пример 5. Определить среднюю кинетическую энергию вращательного .движения одной молекулы углекислого газа при температуре 400 К и кинетическую энергию вращательного движения всех молекул углекислого газа, находящихся в 20 г.
Решение. На каждую степень свободы молекулы газа приходится одинаковая средняя, энергия <ε> = 1/2 kТ, где k — постоянная Больцмана; Т — температура газа. Так как для трехатомной молекулы углекислого газа три степени свободы приходятся на поступательное движение и три степени свободы на вращательное движение, поэтому средняя энергия вращательного движения одной молекулы
![]()
Кинетическая энергия вращательного движения всех молекул газа
E=‹εвращ›N.
Число молекул газа N = νNA, где NA, — постоянная Авогадро; ν— количество вещества.
С учетом того, что ν=m/μ , получаем N = NA (,m/μ) . Полная кинетическая энергия вращения всех молекул, таким образом определяется:
Е =NA(m/μ)‹εвращ›.
Учитывая, что для углекислого газа μ = 44*10~3 кг/моль, произведем вычисления:
‹εвращ›= 3/2kT =3/2*1,38*10-23*400 = 8,28*10-21 Дж;
![]()
Пример 6. Чему равны удельные теплоемкости сV и сp некоторого двухатомного газа, если плотность этого газа при нормальных условиях равна 1,43 кг/м3?
Решение. Удельные теплоемкости выражаются
![]()
![]()
![]()
Из уравнения Клапейрона — Менделеева выражаем μ:
![]() и
и
![]()
так как плотность газа ρ=m/V.
Подставляя молярную массу в формулы для теплоемкости, имеем:
![]() и
и
![]() .
.
Произведем вычисления, учитывая, что для двухатомного газа число степеней свободы
i= 5, а при нормальных условиях давление p= 1,01 *105 Па и Т = 273 К.
![]()
![]()
Пример 7. В цилиндре под поршнем находится водород массой m = 0,02 кг при температуре
T=300 К. Водород сначала расширился адиабатно, увеличив объем в 5 раз, а затем изотермически сжался, уменьшив объем в 5 раз. Найти температуру в конце адиабатного расширения и работу, совершенную газом в этих процессах.
Решение. В адиабатном процессе температура- и объем газа связаны соотношением:
TVγ-1=const, то есть T2/T1=(V1/V2)γ-1,
где γ — отношение теплоемкостей газов (γ = сp/сV). Конечная температура T2, отсюда определится:
T2=T1(V1/V2)γ-1
Работа при адиабатном расширении определится:
![]()
где СV- молярная теплоемкость газа при постоянном объеме. Работа при изотермическом процессе определится:
![]()
Проведем вычисления, учитывая, что для водорода, как двухатомного газа, i = 5,γ= 1,4,
μ= 2*10~3 кг/моль;
T2=157K
![]()
![]()
Здесь знак «минус» означает, что при сжатии работа совершается над газом внешними силами.
Пример 8. Тепловая машина работает по обратимому циклу Карно. Температура теплоотдатчика T1 = 600 К. Определить термический КПД цикла и температуру Т2 теплоприемника, если за счет каждого килоджоуля теплоты, получаемой от теплоотдатчика, совершается работа А = 250 Дж.
Решение. Термический КПД тепловой машины показывает, какая доля теплоты, полученной от теплоотдатчика, затрачивается на совершение механической работы, и определяется:
η=A/Q1
где Q1— количество теплоты, получаемое от теплоотдатчика; А — механическая работа, совершаемая рабочим телом тепловой машины.
С другой стороны, КПД цикла Карно определяется температурами теплоотдатчика и теплоприемника:
η=(T1-T2)/T1
Отсюда температура теплоприемника:
T2=T1(1-η).
Произведем вычисления:
η = 250/1000 = 0,25;
T2=600(1— 0,25) =450 К.
Пример 9. Найти добавочное давление, внутри мыльного пузыря диаметром d=10 см. Какую работу нужно совершить, чтобы выдуть этот пузырь?
Решение. Пленка мыльного пузыря имеет внешнюю и внутреннюю сферические поверхности и обе оказывают давление на воздух, заключенный внутри пузыря. Диаметры обеих .поверхностей можно считать одинаковыми, так как толщина пленки мала. Добавочное давление, поэтому определится:
p=2(2α/r),
где α — коэффициент поверхностного натяжения; r — радиус пузыря; г = d/2.
Окончательно: р = 8α/d.
Работа, затрачиваемая на увеличение поверхности пленки на величину ∆S, запишется:
A=α∆S=α(S-S0),
гдеS — общая площадь двух сферических поверхностей пленки мыльного пузыря; S0 — общая площадь двух поверхностей плоской пленки, имевшейся до выдувания пузыря, которой в задаче можно пренебречь. Поэтому
A=αS=α2πd2
Произведем вычисления:
![]() ;
;
А=2*3,14*(0,1)2*40*10-3=2,5 мДж
Пример 10. Найти изменение энтропии при превращении 10 г льда при —20 °С в пар при 100 °С.
Решение. Изменение энтропии определяется формулой:
![]()
где S1 и S2 — значения энтропии в первом и во втором состоянии соответственно.
В данном случае общее изменение энтропии складывается из изменений ее в отдельных процессах.
1) Нагревание массы m льда от температуры Т1 до температуры T2. При этом
dQ = mc1dT
где с1 - удельная теплоемкость льда.
Таким образом,
∆S1=mc1ln(T2/T1).
2) Плавление массы m льда при температуре Т2. Здесь
![]() ,
,
где λ — удельная теплота плавления.
Определяем
∆S2=λm/T2.
3) Нагревание массы m воды от T2 до T3:
∆S3=mc2ln(T3/T2);
где с2— удельная теплоемкость воды.
4) Испарение массы m воды при температуре Т3:
∆S4=r m/T3
где r — удельная теплота парообразования. Общее изменение энтропии:
∆S=∆S1+∆S2+∆S3+∆S4=m[c1ln(T2/T1)+λ/T2+c2ln(T3/T2)+r/T3].
Произведем
вычисления, имея в виду, что c1=2,1*103
Дж/кг*К, T1
= 253 К,T2
= 273 К, T3
= 373 К,
![]() λ=3,35*105
Дж/кг, c2=
4,19*103
Дж/(кг*К), r
=2,26*106
Дж/кг.
λ=3,35*105
Дж/кг, c2=
4,19*103
Дж/(кг*К), r
=2,26*106
Дж/кг.
∆S = 88 Дж/К.
Пример 11. Найти изменение энтропии при переходе 8 г кислорода от объема в 10 л при температуре 80 °С к объему в 40 л при температуре 300 °С.
Решение. Имеем изменение энтропии
![]() ,
,
где
![]()
Учитывая уравнение Клапейрона — Менделеева имеем:
![]()
После вычислений получаем
![]()
S2 –S1= 5,4 Дж/К.
