
Лекція № 7. Ферменти.
Коротка історія вчення про ферменти
Ферменти(ензими) – це біологічні каталізатори білкової природи, які утворюються в живих клітинах і володіють здатністю прискорювати хімічні процеси в організмі. І.П. Павлов назвав ферменти істинними двигунами всіх життєвих процесів.
Історія біохімії в значній мірі є історією вивчення ферментів. Розвиток вчення про ферменти можна умовно розбити на декілька етапів. Перший етап охоплює період до XVII ст. і характеризується використанням ферментів в практичній діяльності людини (випічка хліба, виготовлення вин, різних сортів сиру, шкіри та ін.).
Другий етап включає період з XVII ст. до середини XIX ст. і зв’язаний з іменем Я.Б. ван Гельмонта, який вивчав бродіння цукристих речовин. Я.Б. ван Гельмонт запропонував і ввів у науку термін ферменти (від лат. fermentum – закваска). В 1814 р. російський вчений К. Кірхгоф у солоді відкрив амілазу, під впливом якої крохмаль перетворюється на мальтозу. В 1836 р. T. Шванн у шлунковому соку виявив пепсин. У 1862 р. О.Я. Данилевський з соку підшлункової залози виділив амілазу, ліпазу і трипсин. Ним і його учнями встановлена оборотність перебігу ферментативних реакцій.
Третій етап починається з другої половини XIX ст. і продовжується до 30-х років XX ст. У другій половині XIX ст. ферменти почали цікавити технологів і клініцистів. Виникла суперечка між Л. Пастером і Ю. Лібіхом відносно природи ферментів. Л. Пастер всі ферменти розділив на „організовані” і „неорганізовані”. До перших він відніс ферменти, які діють на субстрати в живих клітинах (наприклад, ферменти дріжджів, що викликають спиртне бродіння). До других були віднесені ферменти, які проявляли свою дію зовні клітин, які утворили їх (наприклад, пепсин в порожнині шлунку). Ю. Лібіх вважав, що всі ферменти можуть проявляти свою каталітичну дію як у середині клітин так і зовні них. Суперечка була вирішена російським лікарем M.M. Манасеїною в 1871 р. Вона отримала дріжджовий сік, який зброджує вуглеводи так само, як і дріжджові клітини. Досліди були підтверджені Е. Бухнером. Тим самим було доведено, що ферменти можуть функціонувати незалежно від клітинної структури.
Число відомих ферментів зростало. До кінця XIX ст. виникла необхідність в систематизації їх назв. Е. Дюкло запропонував при найменуванні ферментів до кореня слова, що означає субстрат, додавати суфікс –аза (наприклад, субстрат сахароза – фермент сахараза). Г. Бертран у 1897 р. виділив з молекул багатьох ферментів речовину, здатну до діалізу, кофермент, або коензим. С. Серенсен у 1909 р. прийшов до висновку, що активність будь-якого ферменту залежить від рН середовища. В цей час Е. Фішер створює перші уявлення про механізм дії ферментів і субстратів („ключ до замка”), А. Броун у 1902 р. приходить до висновку, що під час каталізу виникає фермент–субстратний комплекс. В. Анрі обґрунтовує цей висновок математично. Л. Міхаеліс і M. Ментан у 1913 р. створюють основи сучасної кінетики ферментативного каталізу.
Детально вивчається структура молекул ферментів. P. Вільштеттер встановлює одно- і двокомпонентні ферменти. В першому випадку молекула ферменту складається тільки з білка, в другому – з білкового носія – апофермента і небілкової групи – кофермента. Апоферменти і кофермент разом складають холофермент, або активний фермент. Дж. Самнер у 1926 р. виділяє перший фермент в кристалічному вигляді – уреазу. Його роботи успішно продовжує Д.X. Нортроп, який у 1930 р. виділяє кристалічний пепсин, у 1931 р. – трипсин та інші ферменти. З того часу починається четвертий етап в розвитку ферментології.
У ці роки вивчається структура молекул коферментів і реакції їх з’єднання з білковими носіями. О. Варбург і його учні вивчають структуру молекул дихальних ферментів, НАД і ФАД. Досліджується різноманіття функцій ферментів і деталі будови їх молекул. В.О. Енгельгардт і M.М. Любімова в 1939 р. встановлюють, що багато структурних білків (наприклад, міозин) можуть виконувати ферментативні функції. До 50 років XX ст. ферментологія стала одним з розділів біохімії. В цей час встановлено участь у ферментативних реакціях, як коферментів, багатьох вітамінів. У 1955 р. С. Очоа зі співробітниками здійснив синтез РНК під впливом ферменту полінуклеотидфосфорилази. В 1958 р. А. Корнберг виділив полімеразу, під впливом якої синтезується ДНК.
Сучасний етап в розвитку ферментології характеризується одним з блискучих досягнень учених-ферментологів – встановленням структури панкреатичної рибонуклеази (К. Хірс, С. Мур, В. Стейн, 1960). У 1976 р. X.Г. Корана синтезує ген з 196 нуклеотидів. За образним виразом В.Л. Кретовича, всі ці відкриття в області ферментології підвели завісу над найпотаємнішими таємницями живої матерії і розкривають блискучі перспективи для подальшого розвитку науки і застосування її досягнень на практиці.
Біосинтез і клітинна локалізація ферментів
Ферменти за хімічною природою є простими або складними білками. Для їх утворення відповідні клітини повинні містити амінокислоти та інші речовини, з яких утворюються простетичні групи або коферменти.
Біосинтез молекули ферменту відбувається в кожній клітині, тканині, органі і складається з тих же етапів, що і біосинтез звичайного білка:
![]()
Перші два етапи є типовими матричними процесами. Третій етап – це типовий синтез білкової молекули. На четвертому етапі формується молекула активного ферменту. Якщо фермент є складним білком, то відбувається з’єднання апофермента з коферментом. Молекула ферменту набуває типової структури (вторинна, третинна і четвертна), яка енергетично вигідна для здійснення каталітичних функцій. Деякі ферменти спочатку перебувають в неактивному стані і лише після дії активаторів стають активними.
Біосинтез ферментів в організмі протікає безперервно. Найбільш інтенсивно утворюються ферменти в періоди росту і розвитку організму. Окремі органи синтезують значну частину ферментів, до них слід віднести залози (слинні, шлункові, кишкові, підшлункову), ферменти яких беруть участь в гідролітичному розщепленні поживних речовин. Порушення якісного і кількісного складу ферментів призводить до патології, оскільки для кожного органу, тканини і клітини характерний свій „набір” ферментів. Цей набір визначається видом і віком, ступенем функціонального навантаження і статтю організму.
Для ферментів характерна певна клітинна локалізація. Так, в ядрі, в основному, зосереджені ферменти, які впливають на обмін нуклеїнових кислот (5¢-нуклеотидаза, аденозиндезаміназа, НАД-пірофосфорилаза, оротидин-5¢-фосфат-пірофосфорилаза, глюкозо-1-фосфат-уридилтрансфераза та ін.). В ядерній мембрані містяться ферменти, які беруть участь у транспортуванні окремих сполук і енергії (ацетилестераза, АТФ-аза, цитохромоксидаза, глутаматдегідрогеназа, НАД∙Н2-Цитохром-с-редуктаза та ін.). Ферменти клітинного дихання розміщені переважно в мітохондріях (піруватдегідрогеназа, глутаматдегідрогеназа, ферменти окислення жирних кислот та ін.). Лізосоми містять ферменти, що каталізують в основному розщеплення багатьох речовин (катепсин С, пептидгідролази, естерази, сульфатази, кислі ДНК- і РНК-ази, гіалуронатліазу та ін.). Ферменти біосинтезу білка переважно концентруються в рибосомах (аміноацил-тРНК-синтетази, пептидсинтетази та ін.). У гіалоплазмі виявляються ферменти різної функціональної спрямованості: гліколізу, синтезу жирних кислот, активації амінокислот т.д.
Наявність і кількісний вміст індивідуального ферменту в клітині і її мікроструктурах залежать від багатьох чинників – функціонального значення клітини, виду, віку організму.
Методи виділення і очищення ферментів
Вихідним матеріалом для отримання різних ферментів найчастіше служать органи і тканини тварин і рослин, травні соки, а також клітинна маса мікроорганізмів. Підбираючи матеріал, слід враховувати вид тварини. Зокрема, вміст b-глюкозидази в тканинах шести видів тварин може різко відрізнятися. Травні ферменти від тварин одержують фістульним методом І.П. Павлова. Часто для отримання ферментів використовують бактерійні маси, вирощені на певному середовищі. Так, при індукованому синтезі вміст кислої фосфатази в масі кишкової палички можна збільшити до 6% і більше.
Молекули ферментів зазвичай зв’язані із структурними білками, ліпідами і вуглеводами, які входять до складу органоїдів і клітинних мембран. Частина молекул ферментів знаходиться в біологічних рідинах у вільному стані. Щоб виділити ферменти, слід зруйнувати клітини, перевести ферменти в розчин і потім екстрагувати.
Матеріал, призначений для отримання ферментів, звільняють від домішок (органи – від сполучнотканинної капсули, жиру, крові та ін.). Свіжий матеріал зазвичай зберігають при низьких температурах (–20°С). Матеріал подрібнюють в гомогенізаторах, ультразвуком, за допомогою аутоліза, лізису, розтирання в ступці з піском і т.д. Іноді клітинні мембрани руйнують, обробляючи матеріал ацетоном (одержують безводний порошок, зручний для зберігання і екстракції). Для отримання ферментів з певних субклітинних структур матеріал гомогенізують і фракційно центрифугують. До окремих фракцій додають детергенти, наприклад „Твіни”. Під їх впливом руйнуються мембрани субклітинних структур і ферменти переходять в розчин. Для отримання екстрактів як розчинники використовують дистильовану воду, буферні розчини, фізіологічний розчин, суміш гліцерину і дистильованої води, органічні розчинники.
Очищення ферментів зазвичай є чергуванням різних методів фракціонування. Зокрема, більшість ферментів можна очистити, застосовуючи такі методи.
1. Фракціонування за допомогою органічних розчинників: ацетону, етанолу та ін.
2. Фракціонування з використанням адсорбції і елюції. Як адсорбенти застосовують гелі гідроксида алюмінію, ортофосфата кальцію, як елютанти – воду, буферні розчини і інші розчинники.
3. Фракціонування з різними концентраціями нейтральних солей, найчастіше – сульфату амонія.
4. Розділення ферментів за допомогою хроматографічної колонки.
5. Виділення ферментів з сумішей методом електрофореза на крохмальному гелі або на папері.
6. Отримання ферментів з розчинів методом кристалізації і перекристалізації.
Отримані ферменти перевіряють на чистоту. Для цього визначають константу седиментації, електрофоретичну рухливість при декількох значеннях рН, чистоту ферментативного препарату по кривій розчинності, досліджують імунологічні властивості препарату за допомогою антисироватки, а також вивчають електрофоретичні та хроматографічні властивості ферменту після дії трипсину.
Загальні властивості ферментів
Білкова природа ферментів. Білкова природа ферментів в даний час повністю встановлена. Всі ферменти є простими або складними білками. Наприклад, до простих білків відносяться. ферменти трипсин, уреаза й ін., до складних – каталаза, ферменти, що каталізують окисно-відновні процеси й ін. Усі ферменти добре розчиняються у воді, в розбавлених розчинах кислот, лугів, солей і деяких органічних розчинниках. Водні розчини ферментів проявляють типові ознаки ліофільних колоїдних систем. Для ферментів характерна висока молекулярна маса: від десятка тисяч до декількох мільйонів. Понад 400 ферментів отримано в кристалічному вигляді (рис. 1). Всі вони амфотерні і володіють високою хімічною активністю.
Термолабільність і температурний оптимум дії ферментів. Ферменти – термолабільні сполуки. При дії високих температур вони денатуруються, що призводить спочатку до зменшення, а потім і до припинення каталітичних функцій. Температурний оптимум дії більшості ферментів тварин знаходиться в межах температури тіла – 37 – 40°С. Виключенням є папаїн, найбільша активність каталітичної дії якого виявляється при 80°С, і каталаза, температурний оптимум дії якої лежить між 0 і 10°С. При підвищенні температури середовища на 10°С швидкість реакції зростає в 1,5 – 3 рази (правило ле Шательє) приблизно в межах від 0 до 25°С; потім поволі підвищується і після 40°С починає зменшуватися (рис. 2).

Рис. 1. Кристали фосфоенолпіруваткінази
При температурі 80 – 100°С ферменти втрачають свою каталітичну здатність, оскільки наступає денатурація білкової молекули. Ферменти в розчиненому стані більш чутливі до нагрівання, ніж в сухому. Відомі ферменти, які можуть короткочасно переносити температуру +100°С (аденілаткіназа). З пониженням температури швидкість ферментативних реакцій поступово зменшується, досягаючи мінімуму при 0°С. Деякі ферменти в сухому стані витримують охолоджування до –120–190°С. При поступовому підвищенні температури до +37°С їх активність відновлюється. Ця властивість використовується при зберіганні сперми для штучного запліднення тварин.

Рис. 2. Залежність швидкості ферментативної реакції від температури
Вплив реакції середовища на активність ферментів. Кожний фермент проявляє максимальну для нього каталітичну дію при певному значенні рН, яке називається рН-оптимумом. Так, для пепсину рН-оптимум рівний 1,5 – 2,5, катепсина – 4,5 – 5,0, карбоксилази – 4,8, уреази – 7,2 – 8,0, трипсину – 7,5 – 9,5 і т.д (табл 1).
Більшість ферментів проявляє максимальну каталітичну активність при рН = 7 (рис. 3). Зміни рН уповільнюють або припиняють дію ферментів.
Вплив рН на активність ферментів пояснюється структурою їх молекул. Молекула ферменту має один або декілька активних центрів, в яких сконцентровані функціональні групи білків (рис. 5).
Таблиця 1.
Оптимальні значення рН для деяких ферментів (зa t.T. Березовим і б.Ф. Коровкіним)
|
Фермент |
рН |
Фермент |
рН |
|
Пепсин |
1,5 – 2,5 |
Каталаза |
6,8 – 7,0 |
|
Катепсин В |
4,5 – 5,0 |
Уреаза |
7,0 – 7,2 |
|
Амілаза із солоду |
4,9 – 5,2 |
Панкреатична ліпаза |
7,0 – 8,5 |
|
Сахароза кишкова |
5,8 – 6,2 |
Трипсин |
7,5 – 8,5 |
|
Амілаза слини |
6,8 – 7,0 |
Аргіназа |
9,5 – 10,0 |
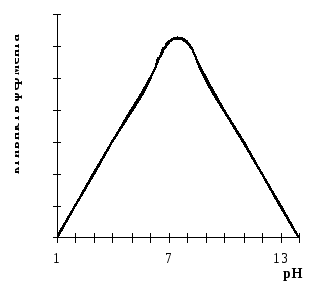
Рис. 3. Залежність активності ферментів від рН середовища
Ступінь їх іонізації залежить від рН середовища. Більш того, рН середовища впливає на ступінь іонізації субстратів, фермент-субстратного комплексу і продуктів реакції, структуру молекули ферменту. Все це разом і визначає каталітичну здатність ферменту в тій або іншій реакції. Прикладом може бути фермент РНК-аза, яка розщеплює молекулу РНК на мононуклеотиди. Молекула РНК-ази, особливо її активний центр, містить високий відсоток лізину. Аміногрупа, розміщена в e-положенні, зазвичай вільна і визначає активність ферменту. Її іонізація можлива в кислому середовищі, тому і оптимальне значення рН для РНК-ази буде дорівнювати 5,4 – 5,6. У лужному середовищі фермент не активний, оскільки іонізація аміногрупи в цих умовах неможлива.
Специфічність дії ферментів. Кожний фермент діє на певний субстрат або групу речовин, схожих за своєю будовою. Специфічність дії ферментів пояснюється подібністю просторових конфігурацій активного центру ферменту і субстрату, їх хімічною спорідненістю, що призводить до утворення фермент-субстратного комплексу і здійснення каталітичного процесу. Без специфічності ферментів був би неможливий впорядкований ланцюг реакцій обміну речовин.
Розрізняють індивідуальну (абсолютну і стереохімічну) і групову (абсолютну і відносну) специфічність ферментів. Ферменти, які каталізують лише одну реакцію і діють на один точно визначений субстрат, мають абсолютну індивідуальну специфічність. Абсолютною специфічністю володіє уреаза, яка розщеплює сечовину на аміак і вуглекислий газ:

Довгий час вважали, що сечовина є єдиним субстратом уреази. Однак зовсім недавно було доведено, що кристалічна уреаза може діяти також на окремі сполуки – похідні сечовини, зокрема на оксисечовину. Правда реакція гідролізу оксисечовини відбувається у 100 разів повільніше:
![]()
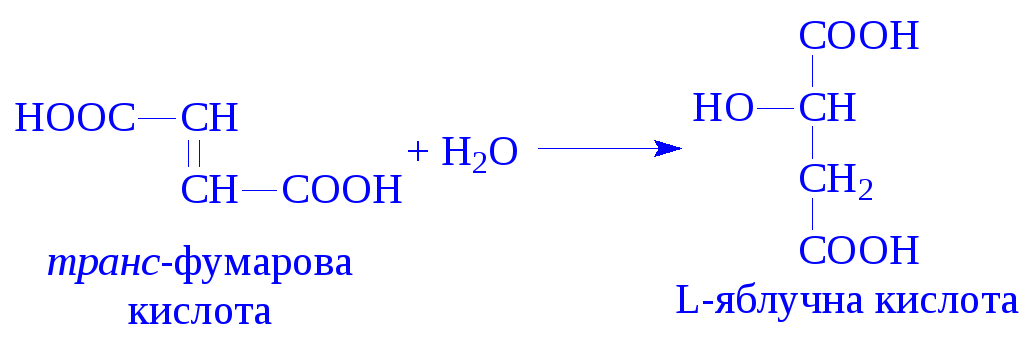
Стереохімічна абсолютна специфічність ферментів проявляється тоді, коли вони діють на оптично активні сполуки, або сполуки, для яких характерна цис- і транс-ізомерія. Прикладом стереохімічної специфічності є фумаратгідратаза. Вона каталізує приєднання води до фумарової кислоти, але не впливає на цис-ізомер – малеїнову кислоту:
Групова абсолютна специфічністьхарактерна для ферментів, які діють на різні субстрати, що мають однаковий тип зв’язку. Прикладом абсолютної групової специфічності може бути дія пепсину на різні білки (прості і складні) тваринного, рослинного і мікробного походження. До ферментів з груповою специфічністю належать також естерази, які каталізують гідролітичне розщеплення зв’язку складноефірного типу:

Відносну групову специфічність проявляють лужна і кисла фосфатази, які каталізують гідроліз моноефірів ортофосфорної кислоти. Зустрічається подвійна специфічність, наприклад, ксантиноксидаза, яка специфічно окислює пуринові основи і неспецифічно – альдегіди. Іноді подвійна специфічність позначається на механізмі реакції між субстратом і ферментом. Так, ізоцитратдегідрогеназа залежно від умов викликає або декарбоксилування, або окислення ізоцитрата.
Активатори і інгібітори ферментів. На активність ферментів впливає багато речовин. Деякі з них підвищують активність ферментів, інші – гальмують. Перші речовини називають активаторами, другі – інгібіторами, або паралізаторами. Нерідко одні і ті ж речовини для одних ферментів можуть бути активаторами, для інших – інгібіторами. Так, соляна кислота є активатором для пепсину і інгібітором для амілази слини. Активність ферменту зменшується у міру збільшення концентрації продуктів, що утворюються в результаті хімічних реакцій та каталізуються даним ферментом.
Розрізняють специфічні і неспецифічні активатори і інгібітори. Прикладом специфічного активатора для пепсину є соляна кислота, для трипсину – ентеропептидаза. Під їх впливом від молекули попередника (пепсиногена і трипсиногена) відщеплюється пептид, відкривається активний центр і формується молекула ферменту. Пептиди, що відщепилися, можна розглядати як специфічні інгібітори. До типових специфічних активаторів слід віднести жовчні кислоти, що активують ліпазу. Типовими специфічними інгібіторами є антиферменти – антипепсин, антитрипсин та ін. Багато лікарських речовин відносяться до специфічних інгібіторів, оскільки вони, з’єднуючись з ферментами мікроорганізмів, блокують їх (білий стрептоцид і ферменти стрептокока).
До неспецифічних активаторів відносяться різні неорганічні катіони (табл. 2), рідше – аніони: Na+, K+, Ca2+, Mg2+, СІ– та ін. Вплив катіонів на ферменти більш специфічний, ніж аніонів. Деякі іони для одних ферментів є активаторами, для інших – інгібіторами (наприклад, Ca2+ – активатор для лужної фосфатази і інгібітор для гліцил-лейцин-дипептидази). В активації або гальмуванні ферменту може брати участь один або декілька видів іонів.
До неспецифічних інгібіторів відносяться ферментні отрути (HCN, KCN, NaCN), іони важких металів, алкалоїдні реактиви, азиди, флуориди, сульфіди та ін. Інгібітори взаємодіють з активними центрами молекули ферменту, інактивуючи функціональні групи білків. Вони можуть взаємодіяти з металами, що входять до складу молекул ферментів і фермент-субстратних комплексів. Високі концентрації інгібіторів руйнують четвертну і третинну структуру молекули ферменту, викликаючи його денатурацію.
Таблиця 2.
