
- •Редактор Л.М. Тонкошкур
- •УДХТУ, 49005, Дніпропетровськ-5, просп. Гагаріна, 8.
- •Основні характеристики ковалентного зв’язку:
- •Таблиця 1.1
- •Характеристика ковалентних зв'язків
- •Нітроген, пірамідальна будова
- •Оксиген, кутова будова
- •Теорія хімічної будови органічних сполук О.М. Бутлерова
- •Класифікація в залежності від будови вуглецевого ланцюга
- •СПОСОБИ ОДЕРЖАННЯ АЛКАНІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКАНІВ
- •СПОСОБИ ОДЕРЖАННЯ АЛКЕНІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКЕНІВ
- •Швидкість приєднання галогеноводнів зменшується в ряду НI > НBr > НCl > НF відповідно із зменшенням міцності зв’язку Н-Hlg.
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКАДІЄНІВ
- •Природний каучук: цис-1,4-поліізопрен. Гутаперча: транс-1,4-поліізопрен
- •СПОСОБИ ОДЕРЖАННЯ АЛКІНІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКІНІВ
- •АЛІЦИКЛІЧНІ СПОЛУКИ
- •Циклоалкани. Класифікація, номенклатура та ізомерія
- •Сучасні уявлення про будову циклоалканів
- •СПОСОБИ ОДЕРЖАННЯ ЦИКЛОАЛКАНІВ
- •Спеціальні методи
- •ХІМІЧНІ ВЛАСТИВОСТІ ЦИКЛОАЛКАНІВ
- •АРОМАТИЧНІ ВУГЛЕВОДНІ
- •СПОСОБИ ОДЕРЖАННЯ БЕНЗОЛУ ТА ЙОГО ГОМОЛОГІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ
- •ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
- •ПЯТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
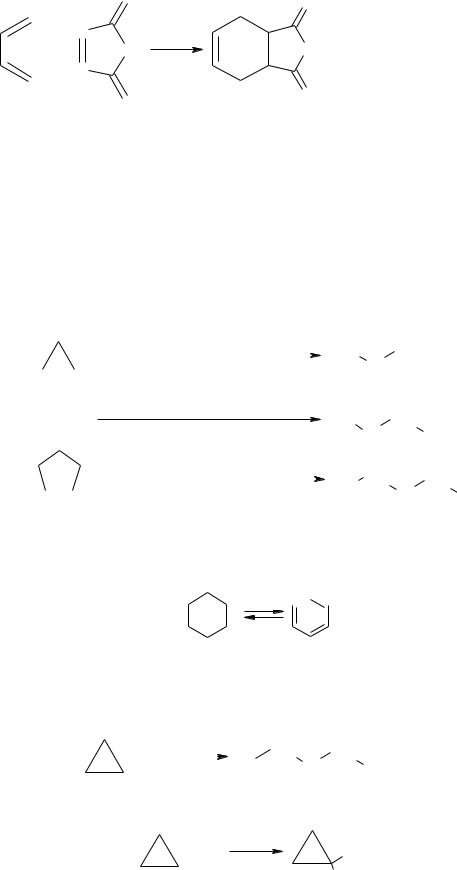
|
O |
52 |
|
O |
|
|
|
|
|
HC |
O Ангідрид 1,2,3,6-тетрагідрофталевої кислоти |
+ |
O |
|
|
HC |
|
1,3-бутадієн |
O |
O |
ХІМІЧНІ ВЛАСТИВОСТІ ЦИКЛОАЛКАНІВ
Хімічні властивості циклоалканів, в основному, визначаються розмірами циклу. Три- і чотиричленні цикли нестійкі і легко руйнуються. Тому для них характерні реакції приєднання, які супроводжуються розривом циклу.
а) реакції з воднем:
|
|
|
|
|
|
|
80 °C |
CH3 |
CH |
|
пропан |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
циклопропан |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
+ H2 / Pd |
200 °C |
CH3 |
CH |
|
бутан |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
CH |
|
циклобутан |
|
|
|
|
|
|||||||
|
|
|
|
|
3 |
|
||||||
|
|
|
|
|
|
|
300 °C |
|
CH2 |
CH |
|
|
|
|
|
|
|
|
|
|
|
H3C |
пентан |
||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
CH2 |
2 |
||
|
|
|
|
|
|
|
|
CH |
||||
циклопентан |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
3 |
Циклогексан при нагріванні з каталізаторами (Pt, Pd) піддається дегідруванню і перетворюється на бензол:
300 °C 
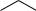
циклогексан
+3 H2
Pd
б) реакції з галогенами:
Циклопропан приєднує бром і йод з розривом циклу:
+ X2 |
t ° |
CH2 |
CH2 |
(де X = Br, I) |
|
|
X |
||||
|
|
CH2 |
|
X |
|
З хлором циклопропан вступає переважно в реакцію заміщення:
+ 2 Cl2 |
t ° |
+ 2 HCl |
Cl |
Cl
Циклобутан приєднує бром при нагріванні. Реакція супроводжується розривом циклобутанового кільця.
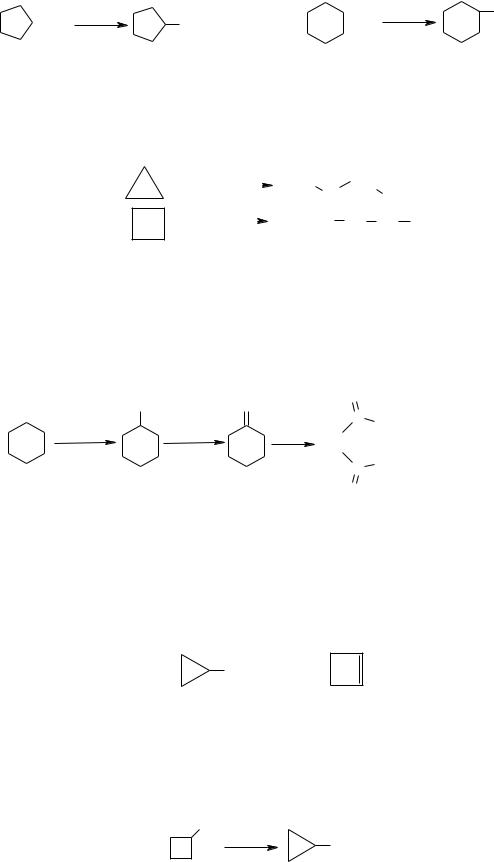
53
П’яти- і шестичленні циклоалкани вступають з галогенами в реакції заміщення:
+ Br2 |
t° |
Br + HBr |
t° |
Cl + HCl |
|
+ Cl2 |
|
в) реакції з галогеноводнями:
Малі цикли приєднують галогеноводні, а також інші сильні кислоти. Цикли при цьому розриваються і утворюються відповідні галогенопохідні насичених вуглеводнів:
+ HBr |
|
|
|
CH3 |
CH2 |
|
|
||
|
|
|
|
|
|||||
|
|
|
|
|
|
CH2 |
Br |
||
+ HI |
|
|
|
H3C |
|
CH2 |
CH2 |
CH2 |
I |
|
|
|
|
||||||
г) окислення.
Під дією HNO3, кисня при наявності каталізаторів відбувається окислення циклоалканів. Практичне значення має окислення циклогексану до адипінової кислоти
– вихідного продукту для виробництву найлону:
|
OH |
O |
O |
|
|
C |
|
||
O2, Co2+ |
O2 |
O2 |
OH адипінова (гександіова) |
|
|
|
|
(CH2)4 |
OH кислота |
циклогексанол |
циклогексанон |
C |
||
O |
|
|||
|
|
|
|
|
д) взаємні перетворення циклів.
Дегідратація спиртів аліціклічного ряду часто супроводжується перегрупуванням. Якщо гідроксильна група знаходиться в боковому ланцюгу у α-вуглецевого атома, то відбувається розширення цикла:
H2SO4
CH2OH  циклопропілкарбінол циклобутен
циклопропілкарбінол циклобутен
Дегідратація циклопентанола в деяких випадках супроводжується звуженням циклу. Циклобутанол під дією кислот частково може перетворюватись у циклопропілкарбінол:
OH H+
CH2OH
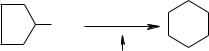
54
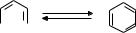
При нагріванні з хлористим алюмінієм наступає рівноважна ізомеризація між вуглеводнями циклопентанового і циклогексанового ряду (М.Д. Зелінський, О. Атан, К. Неніцеску):
CH3 |
AlCl3 |
|
t° |
||
цикло п ен тилм етан |
||
цикло гексан |
55
АРОМАТИЧНІ ВУГЛЕВОДНІ
До ароматичних сполук відносяться бензол та інші сполуки, які нагадують його за хімічними властивостями. Бензол має особливі властивості, які відрізняють його від аліфатичних вуглеводнів: аліфатичні ненасичені вуглеводні головним чином вступають в реакції приєднання, аліфатичні насичені вуглеводні – в реакції вільно-радикального заміщення, а ароматичні вуглеводні – головним чином в реакції йонного заміщення.
Основний представник ароматичних сполук – бензол – вперше виділив у 1825 році Фарадей із світильного газу. Його хімічні властивості вивчені краще, ніж будь-якої іншої органічної сполуки. Незважаючи на це, лише у 1931 році була запропонована задовільна структура для бензолу, яка згодом стала загальноприйнятою.
У 70-х роках ІХ століття було вже відомо, що бензол має молекулярну формулу С6Н6. у 1865 році Кекуле запропонував зображати структурну формулу бензолу у вигляді 6-членного циклу з трьома подвійними зв’язками. Але ця формула не пояснювала основні хімічні властивості ароматичних сполук, завдяки яким вони і були виділені в особливий клас. Ці властивості і становлять хімічні критерії ароматичності:
1.Легкість утворення ароматичних сполук в різноманітних реакціях:
2.Стійкість до дії слабких окиснювачів на відміну від ненасичених сполук:
3.Інертність до реакцій електрофільного приєднання:
4.Легкість реакції електрофільного заміщення:
5.Атоми і групи атомів, які сполучені з бензольним ядром набувають особливих властивостей: феноли значно більш сильні кислоти, ніж
спирти, а анілін слабкіша основа, ніж аліфатичні аміни.
Ця формула не пояснювала також, чому немає ізомерів у 1,2-дизаміщенних
похідних бензолу, наприклад 
56
Тому у 1872 р. Кекуле запропонував осциляційну гіпотезу, згідно з якою подвійні карбон-карбонові зв’язки в бензольному ядрі не закріплені, а безперевно переміщуються (осцилюють) у кільці молекули. Ця гіпотеза дозволила пояснити, чому немає двох ізомерів о-ксилолу, що було доказано раніше його озонолізом.
|
|
|
|
|
|
3O3 |
+ 3H2O |
+ 2 CH3COCHO |
|||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OHC |
|
CHO |
|
|
|
|
|
|
|
|
- |
3H2O2 |
|
||||||
|
|
|
|
|
|
3O3 |
+ 3H2O |
|
|||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 CH3COCHO + CH3COCOCH3 |
|||
|
|
|
|
|
|
|
|
- 3H2O2 |
|
||||||
|
|
|
|
|
|
|
В дійсності |
|
|||||||
3O |
3 |
+ |
3H |
O |
|
|
|
CHO + 2 CH3COCHO + CH3COCOCH3 |
|||||||
|
|
|
|
|
|
2 3OHC |
|
||||||||
|
|
|
- 3H2O2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Але осциляційна гіпотеза не пояснювала інших хімічних аномалій бензолу. Сучасні дані також не підтверджують осциляційну гіпотезу.
Фізичні критерії ароматичності. Вирішальне значення для становлення структури бензолу мали фізичні методи дослідження. Було встановлено, що:
1.Молекула бензолу являє собою плоский правильний шестикутник з валентним кутом 1200. Довжина всіх карбон-карбонових зв’язків однакові і дорівнюють 0,14 нм і мають приблизно середнє значення
між довжинами простих (0,154 нм) т подвійних (0,134 нм) карбонових зв’язків. Порядок зв’язків С-С в бензолі 1,67. Довжини всіх зв’язків С-Н також однакові і становлять 0,108 нм.
2.Молекула бензолу симетрична і має вісь шостого, а не третього порядку, як випливає з формули Кекуле
3.Бензол є неполярною сполукою. Отже, ядра атомів та валентні електрони в молекулі бензолу розміщені симетрично.
4.Теплота гідрування бензолу значно менша, ніж слід було очікувати при гідруванні структури Кекуле. Так, теплота гідрування циклогексену 119,7 кДж/моль. Відповідно, при гідруванні структури Кекуле повинно було виділитись в три рази більше теплоти 359,1 кДж/моль. В дійсності виділяється лише 208,4
57
кДж/моль, тобто на 150,7 кДж/моль менше. Відповідно, енергія бензолу менша від енергії циклогексатрієну – 1,3,5 на цю ж величину. Тобто, бензол стабільніший від циклогексатрієну на 150,7 кДж/моль. Отже, бензол є термодінамічно стійкою сполукою і утворення його відбувається енергетично вигідно. Різниця між теоретичною енергією циклогексатрієнуж-1,3,5 та енергією бензолу називається енергією стабілізації, енергією спряження або енергією резонансу бензолу. Взагалі основними фізичними критеріями ароматичного характеру органічних сполук є їх підвищена енергетична стійкість, тобто зменшення енергії при утворенні циклічної системи із аліциклічної спряженої системи з тим же числом атомів карбону та π-електронів. Якщо при переході від ациклічної спряженої системи до циклічної з тим же числом π- електронів енергія системи не змінюється, цикл є неароматичним, якщо ж енергія системи підвищується, то цикл є анти ароматичним.
Але як а priori без фізичних досліджень можна визначити, який характер має та чи інша сполука – ароматичний, неароматичний чи антиароматичний?
Для цього існує правило кола. Якщо циклічну систему, що складається з k-атомів, які не знаходяться у sp3-гібридизації, вписати у вигляді k-кутника в коло таким чином, щоб одна із вершин знаходилась в нижній точці, тоді число вершин k-кутника відповідає числу π-МО системи, а проекція цих вершин на вісь ординат – відносним енергіям цих π-МО. При цьому π-МО, розташовані нижче центру кола, є π- зв’язуючими, розташовані на рівні центру кола - π- незв’язуючими, вище центру кола - π- розпушуючими. Якщо в циклічній системі, в якій жоден атом не знаходиться у sp3-гібридизації, зайняті π- електронами лише зв’язуючи π-МО, то ця система повинна бути ароматичною. Якщо ж зайнятими є не лише π- зв’язуючи, а й π-незв’язуючи, а тим більше π- розпушуючи МО, то система повинна бути антиароматичною.
Квантово-хімічні критерії ароматичності. Правило Хюккеля.
Ароматичні властивості має будь-яка плоска моно циклічна сполука, в якій всі
58
атоми знаходяться у sp2-гібридизації, а цикл містить 4n+2 π-електронів, де n – будь-яке число натурального ряду – 0, 1, 2, 3 тощо. Якщо така система має 4n π- електронів, вона анти ароматична, якщо ж система не плоска, то незалежно від кількості π-електронів вона не ароматична.
Бензол є типовим прикладом ароматичної системи з n=1, тобто має секстет π-електронів. Розглянемо цю систему пильніше.
π |
− |
MO + |
|
|
- |
|
+ |
|
|
|
+ |
|
E |
|
+ |
- |
+ |
- |
+ |
- - |
- |
||||
|
+ |
- |
- - |
|
||||||||
|
|
+ |
+ |
+ |
+ |
+ |
- - |
- |
- |
+ + |
|
+ |
|
|
+ |
|
|
+ |
|
+ |
|
|
|
- |
|
В молекулі бензолу всі атоми карбону знаходяться у sp2-гібридизованому стані і при цьому дві sp2-гібридизовані орбіталі витрачаються на утворення двох σ- зв’язків С-С, одна sp2-гібридизована орбіталь – на утворення σ- зв’язку С-Н. Шість р-орбіталей, в результаті взаємодії між собою утворюють шість π- МО: три зв’язуючих та 3 розпущуючих. На зв’язуючих π-МО знаходяться шість π-електронів, на розпушуючих – жодного. При цьому найстійкіша за енергією зв’язуюча π-МО охоплює все бензольне ядро, в цій π-МО можливе кільцеве переміщення π-електронів. Всі атоми і зв’язки С-С таким чином рівноцінні. Розглядаючи ще дві вище розташовані π-МО, приходимо до такого ж висновку. Тобто в молекулі бензолу немає взагалі локалізованих подвійних зв’язків і
молекулу краще всього зображати такою формулою |
. |
|
Окрім бензолу існують і інші ароматичні сполуки, які мають в циклі лише |
||
атоми карбону? |
|
|
1. Аннудени: |
|
|
циклодекапентанен, |
аннулен-18, |
|
плоский, |
||
не плоский, хоча |
||
ароматичний |
||
має 10 π -електронів |
||
|
||
59
2.Карбоцикли, гомо ароматичні системи – це заряджені частини (аніони та катіони), які мають ароматичний характер, тоді як відповідні незаряджені структури мають 4n π-електронів і відповідно неароматичний характер.
a. Циклопропенілій – катіон:
Ph |
|
|
|
Ph |
Ph BF4- |
|
|
CN |
+ HBF4 |
|
+ |
+ HCN |
|||
Ph |
|
|
|
|
|
|
|
Ph |
|
|
|
Ph |
|
|
|
b. Циклопентадієніл-аніон: |
|
|
|
|
|
||
+ K |
- |
K+ |
+ 1/2 H2 |
pKa=15 |
|||
+ CH3MgBr |
- |
+ |
|
|
|
||
MgBr + CH4 |
|
||||||
c. Ферроцен: |
|
|
|
|
|
|
|
|
+ |
|
|
- |
|
|
|
2 - |
+ FeCl2 |
|
Fe2+ |
|
+ 2MgBrCl |
||
MgBr |
|
|
|||||
|
|
|
|
- |
|
|
|
d. Тропілій –катіон: |
|
|
|
|
|
|
|
HH |
+ |
AlCl3 |
|
+ HAlCl3 |
- |
pKa=36 |
|
3.Гетероцикли – цикли, які містять в своєму складі інші атоми, крім карбону, також можуть бути ароматичними за рахунок включення в π- систему електронів гетеро атомів: фуран, пірол, тіофен тощо.
4.Поліциклічні ароматичні системи: нафталін, тощо.
АРОМАТИЧНІ ВУГЛЕВОДНІ РЯДУ БЕНЗОЛУ
Бензол є першим членом гомологічного ряду ароматичних вуглеводнів, склад яких відповідає формулі CnH2n-6. Гомологічна різниця, як і раніше, становить (СН2)n.
