
3. Фізичні властивості.
При кімнатній температурі
алкани С1-С4
– гази, С5-С16
– рідини, а починаючи із С17
– тверді речовини. Із збільшенням
молекулярної маси температури плавлення
та кипіння.
зростають. Вуглеводні із парним числом
атомів карбону у гомологічному ряду
(моноклінна кристалічна решітка)
плавляться вище, ніж сусідні вуглеводні
із непарним числом атомів карбону
(ромбічна кристалічна решітка). Густина
![]() повільно зростає від 0,6261 (С5)
до 0,8097 (С30),
табл. 4.1.
повільно зростає від 0,6261 (С5)
до 0,8097 (С30),
табл. 4.1.
4. Будова алканів.
В алканах атоми карбону знаходяться у першому валентному стані (sp3-гібридизація). Орбітальну будову молекул метану та етану наведено на рис. 4.1.

Рис. 4.1. Орбітальна будова метану та етану.
-зв’язок в алканах утворюється при перекриванні s, p і гібридних sp3-орбіталей вздовж осі, що з’єднує ядра двох атомів (осьова симетрія), а -зв’язок – при бічному перекриванні р-орбіталей вздовж площини, що проходить через ядра двох атомів (площинна симетрія). При цьому необхідно відмітити, що sp3-гібридна орбіталь має тетрагональну (тетраедричну будову).
Характеристики хімічних зв’язків С–С та С–Н наведено в табл. 4.2.
Таблиця 4.2
Характеристики хімічних зв’язків в молекулах алканів.
|
Характеристика Зв’язок |
Довжина,l (нм) |
Енергія, Е (кДж/моль) |
Полярність, (D) |
Поляризовність, RD (см3) |
|
С–С |
0,154 |
336 |
0,0 |
1,296 |
|
С–Н |
0,109 |
410 |
0,3 |
1,676 |
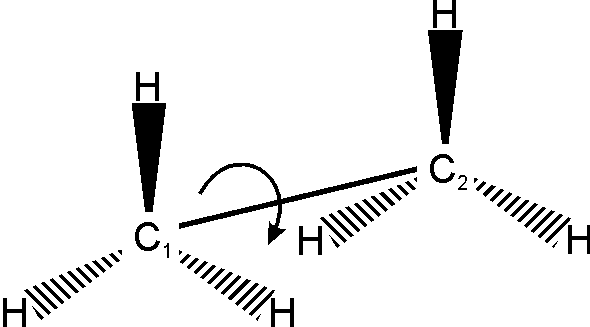
Конформаційна ізомерія має місце при вільному обертанні атомів або окремих груп атомів навколо -зв’язку:
|
|
При цьому утворюються два найбільш стабільні конформери „загальмованої” та „затуленої” форми:
“загальмована” форма “затулена” форма |
При обертанні навколо зв’язку С1-С2, наприклад, у молекулі етану, виникає відштовхування однакових атомів гідрогену. Виходячи із цього посилання, енергетично більш вигідною є “загальмована” форма (мінімальне відштовхування між атомами гідрогену) у порівнянні із “затуленою” формою, де це відштовхування максимальне. Енергетичний бар’єр ротації однієї форми в іншу незначний – 12 кДж/моль, що у порівнянні майже дорівнює енергії водневого зв’язку або енергії теплового руху молекул. Тому при звичайній температурі конформаційні ізомери розділити неможливо.
5. Хімічні властивості.
Алкани, у порівнянні із іншими класами органічних сполук, мають низьку реакційну здатність: при звичайних умовах не реагують із концентрованою сульфатною кислотою, лугами та сильними окисниками. Це можна пояснити міцністю -зв’язків та їх схильністю до гомолітичного розщеплення. Таким чином, можна зробити деякі висновки щодо реакційної здатності алканів:
для цих сполук мають бути характерними реакції заміщення (розрив зв’язку С–Н) та реакції розщеплення (розрив зв’язку С–С);
ці реакції повинні проходити в досить жорстких умовах (t°C,P,h, ініціатор);
враховуючи низьку полярність зв’язків С–Н та С–С, для них повинен бути характерним гомологічний розрив зв’язків.
5.1. Галогенування алканів під дією галогенів проходить із утворенням моно- та полігалогенопохідних алканів.
Загальна схема утворення монопохідних галогеноалканів:
![]()
Швидкість реакції в залежності від природи алкану зменшується у ряду: третинний > вторинний > первинний, а в залежності від природи галогену у наступній послідовності: F2 (з вибухом) > Cl2, Br2 (опромінювання світлом або t300°C) >> I2 (практично не взаємодіє без застосування спеціальних йодуючих агентів, наприклад, (СН3)3С–ОІ).
Хлорування метану відбувається за схемою радикального заміщення (SR):

Механізм реакції (SR) ланцюгово-радикальний (М.М. Семенов, Нобелевський лауреат з хімії):

|
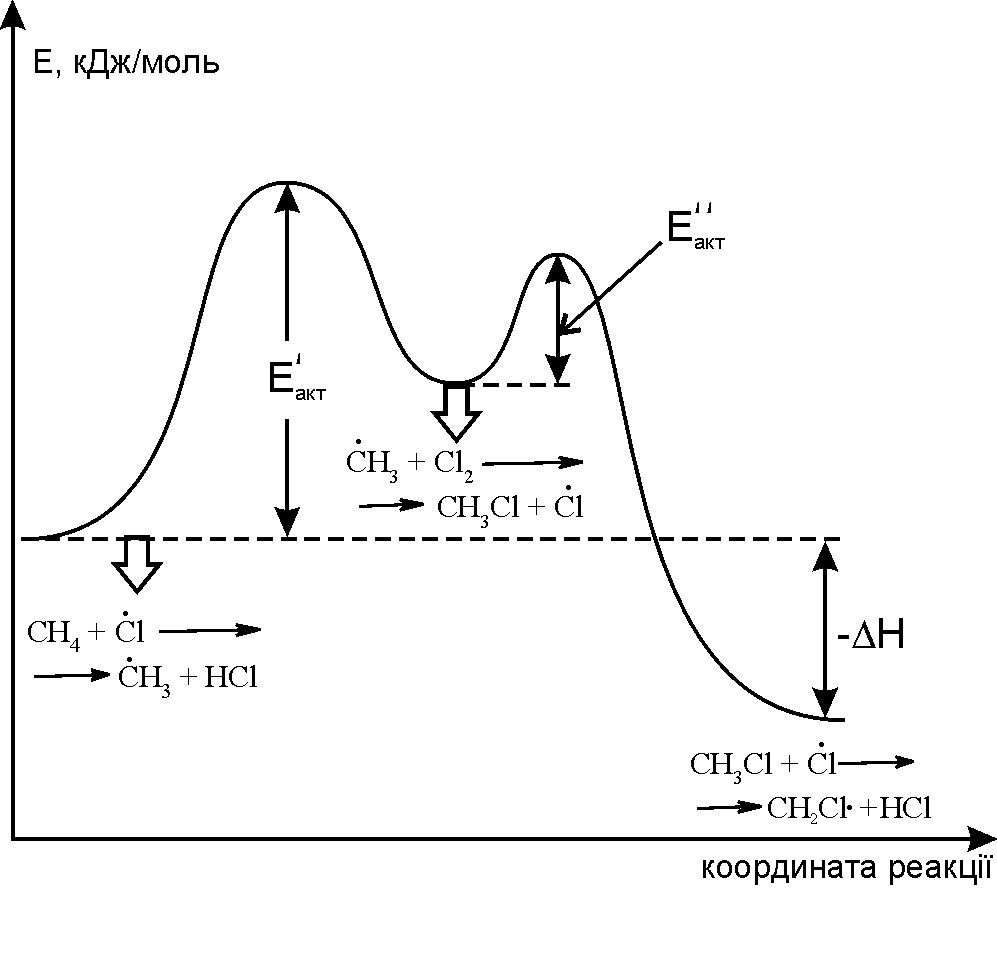
Рис. 4.2. Енергетична діаграма реакції хлорування метану. |
На рис.4.2 наведено енергетичну діаграму реакції хлорування метану. Реакція між метаном та хлором проходить при досягненні енергії активації – Е, подальша взаємодія метильного радикалу (СН3) та молекули хлору відбувається при досягненні енергії активації – Е з утворенням хлористого метила та активного радикала хлора. Галогенування різних алканів проходить селективно в залежності від їх будови та стабільності утворених радикалів: третинний > вторинний > первинний. При цьому їх термодинамічна стабільність визначається енергією дисоціації зв’язку С–Н, тобто енергією утворення вільних радикалів та ефективністю делокалізації при цьому заряду радикального центру (табл. 4.3). |
Таблиця 4.3.
Енергія дисоціації зв’язків С–Н в алканах та ряд стійкості радикалів.
|
Енергія дисоціації, кДж/моль |
425 |
406 |
395 |
375 |
|
Алкан |
Н3С–Н |
|
|
|
|
Алкіл-радикали (ряд стабільності) |
| |||
Можливість селективного галогенування закономірно пов’язана із природою галогену та швидкістю таких реакцій біля первинного, вторинного та третинного атома карбону (табл. 4.4).
Таблиця 4.4.
Швидкість реакції галогенування алканів різної будови.
|
Швидкість Реакція |
|
|
|
|
|
1,00 |
3,25 |
4,30 |
|
|
1,0 |
82,0 |
1600,0 |
У випадку взаємодії (супряження) неспареного електрону із -електронною системою (алкени, арени) стабільність таких радикалів набагато збільшується:
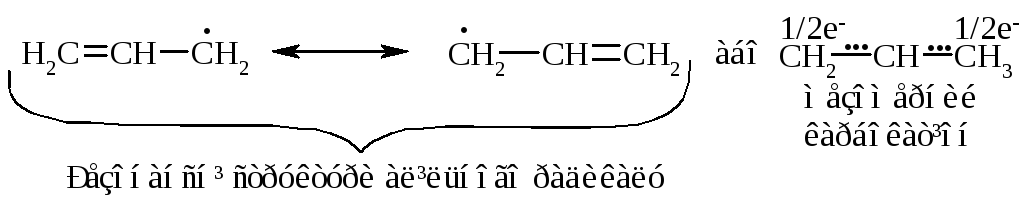
Кінетична стабільність радикалів зумовлена, в першу чергу, просторовими перешкодами, що впливає на їх реакційну здатність.
|
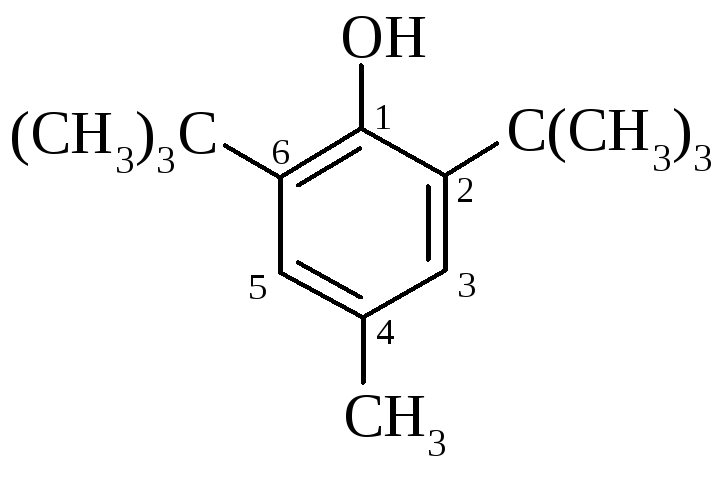
4-метил-2,6-ди-трет-бутилфенол (іонол) |
Так,
4-метил-2,6-ди-трет-бутилфенол має об’ємні
трет-бутильні радикали, що знаходяться
у о-положенні відносно гідроксильної
групи. У випадку утворення радикалу:
|
положення, іонол широко використовується у багатьох промислових сумішах (пластмаси, гуми, мастила, оливи тощо) як ефективний антиоксидант.
Розглянуті на прикладі реакції галогенування алканів теоретичні положення (природа субстрата та реагента, стабільність радикалів) будуть характерними і для інших реакцій, що відбуваються за радикально-ланцюговим механізмом (SR).
5.2. Нітрування алканів нітратною кислотою за звичайних умов не відбувається, а при нагріванні, як правило, іде їх окиснення. М.І. Коновалов, (1889 р.) встановив, що при нагріванні (~140°С) під дією розведеної нітратної кислоти відбувається нітрування алканів за радикальним механізмом (SR) із задовільним виходом кінцевих нітроалканів:
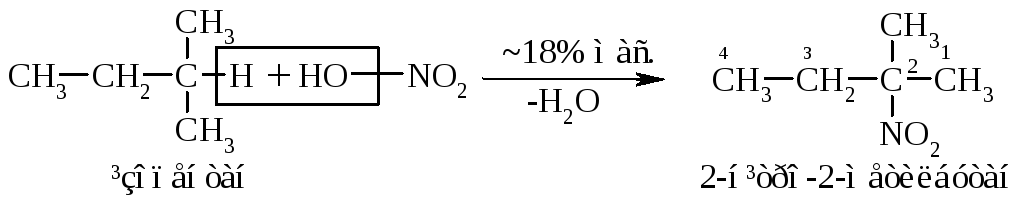
В таких умовах забезпечується селективність нітрування (ізопентан нітрується переважно по третинному атому карбону). Парофазне нітрування (N2O4;t400°C) не забезпечує селективності процесу нітрування.
Механізм реакції (SR):
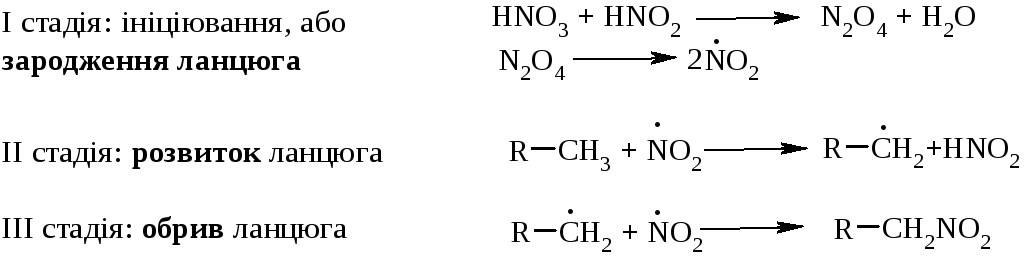
5.3. Сульфохлоруванняалканів проходить активно вже при кімнатній температурі за схемою:
![]()
Механізм реакції (SR):
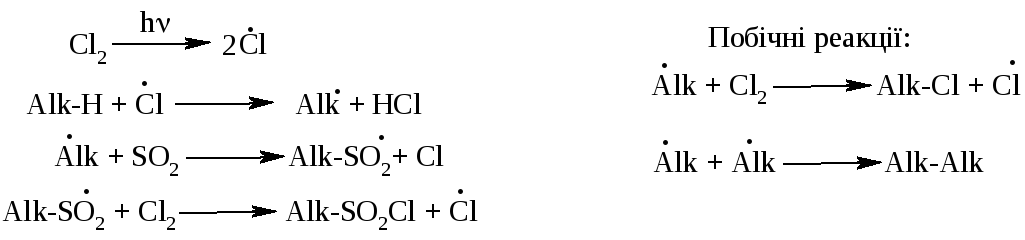
Реакцією сульфохлорування отримують суміш первинних та вторинних алкансульфохлоридів. Третинні алкансульфохлориди, внаслідок просторових перешкод, не утворюються.
Алкансульфохлориди є вихідними сполуками промислового виробництва поверхнево-активних речовин (ПАР), які використовують як миючі засоби:
![]()
5.4. Окиснення. Алкани як паливо горять із виділенням великої кількості теплової енергії (повне окиснення):
![]()
У випадку неповного окиснення (окисники: О2 повітря, KMnO4, K2Cr2O7; температура: ~150-200°С; каталізатор: MnO2, MnAc2) утворюється суміш кисневмісних вуглеводнів: спиртів, альдегідів, кетонів та карбонових кислот. Механізм реакції радикально-ланцюговий (SR):
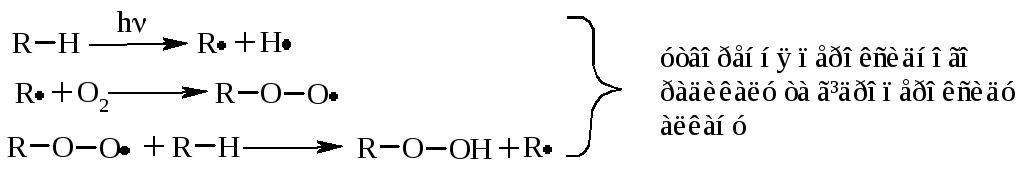
Стабільність гідропероксидів алканів в залежності від будови радикалу R змінюється у ряду: третинний > вторинний > первинний.
В залежності від будови гідропероксиду алкану ROOH утворюються різні продукти реакції.
Первинні гідропероксидипри дисоціації зв’язку О–О утворюють алкілоксирадикали, які далі окиснюються за схемою:
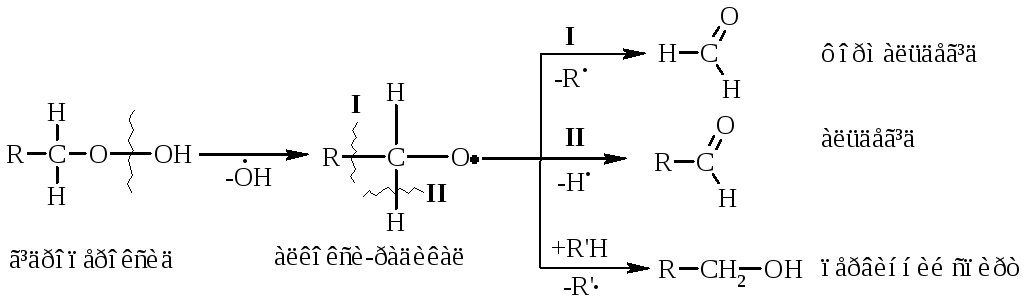
Вторинні гідропероксидиалканів утворюють при окисненні дещо інші продукти реакції:
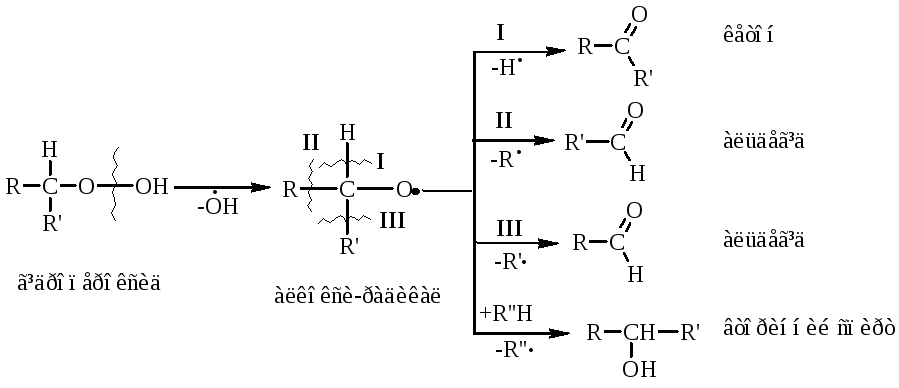
У випадку третинних гідропероксидів алканів реакція окиснення проходить за такою схемою:
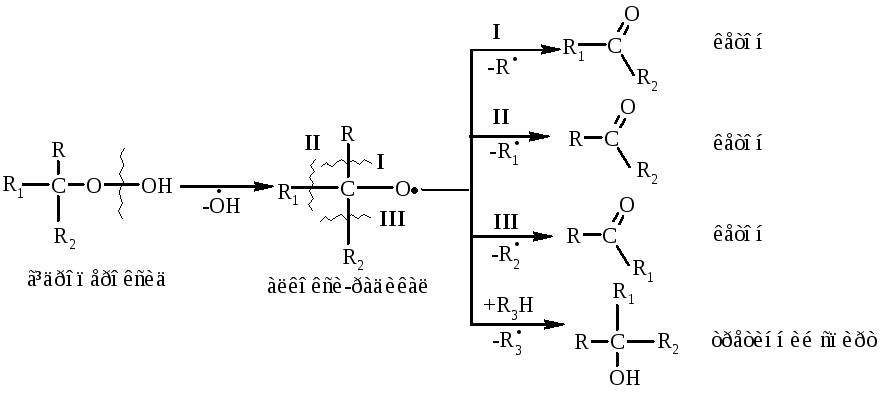
Особливості процесу окиснення:
гомолітичний розрив зв’язку С–С завжди проходить по -положенню відносно атома оксигену алкокси-радикалу (на схемах позначення І, ІІ, ІІІ);
спирти та альдегіди окиснюються далі до карбонових кислот або кетонів.

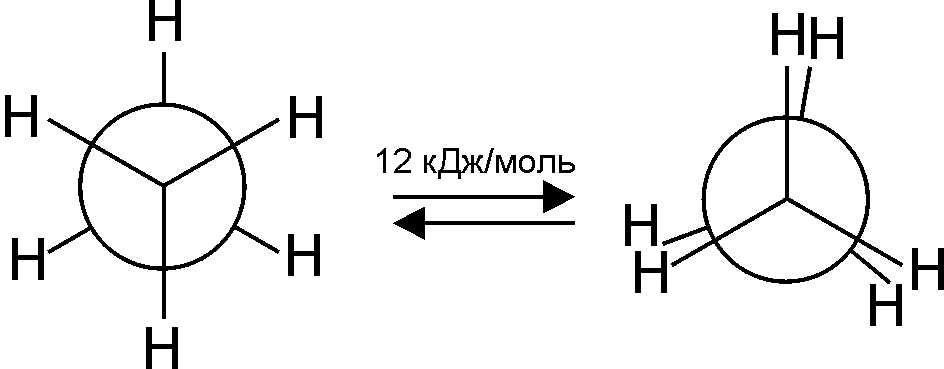
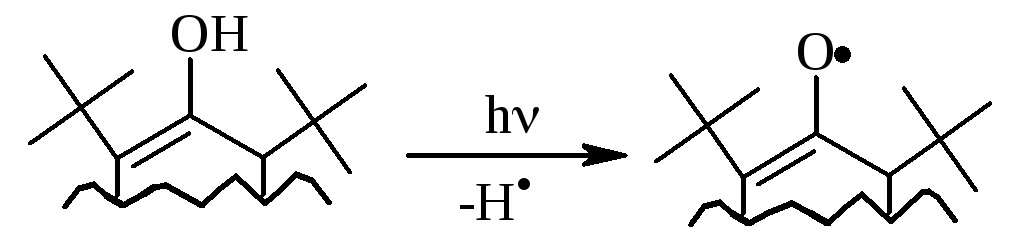 об’ємні трет-бутильні замісники
екранують атом оксигену та заважають
перебігу радикальних реакцій по цьому
реакційному центру. Виходячи із цього
об’ємні трет-бутильні замісники
екранують атом оксигену та заважають
перебігу радикальних реакцій по цьому
реакційному центру. Виходячи із цього