- •12. Галогенопохідні вуглеводнів
- •1. Класифікація. Номенклатура.
- •2. Методи отримання.
- •2.1. Пряме галогенування алканів (тема „Алкани”), sr:
- •2.2. Приєднання галогеноводнів до алкенів (тема „Алкени”)
- •2.3. Заміщення функціональних груп (–oh, –Hal) на галоген.
- •2.4. Одержання ароматичних галогенпохідних галогенуванням вуглеводневого радикалу або бензольного ядра.
- •3. Фізичні властивості.
- •4. Характеристика зв’язків вуглець–галоген с–Hal.
- •5. Хімічні властивості.
- •5.2. Реакції нуклеофільного заміщення галогена, пов’язаного з ароматичним ядром.
- •5.3. Реакції відщеплення (-елімінування).
- •6. Екологічні питання.
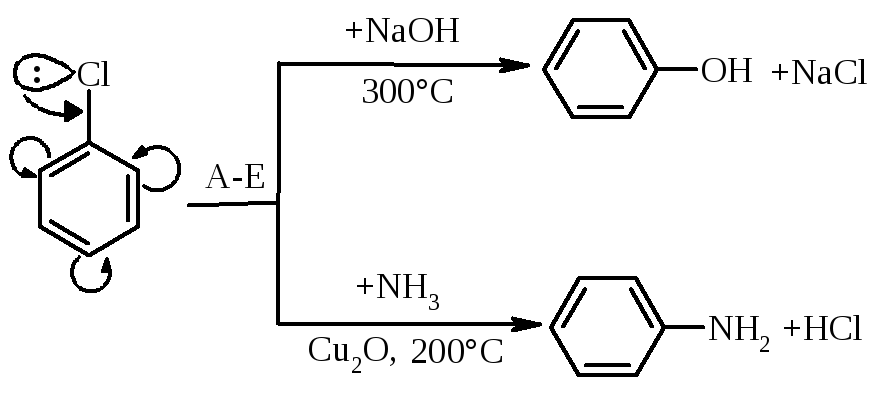
5.2. Реакції нуклеофільного заміщення галогена, пов’язаного з ароматичним ядром.
|
|
галоген в ядрі дуже малорухливий, тому галогенарени важко вступають у реакцію нуклеофільного заміщення SN. |
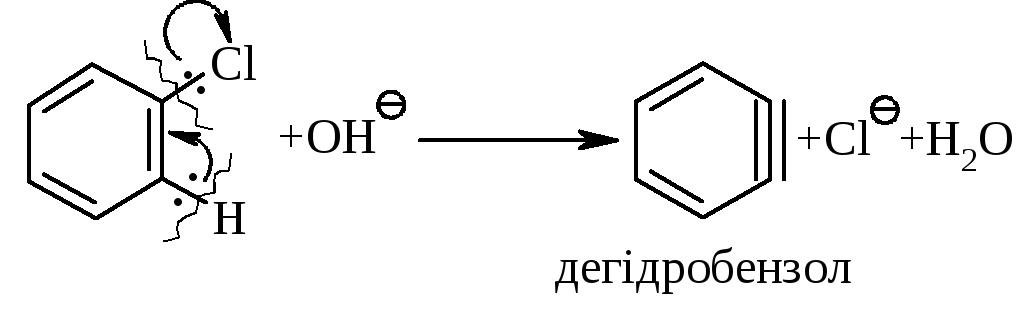
Механізм А-Е (відщеплення-приєднання):
|
Е2: повільна стадія |
|
Віттіг (1942 р.) та Робертс (1953 р.) показали, що при цьому утворюється дегідробензол, а сама реакція іде за механізмом А-Е. |
|
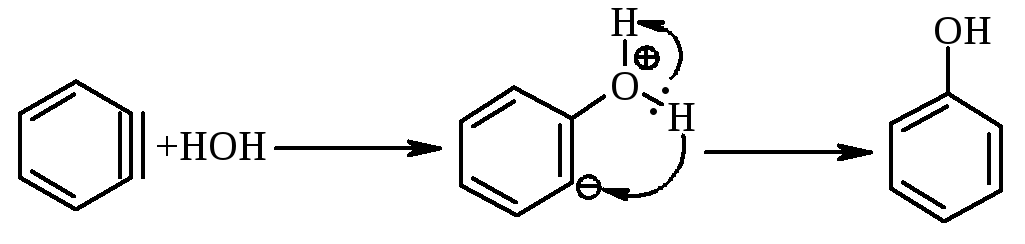
А: швидка стадія |
|
Це реакція 2го порядку: V=k[C6H5Cl][OH–].
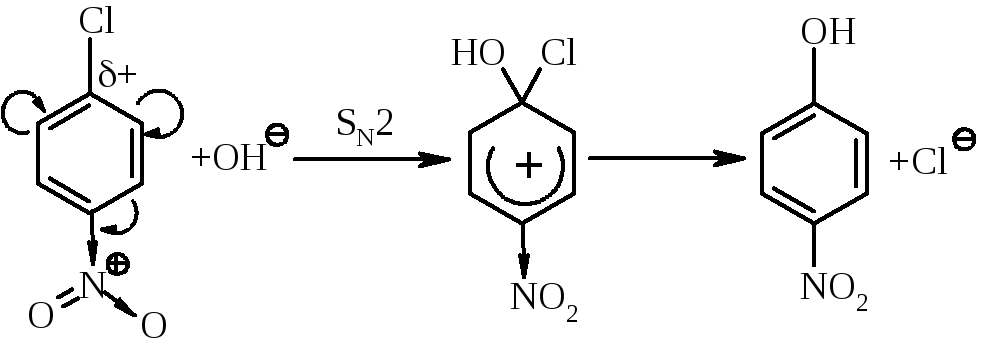
Введення до ароматичного ядра сильних акцепторів електронів (–NO2, –COOH, –CN) значно полегшує реакцію нуклеофільного заміщення, але при цьому змінюється її механізм:
|
|
Реакція йде за SN2-механізмом, при цьому роль сильного акцептора електронів, наприклад, NO2 полягає у збільшенні позитивного заряду + на атомі карбону, що безпосередньо пов’язаний із галогеном. |
5.3. Реакції відщеплення (-елімінування).
Відщеплення (-елімінування) – це реакція, що зворотна реакції приєднання по подвійному зв’язку:

В залежності від природи субстрата і умов протікання реакції вона може йти за механізмом Е2 або Е1.
Механізм Е2 (бімолекулярна реакція елімінування). Реакція характерна для первинних галогеналканів.
Загальна схема реакції:
![]()
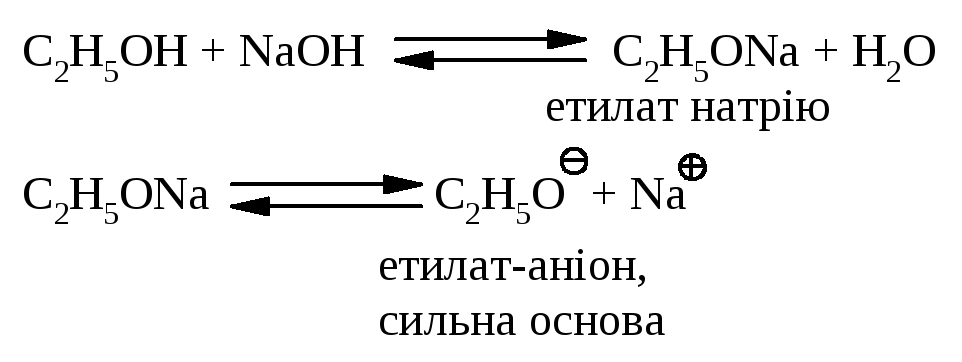
Реакція йде в присутності нуклеофільних реагентів, що мають високу основність: спиртовий розчин лугу (C2H5OH + NaOH), алкоголяти лужних металів (RONa). Швидкість реакції збільшується при підігріванні реакційної маси, або при використанні більш концентрованих розчинів.
Механізм реакції:
|
|
|
утворення нуклеофільного реагента, що має високі основні властивості |
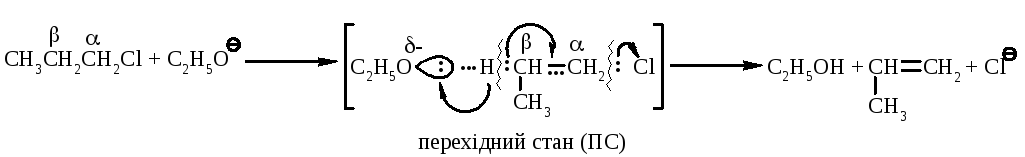
Нуклеофіл (C2H5O–) атакує -положення галогеноалкана відносно зв’язку C–Cl. При цьому відбувається відщеплення гідрогена від -карбону, утворення подвійного зв’язку (алкена) та відщеплення хлорид-аніона за синхронним механізмом (одночасно).
Механізм Е1 (мономолекулярне елімінування). Реакція характерна для третинних галогенопохідних вуглеводнів.
Загальна схема реакції:
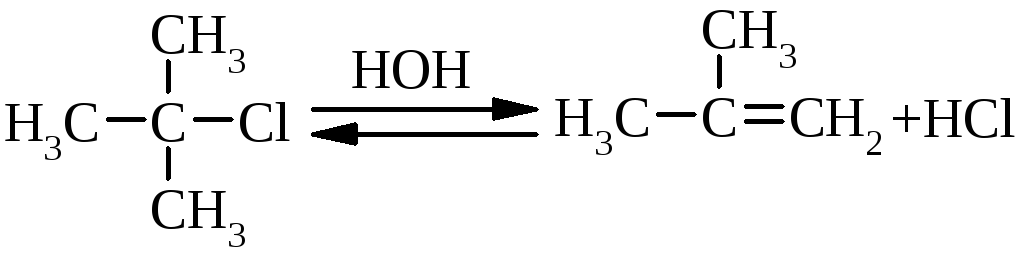
Реакція не потребує наявності
лугу як реагента, але при цьому обов’язковою
складовою є наявність іонізуючого
розчинника (диметилсульфоксида 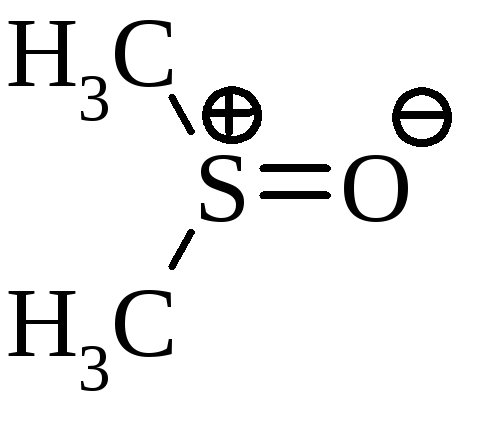 ,
диметилформаміда
,
диметилформаміда 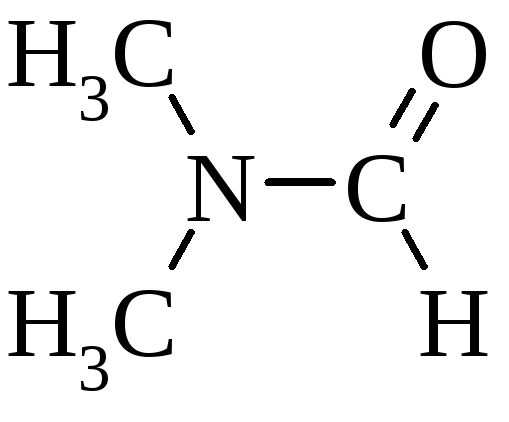 тощо), який міцно сольватує
протон.
тощо), який міцно сольватує
протон.
Механізм реакції:
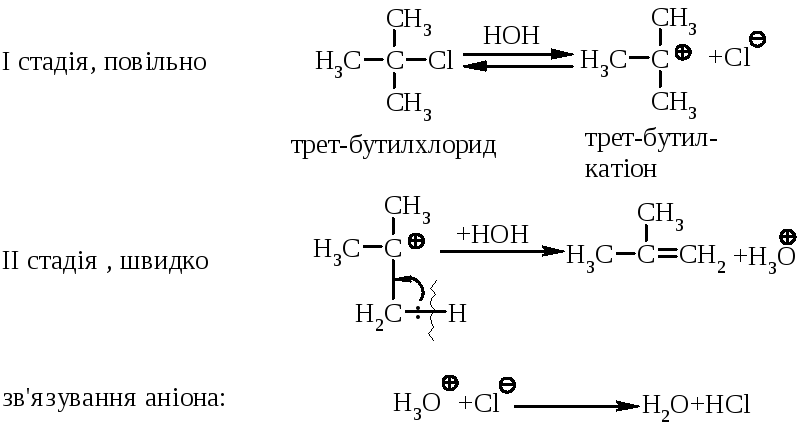
Реакція за механізмом Е1 є двохстадійною, а її швидкість відповідає рівнянню: V=k·[(CH3)3CСl].
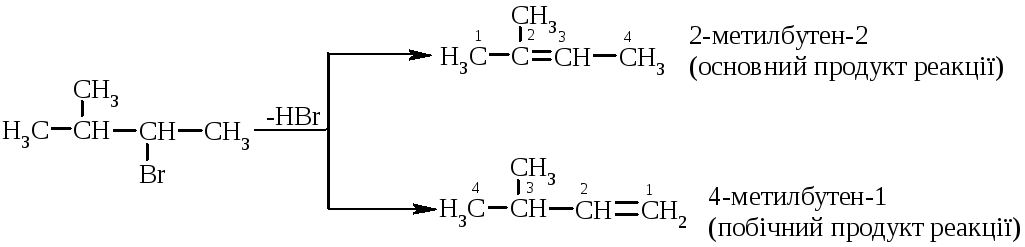
Необхідно відмітити, що відщеплення галогеноводню відбувається за правилом Зайцева:
|
|
гідроген відщеплюється разом із галогеном від сусіднього, найменш гідрогенізованого атома карбону. |
Порівняння умов протікання реакцій SN1, SN2, Е1 та Е2 наведено у табл. 12.5. Наведені дані наглядно свідчать, що реакції SN1 конкурують із реакціями Е1, тоді як реакції SN2 – із реакціями Е2, як це показано наступною схемою перетворень:
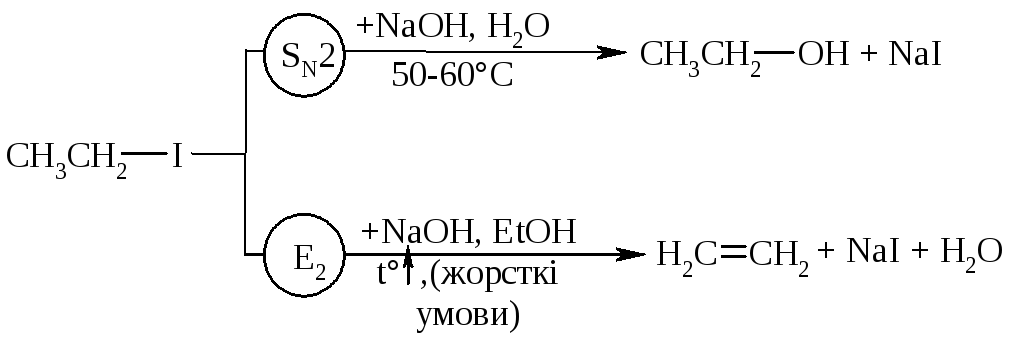
Таблиця 12.5.
Умови протікання реакцій заміщення (SN) та відщеплення (E) в галогеноалканах.
|
SN1 |
SN2 |
Е1 |
Е2 |
|
Третинний алкілгалогенід |
Первинний алкілгалогенід |
Третинний алкілгалогенід |
Первинний алкілгалогенід |
|
Слабкий нуклеофіл |
Сильний нуклеофіл |
Слабка основа |
Сильна основа |
|
Полярний розчинник |
Неполярний розчинник |
Полярний розчинник |
Неполярний розчинник |
Загальні висновки із табл. 12.5:
Реакції SN2 характерні для первиних алкілгалогенідів, особливо при дії сильних нуклеофілів в апротоних розчинниках при помірних температурах.
Реакції SN1 характерні для третиних алкілгалогенідів, особливо при дії слабких нуклеофілів в протоних розчинниках.
Для одержання аленів використовуют Е2 реакції, тому що вони проходять скоріше, з більшим виходами, не супроводжуються перегрупуванням в порівнянні з Е1 реакціями. Для здійснення реакцій Е2 використовують спиртовий луг та підвищену температуру (жорсткі умови).
Чим сильніша основа, тим більш імовірна реакція відщеплення (елімінування) Е2 типу в порівнянні з SN2 реакціями.
Підвищення температури збільшує долю продуктів відщеплення за рахунок зниження долі продуктів заміщення.
На відміну від реакції SN1 та SN2 реакційна здатність галогеноалканів для реакцій Е1 та Е2 зменшується у ряду третинні > вторинні > первинні.
5.3. Взаємодія галогенопохідних вуглеводнів з металами (Li, K, Na) була розглянута на прикладі реакції Вюрца (тема „Алкани”). До цього можна лише додати, що змінюючи умови реакції та використовуючи такі ж вихідні речовини можна отримати металоорганічні сполуки:
![]()
При використанні магнію утворюються магнійорганічні сполуки (реактиви Гріньяра):
![]()
які дуже поширені при синтезі багатьох класів органічних сполук лабораторними методами.