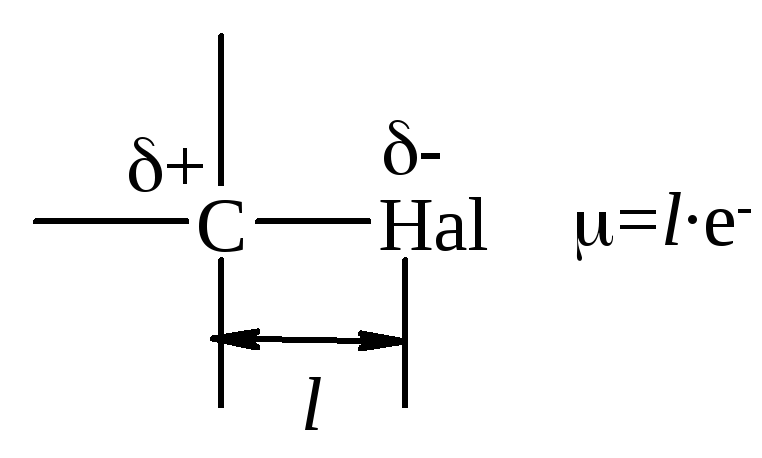- •12. Галогенопохідні вуглеводнів
- •1. Класифікація. Номенклатура.
- •2. Методи отримання.
- •2.1. Пряме галогенування алканів (тема „Алкани”), sr:
- •2.2. Приєднання галогеноводнів до алкенів (тема „Алкени”)
- •2.3. Заміщення функціональних груп (–oh, –Hal) на галоген.
- •2.4. Одержання ароматичних галогенпохідних галогенуванням вуглеводневого радикалу або бензольного ядра.
- •3. Фізичні властивості.
- •4. Характеристика зв’язків вуглець–галоген с–Hal.
- •5. Хімічні властивості.
- •5.2. Реакції нуклеофільного заміщення галогена, пов’язаного з ароматичним ядром.
- •5.3. Реакції відщеплення (-елімінування).
- •6. Екологічні питання.
2.4. Одержання ароматичних галогенпохідних галогенуванням вуглеводневого радикалу або бензольного ядра.
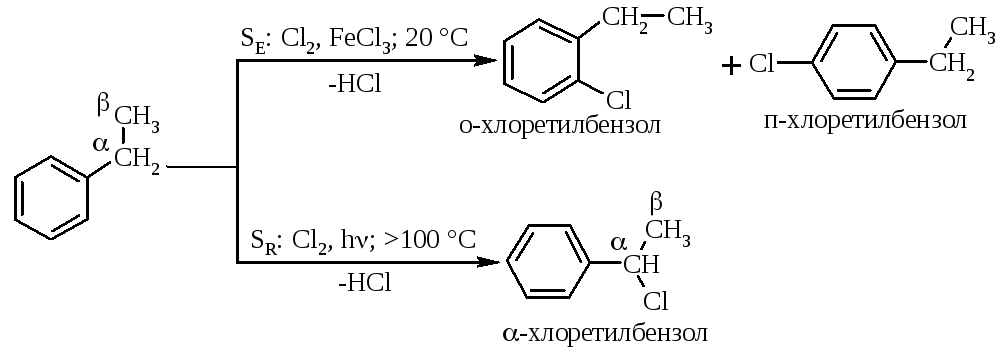
У випадку реакції за механізмом SE хлорування йде в ядро, а за SR – у -положення вуглеводневого радикалу.
3. Фізичні властивості.
Галогеновуглеводні мають полярні зв’язки С–Hal та значний дипольний момент. Вони є типовими діелектриками. Галогеновуглеводні мають низькі температури плавління та кипіння, малорозчинні у воді, але розчиняються у більшості органічних розчинників, мають характерний, трохи солодкуватий запах, розчиняють жири. Деякі фізичні властивості монопохідних галогеновуглеводнів наведені у табл. 12.1.
4. Характеристика зв’язків вуглець–галоген с–Hal.
Таблиця 12.2.
Фізико-хімічні характеристики зв’язку С–Hal.
|
|
Зв’язок |
Довжина, нм |
Енергія, кДж/моль |
Полярність, , D |
Поляризованість*, RD, см3 |
|
C–F |
0,140 |
486 |
2,19 |
1,72 | |
|
C–Cl |
0,177 |
327 |
2,27 |
6,53 | |
|
C–Br |
0,191 |
285 |
2,22 |
9,57 | |
|
C–I |
0,212 |
214 |
2,05 |
14,55 |
Примітка: * RD – атомна рефракція, яка розрахована з показника переломлення для D-лінії натрію. Гордон , Форд . Спутник химика. – М.: Химия,
Галогеналкани – полярні сполуки, для яких є характерним значний дипольний момент. Як видно із наведених значень у галогенпохідних вуглеводнів дипольних моментів та ступінь полярності тим вище, чим більша електронегативність галогену. Винятком є зв’язок C–F та C–Cl, що пояснюється збільшенням довжини зв’язку при переході від елемента другого період до елемента третього періоду.
Поляризованість збільшується закономірно зменшенню електронегативності галогенів. Хімічні властивості галогенопохідних вуглеводнів залежать як від поляризації, так і від поляризованості зв’язків і в першу чергу зв’язку С–Hal (табл. 12.3). Серед багатьох факторів, що впливають на поляризацію та поляризованість, слід прийняти до уваги такі, як природа галогена і типу гібридизації вуглеводневого радикала, атакуючої частинки, розчинника, умов каталізу, тощо (табл. 4).
Таблиця 12.3.
Енергія зв’язку С–Hal деяких галогенопохідних вуглеводнів.
|
Сполука |
Гібридизація „С” |
Енергія зв'язку, кДж/моль | |||
|
С-F |
С-Сl |
С-Вr |
С-І | ||
|
С2Н5Наl |
sp3 |
460,5 |
336,6 |
272,1 |
221,9 |
|
СН2=СН-Наl |
sp2 |
489,8 |
372,6 |
309,8 |
– |
|
СН2=СН-СННal |
sp3 |
- |
251,2 |
192,6 |
173,7 |
|
|
arom. |
510,7 |
347,4 |
297,2 |
265,4 |
|
|
sp3 |
– |
284,6 |
213,5 |
190,0 |
Довжина зв’язку С–Hal галогенопохідних вуглеводнів в залежності від природи галогену та його гібридизації наведена у табл. 12.4.
Таблиця 12.4.
Довжина зв’язку С–Hal в органічних сполуках.
|
Тип сполуки |
Довжина зв'язку C–X, нм |
Дипольний момент, D | ||
|
Х=Сl |
Х=Вr |
Х=Сl |
Х=Вr | |
|
С2Н5Х |
0,177 |
0,191 |
2,05 |
2,02 |
|
СН2=СНХ |
0,169 |
0,186 |
1,44 |
1,41 |
|
С6Н5Х |
0,169 |
0,186 |
1,73 |
1,71 |
Висновки із даних, що наведені в табл. 12.3-12.4:
галогенопохідні вуглеводнів мають високу реакційну здатність за винятком фторпохідних. Висока енергія зв’язку C–F (486 кДж/моль) та низька поляризованість (1,72 см3) робить їх дуже пасивними в хімічному відношенні;
для зв’язку С–Hal є характерним гетеролітичне розщеплення:
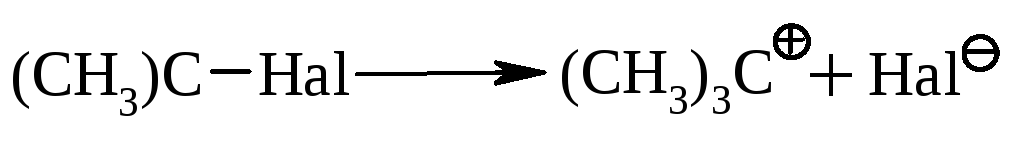 ;
;легкість розриву зв’язку С–Hal збільшується закономірно від фтор- до іодпохідних в порядку зменшення електронегативності галогенів.