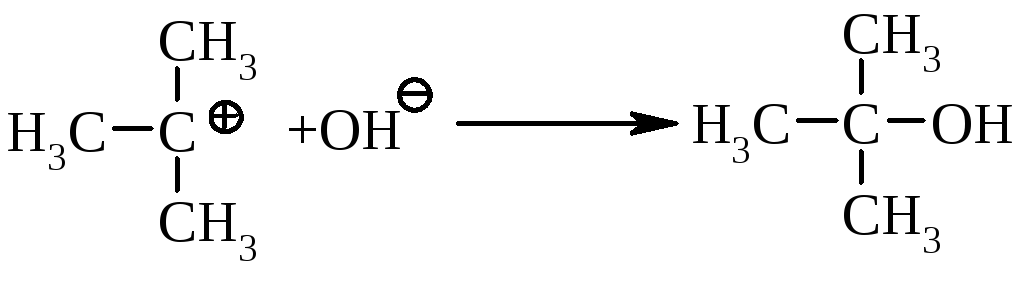- •12. Галогенопохідні вуглеводнів
- •1. Класифікація. Номенклатура.
- •2. Методи отримання.
- •2.1. Пряме галогенування алканів (тема „Алкани”), sr:
- •2.2. Приєднання галогеноводнів до алкенів (тема „Алкени”)
- •2.3. Заміщення функціональних груп (–oh, –Hal) на галоген.
- •2.4. Одержання ароматичних галогенпохідних галогенуванням вуглеводневого радикалу або бензольного ядра.
- •3. Фізичні властивості.
- •4. Характеристика зв’язків вуглець–галоген с–Hal.
- •5. Хімічні властивості.
- •5.2. Реакції нуклеофільного заміщення галогена, пов’язаного з ароматичним ядром.
- •5.3. Реакції відщеплення (-елімінування).
- •6. Екологічні питання.
5. Хімічні властивості.
Хімічні властивості алкілгалогенідів обумовлені реакціями за участю С–Hal, С–Н та С–Н зв’язків, як це наведено за схемою:
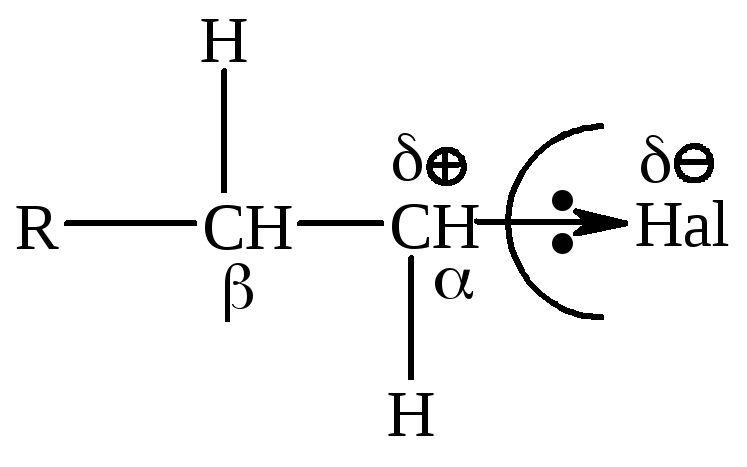
Більша електронегативність атома галогена та наявність –І-ефекту призводить до утворення позитивного заряду (електрофільного центру) на атомі карбону С–Hal зв’язку, що і визначає всі реакції галогенопохідних вуглеводнів:
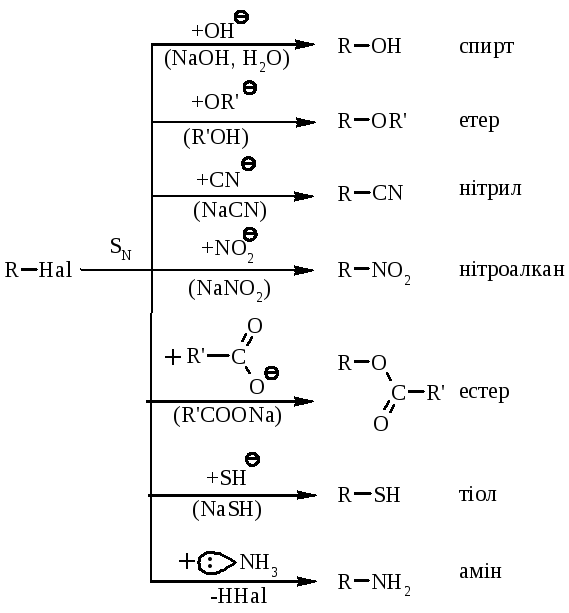
нуклеофільне заміщення галогену (SN);
іонне відщеплення НHal (-елімінування) за участю С–Н-зв’язку і кінцевого утворення алкена (E);
Для них також характерні деякі реакції відновлення та реакції із активними металами (Li, K. Na, Mg).
5.1. Реакції нуклеофільного заміщення проходять по зв’язку C–Hal за загальною схемою:
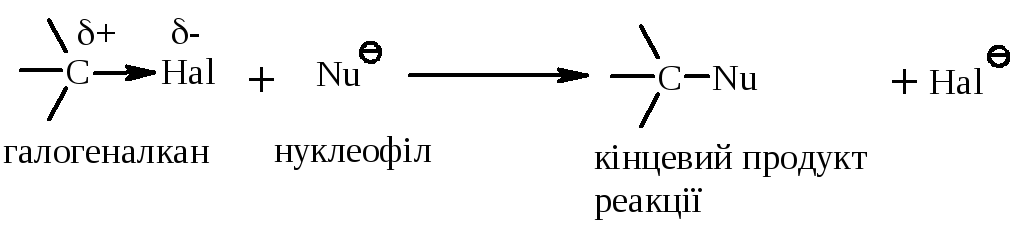
Реакції нуклеофільного заміщення можна вести наступною схемою перетворень:
|
|
|
в залежності від природи галогенпохідних вуглеводнів (R–Hal), природи реагенту (Nu–), а також умов проведення реакції, вони можуть проходити за SN1 механізмом (синхронно) або SN2 (асинхронно). |
Механізм SN2 (бімолекулярна реакція нуклеофільного заміщення).
Загальна схема реакції:
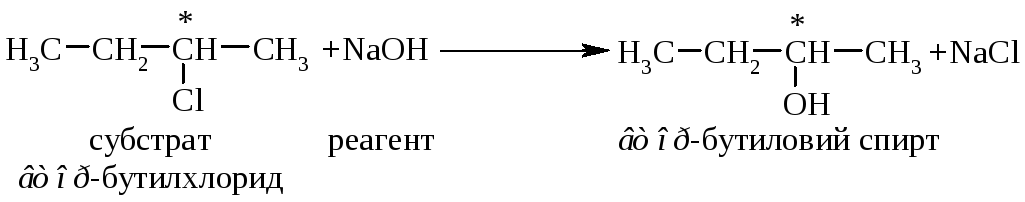
Для первинних та вторинних галогенопохідних вуглеводнівмеханізм реакції наступний:
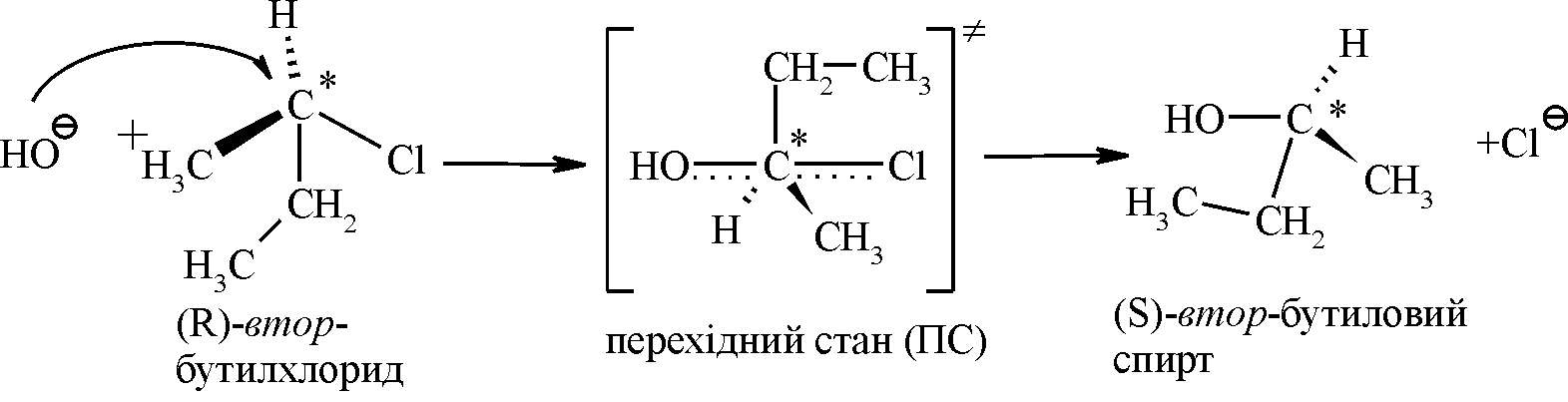
|
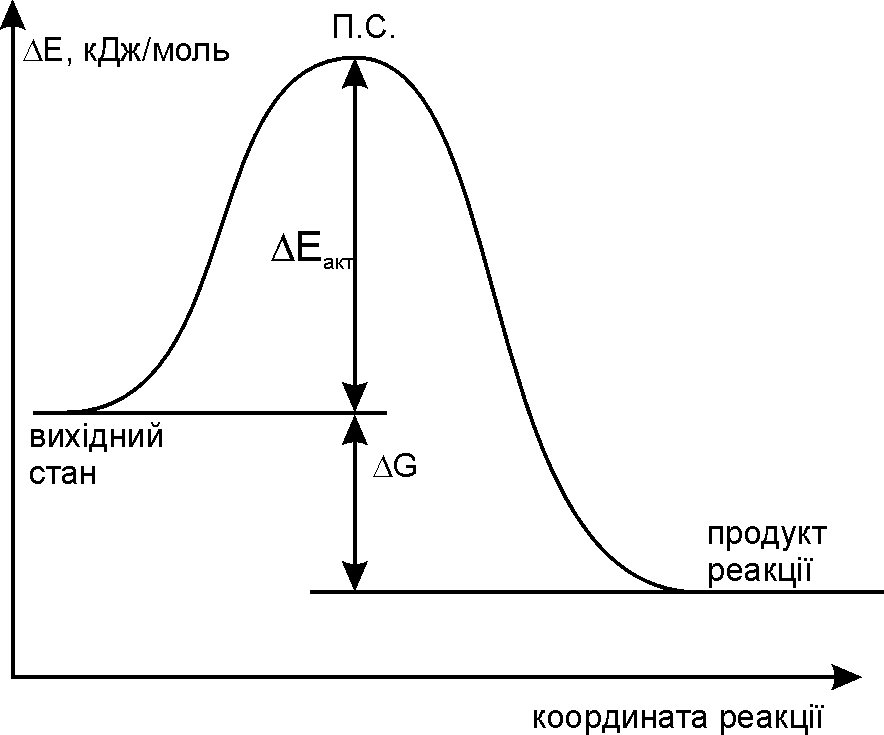
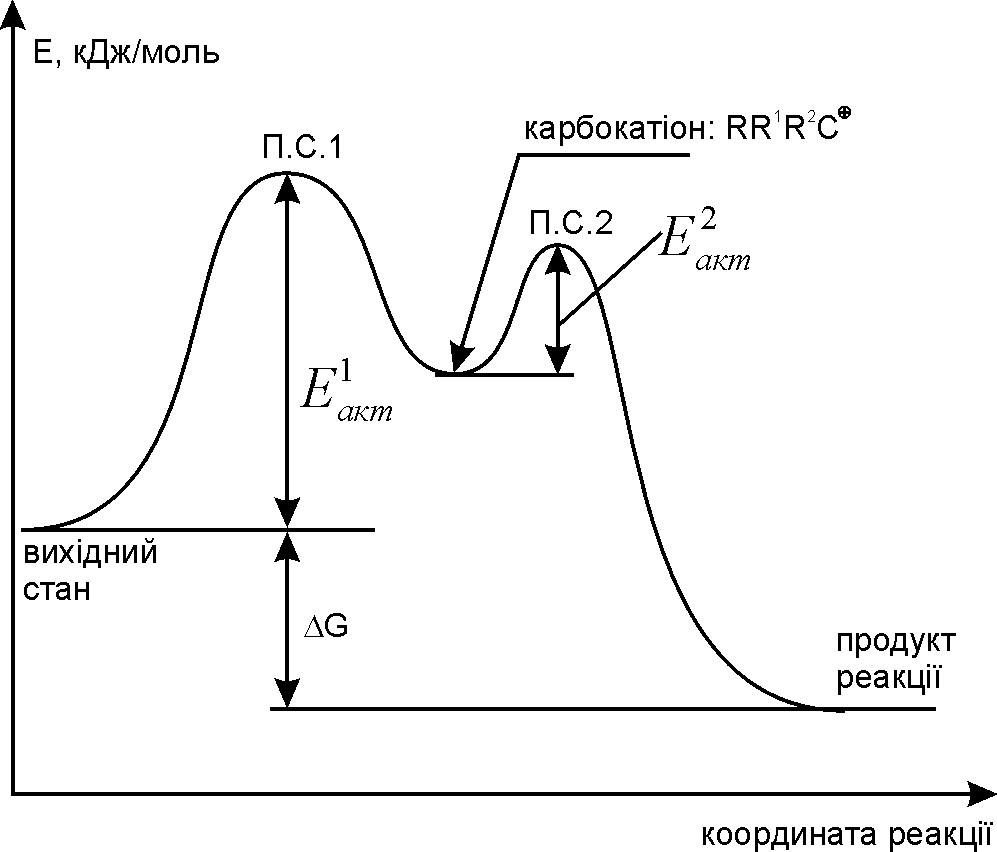
Рис. 12.1. Енергетичний графік реакції SN2. |
Нуклеофіл ОН– атакує асиметричний атом карбону (С* – електрофільний центр) з протилежної відносно галогена сторони з утворенням площинного перехідного стану (ПС), який стабілізується відщепленням галогенід-аніона. У наведеному прикладі заміщення хлору відбувається біля асиметричного атома карбону, тому у ході реакції відбувається обертання конфігурації молекули (Вальденівське обертання; Вальден, 1896 р.). На рис. 12.1 наведено енергетичний графік реакції SN2. Швидкість цієї реакції відповідає реакції другого порядку: V=k·[CH3CH2CH(Cl)CH3][OH–]. Реакція бімолекулярна, тобто швидкість залежить як від концентрації субстрата так і реагента. |
Механізм SN1 (мономолекулярна реакція нуклеофільного заміщення).
Загальна схема реакції:
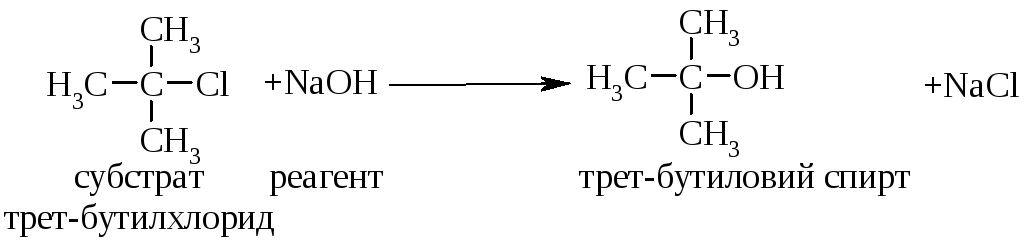
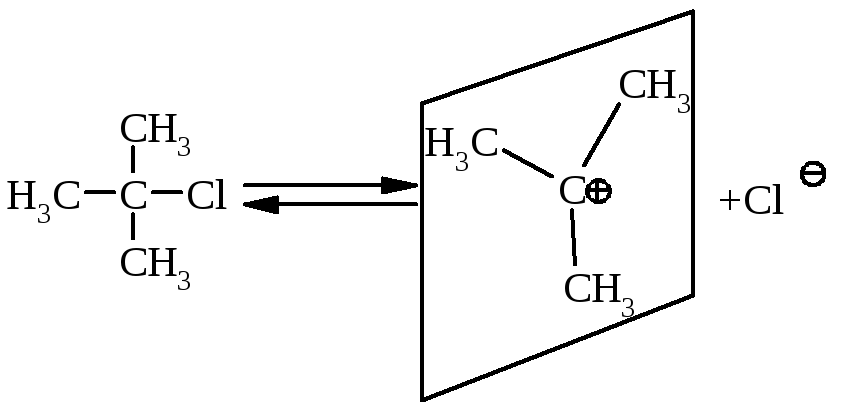
Для третинних галогенопохідних вуглеводнівмаємо наступний механізм реакції:
|
І стадія: повільна, лімітуюча |
|
повільна дисоціація трет-бутилхлорида приводить до утворення площинного бутил-катіона |
|
ІІ стадія: швидка |
|
бутил-катіон миттєво взаємодіє з нуклеофілом, утворюючи кінцеву сполуку. |
У тому випадку, коли заміщення відбувається біля асиметричного атома карбону (RR1R2), то у ході реакції SN1 утворюються оптичні ізомери (рацемати):
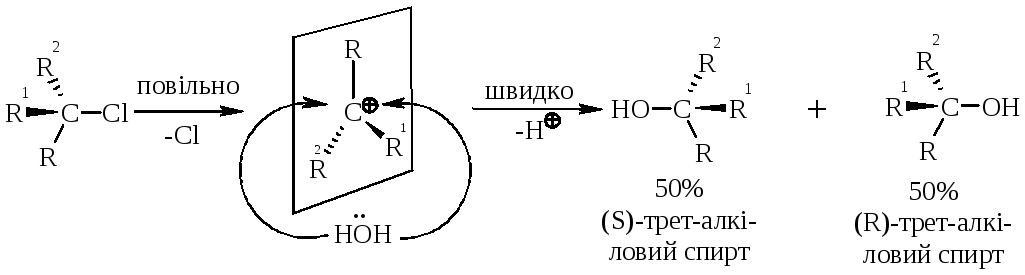
|
Рис. 12.2. Енергетичний графік реакції SN1. |
SN1-механізм визначається повільною дисоціацією третинного галогенопохідного вуглеводню з утворенням площинного карбкатіона, у якому третинний атом карбону знаходиться у sp2-гібридному стані. В подальшому нуклеофіл швидко атакує карбкатіон рівновірогідно з обох сторін цієї площини, утворюючи суміш (50%+50%) оптичних ізомерів (енантіомерів – молекул, симетричних відносно одна одної; дзеркальне відображення). На рис. 12.2 наведено енергетичний графік реакції SN1. Швидкість цієї реакції відповідає реакції першого порядку: V=k·[(CH3)3CСl]. Реакція мономолекулярна, тобто швидкість залежить лише від концентрації субстрата. |
Нуклеофільне заміщення (SN1 або SN2) біля насиченого атома карбону залежить від ряда факторів:
структури субстрата (галогеналкана). Для первинних галогенопохідних вуглеводнів (R‑Hal)є характерним SN2-механізм. Із збільшенням розгалуженності радикала R переважає SN1, що пояснюється із однієї сторони збільшенням стабільності карбо-катіона, що утворюється, а з іншої – утворенням стеричниї перешкод для проходження реакцій по механізму SN2 у випадку, наприклад, третинних галогеналканів. Тому, для третинних галогенопохідних вуглеводнів є характерним SN1-механізм. Часто механізми SN2 та SN1 конкурують;
нуклеофільності реагента та його концентрації. Чим більша нуклеофільність реагента, тим більша вірогідність проходження реакції по SN2-механізму. В той же час на реакції SN1 нуклеофільність реагента не виявляє такої вирішальної дії та реакції за цим механізмом проходять при дії слабких нуклеофілів. При цьому доцільно навести наступний ряд відносної нуклеофільності за рівнянням Свейна-Скотта:
|
Нуклеофіл |
HS– |
CN– |
I– |
OH– |
Br– |
C2H5N |
Cl– |
CH3COO– |
F– |
|
|
n* |
5,10 |
5,10 |
5,04 |
4,20 |
3,89 |
3,60 |
3,04 |
2,72 |
2,00 |
1,03 |
n*–відносна нуклеофільність реагента, для Н2О n=0.
Окрім цього, високі концентрації сприяють SN2-реакціям, а низькі – SN1.
природа розчинникавпливає на сольватацію вихідних сполук та іонів, що утворюються при дисоціації галогенопохідних вуглеводнів.
У випадку реакцій за SN2-механізмом менш полярний перехідний стан сольватується менше, ніж вихідні сполуки. Тому із збільшенням полярності розчинника швидкість таких реакцій зменшується.
У випадку реакцій за SN1-механізмом при дисоціації галогеналкана утворюється карбо-катіон (третинна структура), стабілізація якого проходить за рахунок сольватації тим більше, чим полярніше розчинник, що в свою чергу підвищує швидкість реакції.
природа галогена, що заміщується, впливає на швидкість реакції закономірно зменшенню поляризуємості зв’язку С–Hal в ряду: R–I > R–Br > R–Cl >> R–F.