
Kontrolnaja_rabota_ФИЗКОЛЛОИДНАЯ_
.pdf
температуре 20 оС и давлении 187·102 Па:
P V nRT V mRT 0,001 8,314 293 0,00383(м3)или 3,83 л . MP 0,034 18700
Т.о., в воде объемом 1 л растворяется сероводород объемом 2,77 л. Следовательно, для растворения 1 г сероводорода (3,83 л) потребуется объем воды, равный 3,83:2,77 = 1,38 (л).
Пример 6. В газометре над водой имеется смесь газов сле-
дующего состава (об. доли): Н2 – 0,20; СН4 – 0,70; СО – 0,10. Ка-
ков состав (об. доли) газовой смеси, растворенной в воде при н. у.? Коэффициенты растворимости при н.у. водорода, метана и оксида углерода(II) соответственно равны 0,0217, 0,0556 и 0,0354.
Решение. Определим парциальные давления газов (Па):
P =φ·Pобщ;
PH2 = 0,2·101325 = 20265 (Па);
P = 0,7·101325 = 70927,5 (Па);
CH4
P = 0,1·101325 = 10132,5 (Па).
CO
Определим объемы газов, содержащихся в 1 л воды:
|
Vг |
S P ; |
Vг S P Vж ; |
|
|
|
|||
Vж |
|
|||
Vг,Н2 |
= 0,0217·20265·1 = 439,75 (л); |
|||
Vг,СН4 |
= 0,0556·70927,5·1 = 3943,57 (л); |
|||
Vг,СО |
= 0,0354·10132,5·1 = 358,69 (л). |
|||
Определим общий объем смеси газов, растворенных в 1 л
воды:
Vобщ Vг,Н2 Vг,СН 4 Vг,СО 439,75 3943,57 358,69 4742(л).
Определим объемную долю каждого растворенного в воде
газа:
Vг ;
Vобщ
Н2 = 439,75/4742=0,0927;
СН4 = 3943,57/4742=0,8316;
СО = 358,69/4742=0,0757.
143
Вопросы и упражнения
1.Что такое растворимость веществ и от каких факторов она зависит?
2.Что такое коэффициент растворимости твердого (жидкого) вещества и как он связан с концентрацией раствора?
3.От каких факторов зависит растворимость газов в жидкостях? Как она изменяется с повышением температуры?
4.Что такое коэффициент растворимости и коэффициент абсорбции газов? Какая существует между ними зависимость? Какие факторы оказывают влияние на растворимость газов в воде?
5.Сформулируйте закон Генри и напишите его математическое выражение. Укажите, в каких случаях он может применяться.
6.Имеется несколько формулировок закона Генри, приведите их и покажите, что они не противоречат одна другой.
7.Какому закону подчиняется растворение смеси газов? Сформулируйте закон Генри - Дальтона для смеси идеальных газов. Что называют парциальным давлением? Равнозначны ли понятия «парциальное давление» и «давление насыщенного пара»? Ответ поясните.
8.Почему газометры заполняют не чистой водой, а насыщенным раствором поваренной соли? Можно ли для этих целей использовать насыщенный раствор сульфата бария? Ответ поясните.
Задачи
470.Коэффициент растворимости сульфата меди при температуре 30 оС равен 25 г на 100 г Н2О. Будет ли при этой температуре раствор с массовой долей соли 18 % насыщенным? (нет)
471.В 500 г воды растворено при нагревании 300 г NH4C1. Какая масса NH4C1 выделится из раствора при охлаждении его до 50 оС, если растворимость NH4Cl при этой температуре равна
50 г в 100 г воды? (50 г)
472.Растворимость хлората калия при температуре 70 оС равна 30,2 г, а при температуре 30 оС – 10,1 г в 100 г воды.
144
Сколько граммов хлората калия выделится из 70 г насыщенного при 70 оС раствора, если его охладить до 30 оС? (10,8 г)
473.Сколько граммов нитрата калия выкристаллизуется из 105 г насыщенного при температуре 60 оС раствора, если его охладить до 0 оС? Коэффициенты растворимости соли при указанных температурах соответственно равны 110 и 13 г в 100 г
Н2О. (48,5 г)
474.Сколько граммов хлорида натрия выпадет в осадок из 600 г насыщенного при температуре 80 оС раствора при охлаждении его до 0 оС? Растворимость соли при этих температурах составляет соответственно 380 г и 358 г на 100 г воды.
475.К 40,3 мл 37,8 %-го раствора азотной кислоты (ρ=1,24 г/см3) осторожно прибавлен 33,6 %-ый раствор гидроксида калия до полной нейтрализации. Какая масса соли выпадет в осадок при охлаждении раствора до 0 оС, если в насыщенном при этой температуре растворе массовая доля соли составляет 11,6 %?
476.К 44,47 мл 12,9 %-й соляной кислоты (ρ=1,12 г/см3)
осторожно прибавили 50,4 %-й раствор гидроксида калия до полной нейтрализации. Полученный раствор охладили до 0 оС. Какой количество соли выпадет при этом в осадок, если в насыщенном при этой температуре растворе массовая доля соли составляет 22,2 %?
477.В воде объемом 36 мл при температуре 30 оС и давлении 986 гПа растворяется сероводород объемом 81,4 мл. Вычислите коэффициент растворимости и коэффициент абсорбции. (2,26;2,04)
478.Растворимость хлора в воде при температуре 20 оС равна 0,729 г в воде массой 100 г. Вычислите массу хлора, растворенного в воде объемом 5 л при давлении 203 кПа. Плотность воды считайте равной 1. (72,9 г)
479.Коэффициент абсорбции метана в воде при температуре 20 оС равен 0,0331. Какая масса метана растворится в воде объемом 4 л при температуре 20 оС и давлении 303,9 кПа? (0,284 г)
480.Коэффициент растворимости оксида азота(II) в воде при температуре 0 оС равен 0,74. Какая масса оксида азота(II) растворится при температуре 0 оС и давлении 202,6 кПа в воде объе-
145
мом 5 л? (9,91 г)
481.Коэффициент растворимости хлора в воде при температуре 10 оС равен 3,26. Вычислите, какая масса хлора растворится в воде объемом 15 л при температуре 10 оС и давлении 405,2
кПа. (598 г)
482.*Коэффициент растворимости углекислого газа в воде при температуре 30 оС равен 0,738. Вычислите молярную кон-
центрацию углекислого газа в воде, насыщенной углекислым газом при температуре 30 оС и давлении 202,6 кПа. (0,059 моль/л)
483.Коэффициент растворимости кислорода в воде при тем-
пературе 0 оС равен 0,0489. Сколько кислорода растворится в 1
лводы при этой температуре и давлении 2,532·106 Па? (1,746 г.)
484.Растворимость аммиака в воде при температуре 28 оС равна 586. Выразите концентрацию аммиака в растворе в массо-
вых долях. (28,76 %)
485.Растворимость хлористого водорода при температуре 20 оС равна 442. Какова концентрация полученного раствора в массовых долях (%)? (40,14)
486.Коэффициент абсорбции метана водой при температуре 20 оС равен 0,0331. Какой объем метана растворится в 10 л воды при этой температуре и давлении 5,065·105? (1,184 л)
487.Коэффициент абсорбции ацетилена водой при температуре 30 оС равен 0,840. Вычислите коэффициент растворимости этого газа при указанной температуре. (0,9322)
488.Коэффициент растворимости хлора при температуре 20 оС равен 2,26. Вычислите коэффициент абсорбции хлора при этой температуре. (2,106)
489.Коэффициент абсорбции метана водой при температуре 0 оС равен 0,0556. Определите содержание метана в граммах на
100 г воды. (0,004 г)
490.Растворимость аммиака при температуре 20 оС равна 702 мл в 1 мл воды. Найдите массовую долю аммиака в насыщенном растворе. Парциальное давление NH3 считайте равным нормальному атмосферному давлению. (33,2 %)
491.В каком объеме воды при температуре 20 оС раство-
146
рится кислород массой 0,5 г, парциальное давление которого равно 267 гПа? Коэффициент растворимости кислорода при 20 оС
равен 0,0338. (42,2 л)
492.Сколько литров воды потребуется, чтобы в ней при температуре 0 оС растворился углекислый газ массой 1 г, парци-
альное давление которого равно 200 гПа? Коэффициент растворимости углекислого газа при 0 оС равен 1,71. (1,51 л)
493.Вычислите молярную концентрацию азота в воде, насыщенной азотом воздуха при температуре 0 оС в открытом сосуде. Атмосферное давление равно 101,3 кПа, массовая доля азота
ввоздухе равна 78 %. Коэффициент растворимости азота при 0
оС равен 0,0239. (0,00083 моль/л)
494.1 л воды насыщен СО2 при температуре 0 оС под давлением 506,6 кПа (3800 мм рт. ст.). Какой объем займёт растворенный газ, если выделить его из воды и привести к нормальным
условиям? Растворимость СО2 при температуре 0 оС равна 171
мл в 100 мл Н2О. (8,55 л)
495.В 1 л воды при температуре 0 оС растворяется 4,62 л H2S. Под каким давлением надо растворять H2S, чтобы получить 5 %-й (по массе) раствор? (760 кПа)
496.Коэффициент абсорбции СО2 при температуре 0 оС равен 1,71. При каком давлении растворимость СО2 в воде при указанной температуре составит 16 г/л? (483 кПа)
497.Определите состав воздуха, растворенного в воде при температуре 0 оС в объемных долях, если состав атмосферного воздуха (в объемных долях) следующий: азота – 78,04 %, кислорода – 21,00 %, аргона – 0,93 %, углекислого газа – 0,03 %. Вода, в которой растворяется воздух, находится в открытом сосуде; на-
чальное и равновесное давления одинаковы и равны 101,3 кПа. Коэффициенты растворимости при температуре 0 оС равны: азота
–0,024, кислорода – 0,049, аргона – 0,058, углекислого газа – 1,71. (62,3 N2; 34,2 O2; 1,79 Ar; 1,71 CO2)
498.Растворимость сероводорода в анилине Сж при температуре 22 оС в зависимости от давления изменяется следующим образом:
р, Па |
13590 |
51990 |
116200 |
154600 |
147
Сж, г/л |
2,74 |
10,6 |
24,0 |
31,6 |
Вычислив соотношение |
Сж/Р для приведенных данных, покажи- |
|||
те, что растворимость сероводорода в анилине подчиняется закону Генри. (2,017·10-4; 2,038·10-4; 2,065·10-4; 2,044·10-4)
499.Коэффициент растворимости сероводорода при температуре 0 оС равен 4,67. Под каким давлением нужно растворять сероводород, чтобы получить раствор с массовой долей сероводо-
рода 0,1 (10 %)? (14,35·105 Па)
500.Принимая, что атмосферный воздух содержит 21 % (об.) О2 и 79 % (об.) N2, рассчитайте объемную долю кислорода в воздухе, выделенном из воды, имевшей температуру 20 оС. Коэффициент абсорбции кислорода при этой температуре равен
0,031, а азота – 0,0154. (35 % О2)
501.Газовую смесь, содержащую 40 % (об.) N2O и 60 % (об.) NO, растворяли при температуре 17 оС и постоянном давлении в воде до полного насыщения последней. Рассчитайте объемные доли компонентов газовой смеси после выделения ее из воды, если при температуре 17 оС коэффициенты абсорбции N2O и NO составляют соответственно 0,690 и 0,050. (90 % N2O; 10 % NO)
502.При н. у. 1 л этилена взболтали в закрытом сосуде с 5 л воды. Вычислите конечное давление нерастворившегося остатка этилена, массу и объем поглощенного водой этилена. Коэффициент растворимости этилена в воде при температуре 0 оС равен
0,226. (47540 Па; 0,6649 г; 0,5309 л)
503.При н. у. 1 л сероводорода взболтали в закрытом сосуде с 5 л воды. Вычислите конечное давление нерастворившегося остатка и объем поглощенного водой сероводорода, измеренного при н. у. Коэффициент растворимости сероводорода в воде при температуре 0 оС равен 4,67. (4162 Па; 0,9592 л)
504.При н. у. 2 л оксида углерода(II) взболтали в закрытом сосуде с 20 л воды. Вычислите массу и объем поглощенного водой СО, измеренный при н. у. Коэффициент растворимости оксида углерода в воде при температуре 0 оС равен 0,0354. (0,6542 г; 0,530 л)
505.Газовая смесь состава (об. доли): 0,35 N2O и 0,65 NO
148

растворяется в воде при температуре 17 оС и постоянном давлении до полного насыщения. Определите состав растворенной в воде смеси газов, если растворимость N2O при температуре 17 оС составляет 0,69, a растворимость NO при той же температуре
–0,050. (88,13 % об.; 11,87 % об.)
506.Состав сухого природного газа (об. доли, %): СН4 –
92,2; С2Н6 – 0,8; N2 – 7,0. Определите состав газовой смеси, растворенной в воде при температуре 0 оС, если при данной температуре коэффициенты растворимости компонентов смеси соответст-
венно равны 0,0556; 0,0987 и 0,0235. (95,47 % об.; 1,47 % об.; 3,06 % об.)
507.Доменный газ имеет состав (об. доли, %): СО – 28; Н2 –
2,7; СН4 – 0,3; H2S – 0,3; СО2 – 10,5; N2 – 58,2. Определите состав газовой смеси, растворенной в воде при температуре 0 оС, если при данной температуре коэффициенты растворимости компонентов смеси соответственно равны 0,0354; 0,0217; 0,0556; 4,67; 1,713; 0,0235. (4,54; 0,27; 0,08; 6,42; 82,42; 6,27 % об.)
Глава 3. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
§ 2. Равновесие в водных растворах электролитов
Состояние электролитов в водных растворах описывается
теорией электролитической диссоциации Аррениуса и Оствальда.
Теория электролитической диссоциации Аррениуса основана на следующих основных положениях.
Вещества, называемые электролитами, обладают способностью при растворении в соответствующих растворителях распадаться на противоположно заряженные частицы – ионы. Распад электролитов на ионы при растворении был назван электролитической диссоциацией. Величина и знак заряда иона, число ионов, образовавшихся в результате диссоциации одной молекулы электролита, зависят от его химического строения.
Электролиты при растворении могут распадаться на ионы не полностью. Степень электролитической диссоциации определяет долю молекул, распавшихся на ионы в растворе.
Силы взаимодействия между ионами отсутствуют, и раство-
149
ры электролитов ведут себя подобно идеальным газовым системам. (Это положение не высказывалось прямо авторами теории электролитической диссоциации, но оно лежит в основе всех ее количественных соотношений.)
Диссоциация электролитов количественно характеризуется степенью электролитической диссоциации . Степень диссоциации представляет собой отношение концентрации вещества, распавшегося на ионы, к общей его концентрации в растворе:
число молекул, распавшихся на ионы ;
общее число растворенных молекул
т.к. |
N |
n и |
n |
CM , то, очевидно |
||||
|
|
|||||||
|
NA |
V |
|
|
|
|||
|
|
|
|
= |
Nдисс. |
= |
CМ ,дисс. |
. |
|
|
|
|
|
Nобщ. |
|
СМ ,общ |
|
В зависимости от способности диссоциировать на ионы электролиты делят на две группы – сильные электролиты ( >0,7),
и слабые электролиты ( <0,3).
Процесс диссоциации слабого электролита является обрати-
мым:
КnAm nKm mAn
ихарактеризуется соответствующей константой равновесия (константа диссоциации или ионизации). Различают:
аналитическую, или концентрационную, константу диссо-
циации Kд,c, вычисленную по концентрациям молекул и ионов:
KKm n An m ,
дKn Am
где [Km ] и [An- ] равновесные молярные концентрации катионов и анионов соответственно; [KmАn] равновесная молярная концентрация недиссоциированных молекул электролита;
термодинамическую константу диссоциации Kд,а, вычис-
ленную по активностям a соответствующих частиц:
Kдо aKn m amAn . aKnAm
Между константой диссоциации слабого электролита и его
150

степенью диссоциации существует зависимость, определяемая
законом разбавления Оствальда: при разбавлении раствора
слабого электролита при данной температуре степень его диссоциации растет, а константа диссоциации остается ве-
личиной постоянной. Математическое выражение закона:
Kд 2CM ,
1
где СМ молярная концентрация слабого электролита в растворе. Если степень диссоциации мала (α<0,05), применимо
приближенное уравнение
Kд 2CM .
Константа диссоциации зависит только от природы вещества и от температуры. Так как диссоциация эндотермический процесс, т.е. Ндисс>0, то константа диссоциации растет с увеличением температуры согласно уравнению изобары химической реакции:
d lnKдо |
|
Hдисс |
. |
dT |
|
||
|
RT2 |
||
Теория электролитической диссоциации Аррениуса применима только к разбавленным растворам слабых электролитов. Поведение концентрированных растворов слабых электролитов и растворов сильных электролитов любых концентраций нельзя описать количественно на основании теории Аррениуса.
Поведение сильных электролитов с ионами низкой зарядности в разбавленных водных растворах описывается теорией Дебая
иГюккеля. Сильные электролиты в разбавленном водном растворе практически полностью диссоциируют на ионы, вследствие чего концентрация ионов в растворе достаточно велика и имеют место сильные взаимодействия между ними (например, электростатическое притяжение, ассоциация в т.н. «тесные ионные пары»
ипр.). На практике это выражается в том, что кажущаяся («эффективная») концентрация ионов в растворе электролита меньше истинной. Поэтому для характеристики состояния ионов в растворе сильного электролита следует использовать не значение концен-
трации, а активность a.
Активность – это та кажущаяся, «эффективная», кон-
151
центрация иона в растворе, в соответствии с которой он проявляет себя в химических реакциях.
|
Активности катиона и аниона (а+ |
и |
а– соответственно) и |
|||||||||||||||
средняя ионная активность |
a |
связаны с моляльной Сm |
(моляр- |
|||||||||||||||
ной CM) концентрацией ионов или их средней концентрацией для |
||||||||||||||||||
реакции |
К |
|
A nKm mAn соответствующими соотношения- |
|||||||||||||||
ми: |
|
|
n |
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
Cm, , |
a Cm, , |
|
a Cm, , |
|
|
|||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
n |
m |
Cm n |
|
n |
m |
|
|
|
n |
m |
|||
|
n m a |
a , |
m Cm |
Cm , |
n m |
|
||||||||||||
где |
|
– средний ионный коэффициент активности электролита, |
||||||||||||||||
γ+ |
и γ– коэффициенты активности соответственно катиона и |
|||||||||||||||||
аниона, которые зависят не только от концентрации данного иона, но и от концентраций всех других ионов, присутствующих в растворе. Эта зависимость для разбавленных водных растворов сильных электролитов может быть представлена уравнениями Дебая
- Гюккеля:
если ионная сила раствора I 0,05, то
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lg Az2 |
|
I , lg Az2 |
|
I , lg A |
z z |
|
I , |
|
|
|
|
|
|||||||||||||
а если |
I 0,1, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|||||
lg |
Az2 |
|
I |
|
, lg |
Az2 |
|
I |
|
, lg |
|
A |
|
z z |
|
|
I |
|||||||||
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
1 |
|
I |
|
|
|
1 |
|
|
I |
|
|
|
|
|
|
1 |
|
|
I |
||||||
где z+ и z– – заряды соответственно катиона и аниона; А – коэффициент, зависящий от температуры и природы растворителя, для водных растворов при температуре 25 ºС А = 0,5117; I ионная сила раствора, определяемая соотношением:
|
|
N |
I 0,5(Сm,1z12 |
Cm,2 z22 |
... Cm,N zN2 ) 0,5 Cm,i zi2 , |
|
|
i 1 |
где Сm – моляльная концентрация иона; z – его заряд; N – число ионов в растворе.
В случае слабых электролитов ионная сила раствора невелика, и значение коэффициента активности близко к 1, поэтому для нестрогих расчетов допустимо использование концентраций ионов вместо активностей.
152

Ионное произведение воды
Вода является слабым электролитом и диссоциирует согласно уравнению:
2H2O H3O OH .
Часто для упрощения записи гидратацию протона опускают и пишут уравнение ионизации воды в виде:
H2O H OH .
Константа равновесия этой реакции может быть выражена следующим образом:
K [H ] [OH ],
[H2O]
откуда
K·[H2O] = [H+]·[OH ].
Т.к. степень диссоциации воды очень мала, то концентрацию ее недиссоциированных молекул можно считать практически постоянной, и из последнего уравнения следует, что правая часть его является также величиной постоянной при постоянной температуре. Эту константу называют ионным произведением воды Kв (или KH2O ), которое при температуре 25 оC равно:
Kв = [H+]·[OH ] = 1·10-14.
Ионное произведение воды Kв увеличивается с ростом температуры, т.к. диссоциация воды – эндотермический процесс.
Для характеристики реакции среды используют водородный показатель среды рН, равный отрицательному десятичному логарифму активности (концентрации) ионов водорода в растворе:
pH lga |
|
( pH lg[H ]). |
H |
|
|
Аналогично определяется гидроксильный показатель рОН:
pOH lg a |
OH |
|
( pOH lg[OH ]). |
|
|
|
Если прологарифмировать ионное произведение воды, получим:
pH + pOH = pKв = 14.
Очевидно, в чистой воде [H+] = [OH ] = 1·10-7 моль/л, следовательно, в нейтральном растворе рН=7. Соответственно в кислом растворе (при избытке ионов H+ по сравнению с ионами OH )
153
pH<7, а в щелочной среде pH>7.
Пример 1. Определите степень диссоциации сероводородной кислоты по первой ступени в 0,1 М растворе, если
Kд,1=1,1 10–7.
Решение. Диссоциация сероводородной кислоты по первой ступени отображается уравнением: H2S H HS . Так как константа диссоциации H2S очень мала, можно использовать приближенное выражение закона разбавления Оствальда:
Kд,1 2CM . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отсюда |
Kд,1 |
|
, |
1,1 10 7 |
3 |
или 0,105 %. |
|||
|
|
|
|
1,05 10 |
|
||||
СМ |
|
0,1 |
|
||||||
|
|
|
|
|
|
|
|
||
Пример 2. Определите рН 0,01 М раствора гидроксида аммония, если Кд = 1,77 10–5.
Решение. Гидроксид аммония слабое основание и в водном растворе диссоциирует согласно уравнению:
NH4OH NH4 OH . |
|
|
|||||
|
|
|
|
|
|
|
|
Т.к. OH = ·См и |
Kд |
|
, то [OH ] |
|
; |
||
|
Kд СМ |
||||||
СМ |
|||||||
|
|
|
|
|
|
||
[OH ] 
 1,77 10 5 0,01 4,2 10 4 (моль/ л).
1,77 10 5 0,01 4,2 10 4 (моль/ л).
рОН = –lg[OH–] = –lg(4,2 10–4) = 3,38.
Следовательно, при температуре 298 К:
рН = 14 – рОН; рН = 14 – 3,38 = 10,62.
Пример 3. Определите рН 0,15 М раствора азотистой кислоты HNO2, константа диссоциации которой составляет 5,1 10–4.
Решение. Кислота диссоциирует согласно уравнению:
HNO2 H NO2 .
Для определения концентрации ионов водорода нужно использовать выражение для константы диссоциации:
Kд [H ] [OH ] .
[HNO2]
Принимая [H+] = [NO2 ] = x, а [HNO2] = (0,15 – х), полу-
154

чим:
5,1 10 4 x2 .
0,15 x
Решая квадратное уравнение, находим
[H+] = x 8,5 10–3 моль/л.
По определению рН = –lg[H+], рН = –lg(8,5 10–3) 2,07.
Пример 4. Как изменится концентрация ионов водорода и рН, если к 1 л 0,1 М раствора цианистоводородной кислоты добавить 0,1 моль NaCN, кажущаяся степень диссоциации которого составляет 85 %? Константа диссоциации HCN равна 4,9 10–10.
Решение. Цианистоводородная кислота диссоциирует согласно уравнению: HCN H CN . Учитывая, что Kд очень мала, вычислим степень диссоциации кислоты в растворе до добавления соли по упрощенному уравнению:
|
K |
д |
|
|
4,9 10 10 |
|
|
|
, |
|
|
7 10 5 . |
|
|
СМ |
|
0,1 |
|
||
Отсюда |
|
|
|
|
|
|
[H+] = ·СМ , |
[H+] = 7 10–5 0,1 = 7 10–6 (моль/л) |
|||||
и рН = |
–lg[H+], рН = –lg(7 10–6)= 5,15. |
|||||
При добавлении в раствор соли NaCN равновесие диссоциации кислоты, согласно принципу Ле-Шателье, сместится влево в результате появления в растворе большого количества ионов CN за счет диссоциации сильного электролита: NaCN Na CN . При этом уменьшится концентрация ионов водорода в растворе, то есть диссоциация слабой кислоты будет подавлена.
Обозначим новую концентрацию ионов водорода х моль/л. Зная степень диссоциации соли (85 %), можно определить концентрацию ионов CN , вносимых солью. Считаем, что объем раствора не изменился, поэтому концентрация соли составит 0,1 моль/л, а концентрация ее ионов
[CN ] = α·Cм = 0,85·0,1 = 0,085 (моль/л).
Значит, общая концентрация цианид-ионов в образовавшемся растворе составляет (х + 0,085) моль/л.
Подставим значения концентраций в выражение для кон-
155
станты диссоциации, помня, что из-за очень незначительной диссоциации цианистоводородной кислоты концентрация недиссоциированных молекул кислоты практически совпадает с исходной концентрацией кислоты:
|
Kд |
[H ] [CN ] |
, |
|
|
|
|
|
|
|
|
||||
|
|
|
[HCN] |
|
|
|
|
4,9 10 10 |
x (x 0,085) |
|
или 4,9 10 10 |
|
x (x 0,085) |
. |
|
|
0,1 x |
|
|
0,1 |
|
||
Решая квадратное уравнение, находим концентрацию ионов водорода в растворе после добавления соли: х = 5,76·10–10 моль/л. Отсюда новое значение рН = –lg(5,76 10–10) = 9,24.
Таким образом, после добавления соли с одноименным анионом к раствору HCN концентрация ионов водорода понизилась в 12153 раз (7 10–6/5,76 10–10 12153), а реакция среды изменилась с кислотной на щелочную.
Пример 5. Вычислите рН раствора с массовой долей хлороводородной кислоты 0,0018 %. Плотность раствора считайте равной 1 г/мл.
Решение. |
Найдем концентрацию |
HCl в растворе, выражен- |
||||||||||
ную в моль/л, |
учитывая, |
что молярная масса HCl составляет |
||||||||||
36,46 г/моль: |
|
|
|
|
|
0,0018 |
|
|
||||
C |
M |
|
n |
|
|
m |
, C |
M |
|
|
4,94 10 4 (моль/ л). |
|
|
V |
|
M V |
|
36,46 0,1 |
|
||||||
Т.к. HCl сильный электролит и в водном растворе практи-
чески полностью диссоциирует на ионы: |
|
|
|
HCl H+ + Cl–, |
|
то H+ = СHСl, |
H+ = 4,94·10-4 моль/л, и |
pH = lg(4,94·10–4) = |
3,31. |
|
|
Пример 6. В 250 мл раствора содержится 0,1 г гидроксида натрия. Вычислите рН раствора, считая плотность его равной 1
г/мл.
Решение. Найдем концентрацию NaOH в растворе, выраженную в моль/л. Молярная масса NaOH составляет 40,00
г/моль.
156

C |
M |
|
n |
|
m |
, C |
M |
|
0,1 |
0,01(моль/ л) |
|
V |
M V |
|
|
40,00 0,25 |
|||||
Гидроксид натрия – сильный электролит и в водном растворе полностью диссоциирует на ионы:
NaOH Na+ + OH .
Ионная сила 0,01М раствора гидроксида натрия равна:
N
I0,5 Cm,i zi2 , I = 0,5(0,01·12 + 0,01·12) = 0,01.
i 1
Для расчета активности ионов OH в растворе рассчитаемкоэффициент активности: lg Az2 
 I
I
lg ОН 0,5 12 
 0,01 0,05,
0,01 0,05,
ОН 10 0,05 0,89.
Откуда активность
aOH [OH ] OH , aOH = 0,01·0,89 = 8,9·10-3 (моль/л). pOH = lg(8,9·10-3) = 2,05
pH = 14 pOH, pH = 14 2,05 = 11,95.
Пример 7. Вычислите pH 0,017 М раствора муравьиной кислоты.
Решение. Муравьиная кислота является слабым электролитом и диссоциирует согласно уравнению:
HCOOH H HCOO .
Это равновесие описывается соответствующей константой равновесия – константой диссоциации слабой кислоты. Табличное
значение константы диссоциации муравьиной кислоты
Kд=1,8·10-4.
При отсутствии в растворе других электролитов с одноименными ионами концентрации ионов H+ и HCOO равны между собой: [H+] = [HCOO–]. Подставим эти значения в выражение для константы диссоциации:
Kд |
|
[H ] [HCOO ] |
|
[H ]2 |
|
или Kд |
|
[H ]2 |
, |
|
[HCOOH] |
CМ |
|||||||
|
|
[HCOOH] |
|
|
|
||||
где CM – общая молярная концентрация кислоты в растворе. Тогда
157
[H ] 
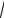 CM Kд ,
CM Kд ,
[H ] 
 1,7 10 2 1,8 10 4 1,75 10 3 (моль/л), pH = lg(1,75·10–3) = 2,76.
1,7 10 2 1,8 10 4 1,75 10 3 (моль/л), pH = lg(1,75·10–3) = 2,76.
Пример 8. Вычислите степень диссоциации муравьиной кисло-
ты в растворе с массовой долей 1,5 %. Плотность раствора считайте равной 1г/мл.Kд = 1,8·10–4.
Решение. Находим молярную концентрацию муравьиной кислоты:
C |
M |
|
n |
|
m |
, C |
M |
|
1,5 |
0,326(моль/ л), |
|
V |
M V |
|
|
46,03 0,1 |
|||||
где 46,03 молярная масса муравьиной кислоты (г/моль). Формиат-ионы и ионы водорода образуются только в ре-
зультате диссоциации муравьиной кислоты:
HCOOH H HCOO
следовательно, их концентрации равны:
[H+] = [HCOO ] = x моль/л,
а концентрация недиссоциированных молекул составит: [HCOOH] = (0,326 x) моль/л.
Подставим эти значения в выражение для константы диссоциации:
Kд |
|
[H ] [HCOO ] |
, |
1,8 10 4 |
x x |
|
0,326 x |
||||
|
|
[HCOOH] |
|
||
Т.к. концентрация диссоциированной части мала по сравнению с общей концентрацией кислоты в растворе, то в знаменателе ею, как алгебраическим слагаемым, можно пренебречь:
|
|
|
|
|
|
|
1,8 10 4 |
|
|
x x |
, |
||
|
|
|
|
|
|
|
|
|
|
||||
откуда |
|
|
|
|
|
|
|
|
0,326 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
,x |
|
|
|
|
|||||
x |
|
|
|
1,8 10 4 |
0,326 |
7,66 10 3 (моль/ л), |
|||||||
|
Kд СM |
||||||||||||
т.е. [H+] = [HCOO–] = 7,66·10–3 (моль/л). |
|||||||||||||
|
|
[H ] |
, |
|
7,66 10 3 |
0,0233или 2,33%. |
|||||||
|
|
|
СМ |
|
0,326 |
|
|
|
|
||||
|
|
|
|
|
|
|
158 |
|
|
|
|
||

Пример 9. Вычислите концентрации ионов в 0,1 М растворе селенистой кислоты H2SeO3. Kд,1=1,8·10–3, Kд,2=3,2·10–9.
Решение. В растворе селенистой кислоты имеют место следующие равновесия:
H2SeO3 H HSeO3
HSeO3 H SeO32
Судя по значениям ступенчатых констант диссоциации, диссоциация по первой ступени протекает во много раз интенсивнее, чем по второй. Поэтому для расчета концентрации ионов H+ в растворе можно рассматривать только диссоциацию кислоты по первой ступени, пренебрегая тем количеством ионов водорода, которые образуются на второй ступени диссоциации.
Обозначим через x концентрацию диссоциированной части кислоты. Тогда, при начальной концентрации кислоты СМ равновесные концентрации будут равны:
[H+] = x моль/л, [HSeO3 ] = x моль/л, [H2SeO3] = (СМ – x) моль/л.
Подставим эти значения в выражение для константы диссоциации:
|
[H ] [HSeO ] |
|
|
|
|
x2 |
||
Kд,1 |
3 |
|
, |
1,8 10 |
|
3 |
|
. |
|
|
|
||||||
[H2SeO3] |
|
|
||||||
|
|
|
|
|
0,1 x |
|||
Решая квадратное уравнение, получим:
x = [H+] = [HSeO3 ] 1,34·10-2 (моль/л).
Поскольку [H+] [HSeO3 ], то из выражения для константы диссоциации кислоты по второй ступени
Kд,2 [H ] [SeO32 ] [HSeO3 ]
находим:
3,2 10 |
|
9 |
|
1,34 10 2 [SeO2 ] |
, |
[SeO |
2 |
] 3,2·10 |
-9 |
(моль/л). |
|
3 |
3 |
|
|||||||
|
|
1,34 10 2 |
|
|||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Пример 10. Применяя уравнение Дебая - Гюккеля, вычислите средний ионный коэффициент активности, среднюю активность ионов и активности ионов в 0,002 m растворе сульфата натрия.
Решение. Сульфат натрия является сильным электролитом и
159
диссоциирует согласно уравнению
|
|
|
|
Na |
SO 2Na |
SO2 . |
|
|
|
|||||||
|
|
|
|
2 |
|
4 |
|
|
4 |
|
|
|
||||
Определим ионную силу раствора: |
|
|
|
|||||||||||||
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
I 0,5 Cm,i zi2 ; |
I 0,5(Cm,Na zNa2 Cm,SO42 zSO2 |
42 ), |
||||||||||||||
|
|
|
i 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I = 0,5·(0,004·12 + 0,002·22) = 0,006. |
|
||||||||||||
Находим средний ионный коэффициент активности: |
||||||||||||||||
|
|
|
|
|
lg A |
z z |
|
I |
, |
, |
γ =0,833. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
lg |
|
|
0,006 |
|
|
|
||||||||||
|
|
0,51171 |
2 |
|
0,07925 |
|
± |
|
||||||||
Находим активности ионов: |
|
|
|
|
|
|
|
|
||||||||
aNa Cm,Na , |
aNa 0,833 0,004 3,33 10 3 (моль/кг), |
|||||||||||||||
aSO2 |
|
Cm,SO2 , |
aSO2 |
0,833 0,002 1,67 10 3 (моль/кг). |
||||||||||||
4 |
|
|
4 |
|
|
4 |
|
|
|
|
|
|
|
|
|
|
Находим среднюю активность ионов:
a n m
 an am , a 3
an am , a 3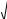 (3,33 10 3)2 1,67 10 3 2,64 10 3 (моль/кг).
(3,33 10 3)2 1,67 10 3 2,64 10 3 (моль/кг).
Вопросы и упражнения
1.Какие наблюдения привели к созданию теории электролитической диссоциации?
2.Изложите сущность теории электролитической диссоциации Аррениуса. Какие дополнения были внесены в нее И.А.Каблуковым? К каким электролитам она применима?
3.Какие вещества называют электролитами? По какому принципу их разделяют на сильные и слабые электролиты? Напишите уравнения электролитической диссоциации нескольких известных вам сильных кислот и оснований в водных растворах.
4.Какие величины являются количественными характеристиками процесса электролитической диссоциации? Напишите выражения концентрационной константы диссоциации для угольной кислоты Н2СО3 по первой и второй ступеням. Для каких электролитов концентрационная константа диссоциации не имеет физического смысла?
5.Что такое степень электролитической диссоциации? Какими
160
методами она определяется? Напишите соответствующие уравнения, применяемые для расчетов степени диссоциации, и поясните их. Как изменяется степень электролитической диссоциации с разбавлением электролита?
6.Выведите математическое выражение закона действующих масс через степень электролитической диссоциации.
7.Какая характеритстика зависит от концентрации раствора: константа диссоциации или степень диссоциации? Напишите выражение закона разбавления Оствальда для бинарного электролита. Для каких электролитов можно использовать его упрощенную форму?
8.Как изменяется степень диссоциации слабого электролита при добавлении к его раствору сильного электролита с одноименным ионом? Поясните на примерах.
9.Что такое ионное произведение воды, водородный и гидроксильный показатели? Укажите значения этих величин при температуре 298 К в чистой воде.
10.Чему равны концентрация ионов водорода и гидроксид-ионов в нейтральной среде? Каковы значения концентрации иона водорода: а)в кислой среде; б) в щелочной среде?
11.Что такое рН? Какие значения он принимает в кислой, нейтральной и щелочной средах?
12.Почему для характеристики как кислотности, так и щелочности раствора применяется рН?
13.Как изменится рН раствора, если к нему добавить раствор щелочи? Как нужно изменить концентрацию ионов водорода в растворе, чтобы рН его уменьшился?
14.Применим ли закон действующих масс к сильным электролитам? Как это подтверждается экспериментально? Дайте объяснение.
15.Изложите основные положения теории сильных электролитов. Укажите, какие факты привели к созданию этой теории.
16.Что такое кажущаяся степень электролитической диссоциации? Какие коэффициенты введены в теории сильных электролитов? Напишите и поясните математические выражения,
161
применяемые для их расчетов.
17.Что такое активность? Какое состояние электролита в растворе принято за стандартное?
18.Что такое коэффициент активности? Как его определяют?
19.Что такое ионная сила? Какое значение имеет эта величина для растворов электролитов?
20.Можно ли экспериментально определить активности отдельных ионов? Какой величиной активности для них обычно пользуются? Как составлены таблицы активности для отдельных ионов?
Задачи
508.Во сколько раз концентрация ионов Н+ в 0,1 н растворе HNO2 больше, чем в 0,1 н растворе HCN?
509.В растворе бензойной кислоты С6Н5СООН концентрация ионов водорода составляет 3 10–3 моль/л. Вычислите общую концентрацию кислоты в растворе (моль/л и г/л).
510.Угольная кислота диссоциирует преимущественно по первой ступени. Концентрация ионов водорода в 0,005 М растворе равна 4,25 10–5 моль/л. Пренебрегая диссоциацией кислоты по второй ступени, определите константу диссоциации Н2СО3 по первой ступени.
511.Степень диссоциации уксусной кислоты СН3СООН в 1 н; 0,1 н; 0,01 н растворах соответственно равна 0,0042; 0,0134; 0,0425. Вычислив Kд уксусной кислоты для растворов указанных концентраций, докажите, что константа диссоциации не зависит от концентрации раствора.
512.Как изменится концентрация ионов ОН в 1 М растворе NH4OH, если к 5 л раствора добавить 26,75 г хлорида аммония, кажущаяся степень диссоциации которого 85 %?
513.Какова концентрация ионов CN в 0,01 н растворе HCN, в 1 л которого содержится 0,5 моль HBr? Кажущаяся степень диссоциации HBr равна 89,8 %.
514.При какой молярной концентрации муравьиной кислоты в растворе степень диссоциации ее составит 6,7 %?
162
