
- •Заведующий кафедры тоЭк
- •Лекция №3(2)
- •1. Построение кривой титрование раствора сильной кислоты раствором сильного основания
- •0,1 М раствором NaOh
- •Выбор индикатора
- •Некоторые кислотно-основные индикаторы
- •Расчет индикаторных погрешностей
- •Кривая титрования
- •V(NaOh), мл
- •0,1 М раствором hCl
- •Выбор индикатора
- •Расчет индикаторных погрешностей
- •Выбор индикатора
- •Расчет индикаторных погрешностей
- •Кривая титрования
- •4 Построение кривой титрование раствора слабого основания раствором сильной кислоты
- •Выбор индикатора
- •Расчет индикаторных погрешностей
- •Кривая титрования
Выбор индикатора
Пояснения. Правило выбора индикатора:
интервал перехода окраски индикатора должен находиться в пределах скачка титрования или частично перекрываться с ним;
рТ индикатора должен быть как можно ближе к точке эквивалентности и находиться в пределах скачка титрования.
Учитывая правило выбора индикатора выбираем 2 индикатора из числа приведенных в табл. 6.6 или из справочной литературы (Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989. 190 с.).
Таблица 2
Некоторые кислотно-основные индикаторы
|
Название |
Интервал перехода окраски, ∆рН |
Показатель титрования, рТ |
|
Метиловый оранжевый |
3,1– 4,4 |
4,0 |
|
Метиловый красный |
4,4 – 6,2 |
5,5 |
|
Метиловый желтый |
2,4 – 4,0 |
3,0 |
|
Фенолфталеин |
8,2 – 9,8 |
9,0 |
|
Тимолфталеин |
9,3 – 10,5 |
9,6 |
|
Феноловый красный |
6,4 – 8,2 |
7,5 |
|
Тимоловый синий |
8,0 – 9,6 |
9,2 |
|
Бромтимоловый синий |
6,0 – 7,6 |
7,0 |
|
Бромкрезоловый зеленый |
3,9 – 5,4 |
4,5 |
|
Бромкрезоловый пурпурный |
5,2 – 6,8 |
6,0 |
Выбираем 2 индикатора: фенолфталеин (рТ=9,0) и тимоловый синий (рТ=9,2)
Расчет индикаторных погрешностей
При
недотитровывании (рТ < рНТЭ)
формула для расчета индикаторной
погрешности (![]() ):
):
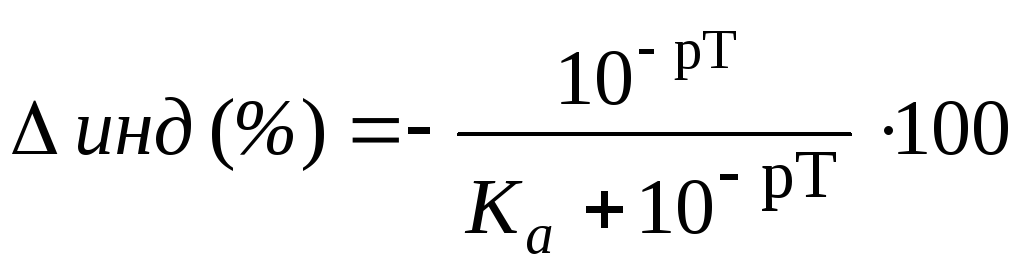 ,
,
где Ka – константа кислотности
При
перетитровывании (рТ > рНТЭ)
формула для расчета индикаторной
погрешности (![]() ):
):
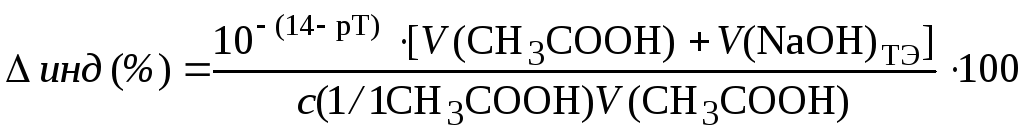 ,
,
где V(NaOH)ТЭ – объем титранта, прибавленный от начала титрования до точки эквивалентности.
Рассчитываем индикаторные погрешности для выбранных индикаторов:
- фенолфталеин (рТ=9,0>рНТЭ):
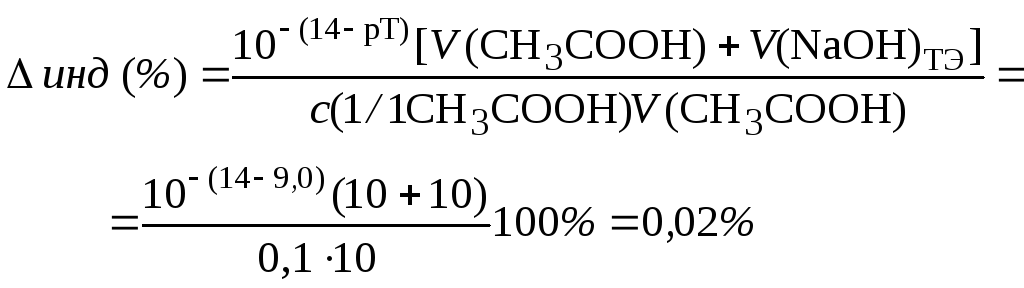
- тимоловый синий (рТ=9,2 > рНТЭ):

Кривая титрования
Пояснения. Рассчитанную кривую титрования вычерчивают на миллиметровой бумаге (возможен вариант компьютерного оформления) в координатах рН = f[V(NaOH)]. На графике должны быть указаны: скачок титрования, точка эквивалентности (ТЭ), линия нейтральности, интервалы перехода окраски двух индикаторов и значения показателей титрования для них (рТ).
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 0 2 4 6 8 10 12 14 16 18 20 22 24
















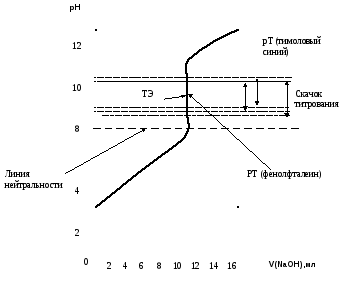




Рис.
1 Теоретическая кривая титрования 10 мл
0,1 М раствора CH3COOH
0,1 М раствором NaOH
4 Построение кривой титрование раствора слабого основания раствором сильной кислоты
Задание. Рассчитать и построить кривую титрования 10 мл 0,1М раствора NH4OH (Кb =1,76∙10−5). Титрант: раствор HCl. 0,1M.
Пояснения: Кривую титрования строят по расчетным точкам.
Расчетные точки должны соответствовать следующим этапам титрования:
1. Начальная точка (рН раствора в данном случае обусловлено наличие слабого основания NH4OH в растворе)
2. Область до точки эквивалентности. (Входе титрования в титруемом растворе будет находиться как неоттитрованная часть NH4OH так и образуется соль NH4Cl, то есть образуется буферный раствор, расчет рН раствора проводят как для буферного раствора образованного слабым основанием и солью слабого основания).
3. Точка эквивалентности (ТЭ) Так как к раствору NH4OH добавлено эквивалентное количеств HCl, вся кислота переведена в соль:
NH4OH + HCl → NH4Cl + Н2О
NH4Cl -соль образованная слабым основанием и солью слабого основания, подвергается гидролизу по катиону
4.
Область
после точки эквивалентности. (После
т.Э. в растворе уже не будет содержаться
NH4OH,
а будет находиться NH4Cl
и HCl. Соляная кислота HCl – сильный
электролит, диссоциирует на ионы
полностью
![]() ,
,![]() )
)
Расчет приводят в виде таблицы:
Расчет кривой титрования 10 мл 0,1 М раствора NH4OH 0,1 М раствором HCl
Таблица1
|
№п/п |
Объем добавленного титранта, мл |
Объем титруемого раствора, мл |
Состав полученного раствора |
Общий объем смеси в колбе для титрования,мл |
Расчет концентрации основания в титруемом растворе |
Расчет концентрации соли в титруемом растворе |
Расчет рН раствора |
рН | |||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 | |||
|
1 |
0 |
10 |
NH4OH |
10 |
СOH
|
- |
рОН=-lg1,33·10-3= =3-lg1,32=2,87
рН=14-рОН=14-2,87=11,13 |
11,13 | |||
|
2 |
5 |
5 |
NH4OH+ NH4Cl |
15 |
Соснования=
|
Ссоли=
|
рН=
14-4,75+lg |
9,25 | |||
|
3 |
9,90 |
0,1 |
NH4OH+ NH4Cl |
19,90 |
Соснования=
|
Ссоли=
|
рН=
14-4,75-lg |
7,26 | |||
|
4 |
9,99 |
0,01 |
NH4OH+ NH4Cl |
19,99 |
Соснования=
|
Ссоли=
|
рН=
14-4,75+lg |
6,25 | |||
|
5 |
10,0 |
0 |
NH4Cl |
20,00 |
- |
Ссоли=
|
NH4Cl-соль образованная сильной кислотой и слабым основанием подвергается гидролизу по катиону
|
5,28 | |||
|
6 |
10,01 |
0 |
NH4Cl+ HCl |
20,01 |
Скислоты=
СН+= c(HCl) = 4,9·10-5моль/л
|
- |
рН=-lgCH+=-lg4,9·10-5=5-lg4,69=4,33
|
4,33 | |||
|
7 |
10,10 |
0 |
NH4Cl+ HCl |
20,10 |
Соснования=
СOH−= c(NaOH) = 4,9·10-4моль/л
|
- |
рН=-lgCH+=-lg4,9·10-4=4-lg4,69=3,3
|
3,3 | |||
|
8 |
15 |
0 |
NH4Cl+ HCl |
25 |
Соснования=
СOH−= c(NaOH) = 2·10-2моль/л
|
- |
рН=-lgCH+=-lg2·10-2=2-lg2=1,7
|
1,7 |
