
- •2. Вихідні дані
- •5.Розрахунок шихти матеріалів і енергетичного балансу виплавки феросиліцію
- •5.1 Розрахунок кількості відновника
- •5.2.Розрахунок кількості і складу феросиліцію
- •5.3.Розрахунок кількості газів
- •5.4.Розрахунок зведеного матеріального балансу виплавки феросиліцію
- •5.5.Розрахунок енергетичного балансу виплавки феросиліцію
2. Вихідні дані
Розрахунок виконується для одержання ФС 25 з вмістом 26% Si , який виплавляється неперервним вуглецевотермічним процесом в рудновидновних круглих відкритих електроферосплавних пічах потужністю 22,5 М ВА.Вякості матеріалів використовуються кварцит, коксик істалева стружка , хімічній склад яких приведено в табл. 5.1.
Розрахунок ведемо на 100кг кварциту.Приймаємо,що сірка и фосфор із стружки переходять в сплав , а сірка коксу звітрюється . Нижче приведено відсоткове співвідношення відновлених оксидів в процесі плавки і переведених в шлак:
|
Оксиди |
|
|
|
CaO |
|
MgO |
|
|
Відновлюється,% |
98,5 |
99 |
45 |
35 |
100 |
- |
100 |
|
Переходіть в шлак ,% |
1,5 |
1 |
55 |
65 |
- |
100 |
- |
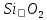 0,5%Відновлюється,
98% до Si
0,5%Відновлюється,
98% до Si
Приймаємо наступне розподілення відновлених елементів між металом і газовою фазою:
|
Елемент |
Si |
Fe |
Al |
Ca |
P |
S |
SiO |
|
Переходить в метал,% |
100 |
99 |
90 |
70 |
50 |
- |
- |
|
Звітрюється,% |
- |
1 |
10 |
30 |
50 |
100 |
100 |
Таблица 5.1. хімічний склад шихтовых матєріалів
|
Назва матеріалів |
Вміст компоненті ,%за масою | ||||||||||||||
|
|
|
|
CaO |
MgO |
|
|
P |
Fe |
Mn |
Si |
C |
Зола |
Волога |
Летучі | |
|
Кварцит митий |
97,94 |
0,30 |
1,10 |
0,49 |
0,11 |
- |
- |
- |
- |
- |
- |
- |
- |
0,55 |
- |
|
Коксик |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
85,86 |
10,4 |
3,5 |
1,0 |
|
Зола коксу |
51,38 |
9,35 |
30,22 |
0,53 |
7,92 |
0,4 |
0,2 |
|
|
|
|
|
|
|
|
|
Сталева стружка |
- |
- |
- |
- |
- |
- |
S 0,03 |
0,03 |
93,5 |
0,6 |
0,5 |
0,34 |
- |
4,0 |
5,0 |
|
Електродна маса |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
85,0 |
12,0 |
- |
3,0 |
|
Зола електродної маси |
50,29 |
11,21 |
22,22 |
7,18 |
8,80 |
- |
0,3 |
- |
- |
- |
- |
- |
- |
- |
- |
5.Розрахунок шихти матеріалів і енергетичного балансу виплавки феросиліцію
5.1 Розрахунок кількості відновника
Розрахунок відновника ведемо по схемі, приймаємо умовно,що процес відновлення проходить у 2 стадії:
1.-дисоциація
оксиду з виділенням кисню МеO Me+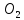

2.-зв’
язування кисню вуглецем коку :C+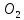 =CO.
=CO.
При розрахунку необхідної кількості відновника враховуємо витрати його безпосередньо на відновлення оксидів кварциту, а також золи коксу і електродної маси.
5.2.1.Розрахунок кисню ,який виділяється при дисоціації оксидів кварциту,приведено у табл.5.2.
Таблиця 5.2. Розрахунок кількості виділеного кисню при дисоціації оксидів кварциту
|
Схема дисоціації оксиду |
Із кварциту відновлюється, кг |
Виділяється кисню,кг |
|
|
97,94∙0,98=95,9812 |
95,98∙32/60=51,189 |
|
|
97,94∙0,005=0,4897 |
0,4897∙16/60=0,13 |
|
|
0,3∙0,99=0,30 |
0,3∙48/160=0,09 |
|
|
1,1∙0,45=0,495 |
0,495∙48/102=0,233 |
|
CaO до Ca |
0,49∙0,35=0,171 |
0,171∙16/56=0,0488 |
|
Разом |
97,437 |
51,691 |
Для зв’ язування 51,6877 кг кисню за реацією С+1/2О2=СО необхідно вуглецю:
51,691∙12/16=38,768 кг.
5.2.2.Розрахунок кисню, який виділяється при відновленні оксидів золи коксу приведено у табл5.3.
Таблиця 5.3.Розрахунок кількості кисню виділеного при відновленні оксидів золи коксику
|
Схема дисоціації оксиду |
Із золи коксику відновлюється,кг |
Виділяється кисню,кг |
|
|
10∙0,514∙0,98=5,04 |
5,04∙32/60=2,688 |
|
|
10∙0,514∙0,005=0,026 |
0,026∙16/60=0,0069 |
|
|
10∙0,093∙0,99=0,92 |
0,92∙48/160=0,276 |
|
|
10∙0,302∙0,45=1,36 |
1,36∙48/102=0,64 |
|
CaO до Ca |
10∙0,35∙0,0053=0,0186 |
0,0186∙16/56=0,005 |
|
|
10∙0,004∙1=0,04 |
0,04∙80/142=0,023 |
|
|
10∙0,002∙1=0,02 |
0,02∙48/80=0,012 |
|
Разом |
7,42 |
3,65 |
Для відновлення оксидів золи коксика необхідно вуглецю
3,65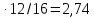 кг.
кг.
Із 84,65 кг вуглецю, які вміщуються в 100кг коксику , витрачується:
на відновлення оксидів золі коксику 2,74 кг,на відновлення оксидів кварциту
85,86 - 2,74=83,12 кг або 83,12%
Для відновлення 100кг кварциту потрібно 38,768 кг вуглецю або
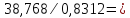 46,64кг
.
46,64кг
.
Приймаємо, що 8% коксику окислюється на колошнику и витрачається на навуглерожування сплаву. Тоді потрібно коксику
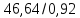 =50,69
кг.
=50,69
кг.
Вуглець електродів також бере участь в реакціях відновлення . Приймаємо із практики, що витрати електродної маси на 100 кг кварциту дорівнюють 1,7 кг.
5.2.3. Розрахунок кількості виділеного кисню при дисоціації оксидів золи електродної маси приведено у табл.. 5.4.
Таблиця 5.4. Розрахунок кількості виділеного кисню при дисоціації оксидів золи
електродної маси
|
Схема дисоціації оксиду
|
Із 1,7 кг електродної маси відновиться,кг |
Виділяється кисню,кг |
|
|
1,7 |
0,084∙32/60=0,0448 |
|
|
1,7∙0,1∙0,5029∙0,005=0,00043 |
0,00043∙16/60=0,00012 |
|
|
1,7∙0,1∙0,1121∙0,99=0,0189 |
0,0189∙48/160=0,0057 |
|
|
1,7∙0,1∙0,2222∙0,45=0,017 |
0,017∙48/102=0,008 |
|
CaO до Ca |
1,7∙0,1∙0,0718∙0,35=0,0043 |
0,0043∙16/56=0,00123 |
|
|
1,7∙0,1∙0,003∙1=0,00051 |
0,00051∙48/80=0,0003 |
|
Разом |
0,125 |
0,06 |
Для зв`язування 0,06301 кг кисню в оксид вуглецю , необхідновуглецю
0,06∙12/16=0,045 кг.
Електродна маса вносить вуглець
1,7∙0,85=1,445 кг.
Приймаємо , що половина цього вуглецю витрачається на відновлення оксидів і зменшується необхідність в коксі на
((1,445-0,045)/2)/0,8312=0,842 кг
Таким чином, необхідність в коксі на колошу шихти , що вміщуює 100 кг кварциту, дорівнює
50,69-0,842=49,85 кг

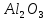
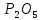

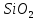
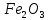
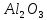
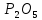

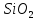 до Si
до Si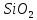 до SiO
до SiO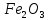 до
Fe
до
Fe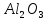 до
Al
до
Al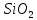 до Si
до Si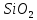 до SiO
до SiO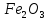 до Fe
до Fe до
Al
до
Al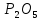 до P
до P до S
до S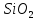 до Si
до Si 0,1∙0,5029∙0,98=0,84
0,1∙0,5029∙0,98=0,84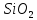 доSiO
доSiO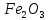 до Fe
до Fe до Al
до Al до S
до S