- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
5.3.5 Поведение серы
Сера является вредной примесью, придает металлу красноломкость, связанную с выделением при кристаллизации стали в межзеренном пространстве сульфидов железа, которые с железом образуют эвтектику, плавящуюся при температурах <1000°С. Слиток стали, содержащей большое количество серы, разрушается при пластической обработке (горячая ковка, штамповка, прокатка) в условиях температур 1200-1250 °С. При этом прослойки, разобщающие зерна стали, находятся в жидком состоянии и способствуют разрушению металла при его деформации. Источниками серы являются шихтовые материалы и, главным образом, чугун. Часть серы содержится в стальном ломе и шлакообразующих материалах. Активность серы в жидкой стали повышают такие элементы как углерод, кремний, алюминий, фосфор, а марганец и медь снижают ее активность. Сера является поверхностно-активным элементом и на поверхностях раздела фаз концентрация ее всегда выше, чем в объеме растворов. При удалении серы из металла в шлак наиболее эффективным является увеличение поверхности контакта металла со шлаком или другой десульфурирующей фазой (например, вдуваемые в металл тонкоизмельченные порошкообразные реагенты). Переход серы из металла в шлак проходит на границе раздела. Главным процессом в удалении серы из металла является ее удаление по реакции
(СaО) + [FeS] = (CaS) + (FeO).
Повышение основности и снижение окисленности шлака способствует десульфурации. Положительную роль оказывает также повышение температуры металла и активное перемешивание ванны.
Часть серы удаляется в газовую фазу в виде SO2. Для снижения содержания серы в металле целесообразна вакуумная обработка жидкого чугуна. Положительную роль в десульфурации металла играет марганец, обладающий заметно более высоким химическим сродством к сере, а продукт взаимодействия с ней не склонен выделяться по границам зерен металла, как сульфид железа, в связи с более высокой температурой плавления (1610 °С). Тем не менее введение марганца не исключает полностью влияния серы на свойства стали, так как хрупкие включения (МnS) в твердом металле снижают его пластичность и ударную вязкость.
5.3.6 Газы в стали
Газы обычно ухудшают качество стали, снижая ее механические свойства. При избыточном содержании кислорода в стали образуются не только пузыри СО в результате взаимодействия с углеродом, но и легкоплавкие оксидные и оксисульфидные включения. Азот снижает пластические свойства стали. Водород способствует появлению таких дефектов, как флокены, шиферный излом и т. п. Такие газы, как кислород, азот и водород, поступающие из влажной атмосферы в рабочее пространство сталеплавильного агрегата, могут растворяться в металле и шлаке.
В железе при обычной температуре кислород находится в виде оксидов и твердого раствора, азот - в виде нитридов и твердого раствора, водород - в твердом растворе в виде атомов или ионов (протонов). В присутствии примесей могут образовываться различные соединения газов с ними. Процесс растворения газов в металле, контактирующем непосредственно с газовой фазой, сопровождается диссоциацией молекул на атомы.
Так, для водородаможно записать этот процесс в виде {Н2} = 2[Н].
Константа равновесия
при этом будет иметь вид
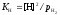 ,
откуда
,
откуда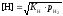 .
.
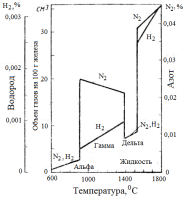
Таким образом, при данной температуре растворимость водорода в железе пропорциональна квадратному корню из парциального давления водорода в газовой фазе. Растворимость водорода в железе с повышением температуры возрастает (см. рис. 1).
|
|
|
Рис.1 – Растворимость водорода и азота в железе при давлении 1 ата |
Однако в различных модификациях железа растворимость его различна. Присутствие примесей изменяет растворимость водорода в металле. Такие элементы, как углерод, кремний, бор, алюминий снижают, а титан, ванадий повышают растворимость водорода в металле. Слабо влияют на растворимость водорода в металле никель, хром, марганец, кобальт, молибден. Скачкообразное изменение растворимости водорода при переходе из одной модификации железа в другую обусловливает выделение водорода из металла, нарушение его сплошности и образование мельчайших дефектов, называемых флокенами. Водород, присутствующий в твердом растворе, увеличивает хрупкость металла вследствие искажения его кристаллической решетки, одновременно снижая пластичность. Это отрицательно влияет на служебные свойства металла.
Растворимость
азотав железе, контактирующим с
газовой фазой при заданной температуре,
также пропорциональна квадратному
корню из парциального давления в
атмосфере, находящейся над расплавом,
т. е. можно записать {N2}
= 2[N],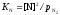 ,
,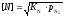 .
.
С повышением температуры растворимость азота в модификациях α-Fе и δ-Fе растет, а в γ-Fе снижается (рис. 1). В отличие от водорода, растворимость азота в модификации γ-Fе с повышением температуры снижается. В различных модификациях железа растворимость азота также различна. Это приводит к скачкообразному изменению растворимости азота в металле при его охлаждении. Очень сильное снижение растворимости азота при переходе металла из жидкого состояния в твердое и при превращении γ-Fе в α-Fе особенно при высоких скоростях охлаждения способствует образованию перенасыщенного азотом твердого раствора. Из этого раствора в процессе службы изделий из такого металла выделяются нитриды по границам зерен, повышающие твердость и хрупкость металла и снижающие его пластичность. Это явление называютстарениемметалла, проявляющимся при эксплуатации изделий из него в условиях низких температур. Для предотвращения последнего необходимо использовать чистые по содержанию азота шихтовые материалы, создать условия для интенсивного кипения металла в процессе выплавки, осуществлять продувку инертным газом, вакуумирование и т. п. Присутствующие в металле титан, ванадий, ниобий, церий, хром, заметно повышают, а углерод, никель, фосфор, кремний снижают растворимость азота в железе.
В твердом железе растворимость кислороданевелика. Например, в твердой фазе δ-Fе при температуре плавления железа при равновесных условиях может содержаться не более 0,043 % [О], а в γ-Fе в десять раз ниже. Растворимость кислорода в α-Fе не превышает 0,002 %. После кристаллизации расплава избыточный кислород (сверх равновесного в α-Fе) переходит в оксидные неметаллические включения (МnО,SiO2, Аl2О3и т. п.), образующиеся после введения раскислителей, обладающих более высоким химическим сродством к кислороду, чем железо. Такие включения находятся в жидкой стали, их температура плавления превышает температуру последней, поэтому они в значительной части относятся к твердофазным. Наряду с оксидными включениями в стали присутствуют включения, представляющие собой сульфиды (Fе3S, Мn3Sи т.п.), карбиды (Fе3С, Мn3С, Сг3С2и т.п.), нитриды (ZrN2,VN,NiNи т. п.), фосфиды (Fе3Р,Fе2Р и т. п.), а также комплексные включения типа оксисульфидов, карбонитридов, силикатов и т. д., образующиеся в ходе технологического процесса производства жидкой стали и ее кристаллизации после разливки.
Источниками неметаллических включений могут быть также шихтовые материалы, огнеупоры, легирующие добавки.
Неметаллические включения, образующиеся в результате протекания реакций в жидком или затвердевающем металле, называют эндогенными (природными), а внесенные со стороны в готовом виде - экзогенными (случайными). Обычно в готовой стали может содержаться до 0,02 % оксидных включений, хотя в расплавленном металле их значительно больше. Поскольку в большинстве случаев неметаллические включения (особенно оксиды и сульфиды) являются нежелательными, содержание их в жидкой стали стремятся снизить, используя различные методы удаления из расплава до начала его кристаллизации.