- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
4.2 Термодинаміка відновлення оксидів твердим вуглецем
Прийнято називати відновлення газами непрямим, а твердим вуглецем – прямим відновленням. Безпосередня взаємодія вуглецю з твердими оксидами обмежена у зв'язку з недосконалістю контакту між кусковими матеріалами. Пряме відновлення протікає переважно з участю газової фази і складається з двох стадій
+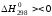
2. СО2
+ С = 2СО 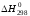 = 172,13 кДж
= 172,13 кДж
 3.
МеО + С = Ме + СО
3.
МеО + С = Ме + СО
За рахунок реакції газифікації вуглецю вуглекислим газом з газової фази безперервно відводитися СО2, що утворюється при відновленні, і регенерується СО, яка знову взаємодіє з твердим оксидом. Але можна одержати і іншу реакцію прямого відновлення
+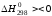
2. СО2
+ С = 2СО 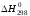 = 172,13 кДж
= 172,13 кДж
 4.
2МеО + С = 2Ме + СО2
4.
2МеО + С = 2Ме + СО2
У області температур більше 950–1000С вуглекислий газ СО2 у присутності вуглецю переходить в СО і ця реакція втрачає значення. Пряме відновлення вимагає витрат теплоти. Число ступенів свободи рівне С = 3 + 2 – 4 = 1. Для однозначної характеристики рівноваги необхідно задатися або температурою, або тиском.
|
|
|
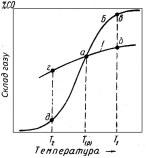
Рис. 4.3 - Поєднання графіків зміни рівноважного складу газу з температурою для екзотермічної реакції непрямого відновлення і реакції СО2 + С = 2СО (б) при Р=const |
На рис. 4.3 суміщені графіки рівноважних складів газової фази для реакції непрямого відновлення оксидів металів газом СО і реакції газифікації вуглецю вуглекислим газом. Перетин кривих в крапці а показує, що при постійному тиску одночасна рівновага реакцій (1) і (2) можливо при єдиній температурі Тр.. Розглянемо дану систему при інших температурах. Якщо Т1 > Тр, система в цілому не може досягти рівноваги. Припустимо, реакція непрямого відновлення знаходиться в рівновазі, чому відповідає склад газу, визначуваний крапкою б. Але дана газова суміш не нейтральна по відношенню до вуглецю: крапка б розташована нижче за крапку в, тобто газ в крапці б містить надлишок СО2 в порівнянні з рівноважною концентрацією для реакції (2). Остання піде у бік окислення вуглецю або у напрямі зниження % СО2 і збільшення % СО в газовій фазі, загальній для обох перетворень (1) і (2). Це порушує рівновагу реакції (1), яка зміщується управо. Сумарним результатом буде односторонній перебіг реакції прямого відновлення.
В цілому процес прямого відновлення можна представити наступною схемою
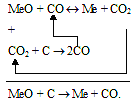
Якщо Т1 < Тр., то в цій області виберемо склад газової фази, який відповідає точці г або рівновазі перетворення (1). Проте такий стан нестійкий, оксид вуглецю буде дисоціювати, концентрація СО знизиться, а концентрація СО2 зросте. В результаті реакція (1) йтиме в протилежному напрямі і сумарне перетворення, представлене схемою
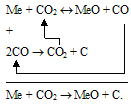
відповідатиме односторонньому окисленню металу.
Розглянемо особливості прямого відновлення для оксидів різної хімічної міцності (рис. 4.4).
|
|
|
Рис. 4.4 - Поєднання графіків зміни рівноважного складу газу з температурою для реакції непрямого відновлення різних оксидів і реакції СО2 + С = 2СО (б) при Р=const |