
Модуль
.docx№1. (биогенные элементы, макроэлементы, микроэлементы)Биогенные элементы Углерод Водород Азот КислородЭти макроэлементы называют биогенными (органогенными) элементами или макронутриентами .Из макронутриентов преимущественно построены такие органические вещества, как белки, жиры, углеводы и нуклеиновые кислоты. МакроэлементыЭти элементы слагают плоть живых организмов. К макроэлементам относят те элементы, рекомендуемая суточная доза потребления которых составляет более 200 мг. Макроэлементы, как правило, поступают в организм человека вместе с пищей. В частности, для агрономов стало очевидным, что даже достаточное количество «макроэлементов» в удобрениях (троица NPK — азот, фосфор, калий) не обеспечивает нормального развития растений.Микроэлементами называются элементы, содержание которых в организме мало, но они участвуют в биохимических процессах и необходимы живым организмам. Рекомендуемая суточная доза потребления микроэлементов для человека составляет менее 200 мг.
№2 (учение Вернадского о биосфере, проблемы загрязнения биосферы) В структуре биосферы Вернадский выделял семь видов вещества:живое;биогенное (возникшее из живого или подвергшееся переработке);косное (абиотическое, образованное вне жизни);биокосное (возникшее на стыке живого и неживого; к биокосному, по Вернадскому, относится почва);вещество в стадии радиоактивного распада;рассеянные атомы;вещество космического происхождения.Важным этапом необратимой эволюции биосферы Вернадский считал её переход в стадию ноосферы. Различают два основных вида загрязнений: природное и антропогенное загрязнения. Природное загрязнение возникает в результате естественных причин - извержения вулканов, землетрясений, катастрофических наводнений и пожаров. Антропогенное загрязнение - результат деятельности человека.Рассмотрим некоторые черты современного состояния биосферы и процессы, происходящие в ней. Глобальные процессы образования и движения живого вещества в биосфере связаны и сопровождаются круговоротом огромных масс вещества и энергии. В отличие от чисто геологических процессов биогеохимические циклы с участием живого вещества имеют значительно более высокие интенсивность, скорость и количество вовлеченного в оборот вещества.
________________________________________________________________________________________________________
№3 (польза Вернадского, Виноградова, Ковальского, Венчикова у свойства хим элементов, строение атомов) Содержание основных химических элементов в организмах, в мг/100 г. сухого вещества (из книги В.В.Ковальского “Геохимическая экология”, М., 1974). Виноградов Геохимия редких и рассеянных химических элементов в почвах, 2 изд., М., 1957,Химическая эволюция Земли, М., 1959,О происхождении вещества земной коры, «Геохимия», 1961, № 1, с. 3-29 В 1927 году организовал в Академии наук СССР Отдел живого вещества. Однако термин «живое вещество» он употреблял в смысле, отличном от работО. Б. Лепешинской — как совокупность живых организмов биосферы[6].Вернадским опубликовано более 700 научных трудов.Основал новую науку — биогеохимию и сделал огромный вклад в геохимию. С 1927 года до самой смерти занимал должность директора Биогеохимической лаборатории при Академии наук СССР. Был учителем целой плеяды советских геохимиков.
№4 ( строение атомов s-елементов , топография s-елементов, применение s-елементов в медицине) К s-элементам относятся элементы главных подгрупп I и IIгрупп. Их электронные структуры имеют вид [инертн. газ]ns ; [инертн. газ]ns Эти элементы отличаются тем, что в атомном состоянии высокоэнергичный электрон находится на s-орбитали. Исключая водород и гелий, эти электроны очень легко переходят и формируются в позитивные ионы при химической реакции. Конфигурация гелия химически весьма стабильна, следовательно, именно по этому гелий не имеет стабильных изотопов; иногда, благодаря этому свойству, его объединяют с инертными газами. Оказывается, металлы содержатся не только в земной коре, но и в организме человека. Так как кальций и магний это активные металлы, то они встречаются в виде соединений – минералов, солей в которых они находятся в виде ионов. В организме человека они тоже находятся в виде ионов. Если принять массу человека за 70 кг. Из них на кальций приходится 1 кг 700 г, а на магний – 42 г. Соединения бериллия ток–сичны и вызывают ряд заболеваний (бериллиевый ра–хит, бериллиоз и т. д.). Особенно токсичны летучие соединения бериллия. Топография магния в организме человека такова: в наибольшей степени магний концентрируется в ден–тине и эмали зубов, костной ткани. Кальций относится к макроэлементам. Общее содер–жание его в организме – 1,4%. Кальций содержится в каждой клетке человеческого организма. Основная мас–са кальция находится в костной и зубной тканях.
__________________________________________________________________________________________________________
№5 ( d- елементы)
d-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроныкоторых с наивысшей энергией занимают d-орбиталь.Данный блок представляет собой часть периодической таблицы; в него входят элементы от 3 до 12группы[1][2]. Элементы данного блока заполняют d-оболочку d-электронами, которая у элементов начинается s2d1 (третья группа) и заканчивается s2d10 (двенадцатая группа). Однако существуют некоторые нарушения в этой последовательности, например, у хрома s1d5 (но не s2d4) вся одиннадцатая группа имеет конфигурацию s1d10 (но не s2d9). Одиннадцатая группа имеет заполненные s- и d-электроны. Mn(OH)2 легко окисляется на воздухе Mn(OH)2 + 1/2O2 = MnO2 + H2O. Соединения Mn(IV) легко восстанавливаются до Mn (II): MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O, но сильными окислителями окисляется до Mn (VII). соединения хрома (VI) (CrO3, K2CrO4, K2Cr2O7) и марганца(VII) (Mn2O7, KMnO4) – сильные окислители, а WO3, Re2O7 и соли соответствующих им кислот (H2WO4, HReO4) восстанавливаются с трудом.
№6 (Типы окисл востанов реакций )
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:Н2S + Cl2 → S + 2HClВнутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:2H2O → 2H2 + O2Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления, например:Cl2 + H2O → HClO + HClРепропорционирование (компропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:NH4NO3 → N2O + 2H2OДля запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:Отдать — Окислиться, Взять — Восстановиться (слова начинаются с одинаковых букв).При отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное.Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
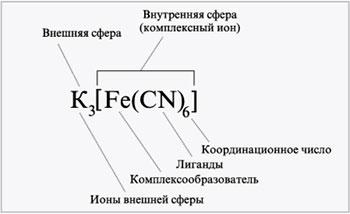
№7 ( р-и комплексообразования, т-я Вернера, Дисоциация комплексных соединений, константа нестойкости) Под комплексными соединениями понимают соединения, обра-зованные-двумя или несколькими простыми соединениями, которые могут существовать самостоятельно. При написании формул простых соединений ближайшую координационную сферу выделяют квадратными скобками, например [Си (ЫНз)4] С12. Диссоциация комплексного соединения проходит по двум ступеням: а) диссоциация на комплексный и простой ионы с сохранением внутренней сферы комплекса и б) диссоциация внутренней сферы, приводящая к разрушению комплекса. Диссоциация по первой ступени проходит по типу диссоциации сильных электролитов, а диссоциация комплексного иона - по типу диссоциации слабых электролитов. [1]
Диссоциация
комплексного соединения будет
тем полнее, чем сильнее сдвинуто вправо
это равновесие. [2]
 ____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
№8 ( методы количественного анализа, закон эквивалентов, индикаторы) Классическими методами количественного анализа являются гравиметрический (весовой) анализ и титриметрический (объемный) анализ. З-н эквивалентов - вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. Индикатор в химии — вещество, дающее характерные (обычно цветные) химические реакции и употребляющиеся при анализе (например лакмус, метилоранж, куркумин,фенолфталеин, розоловая кислота и др.)
№9 (метод нейтрализации, титрование, кислотно-лужные индикаторы) Нейтрализации метод — объемный (титриметрический) метод определения концентрации кислот (ацидиметрия) и щелочей (алкалиметрия) в растворах.В основе метода нейтрализации лежит использование реакции нейтрализации, т. е. соединения водородных и гидроксильных ионов: Н+ + ОН- =Н20.Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать, начиная от других отметок, не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования (точку эквивалентности) определяют индикаторами или физико-химическими методами (по электропроводности, светопропусканию, потенциалу индикаторного электрода и т. д.). По количеству пошедшего на титрование рабочего раствора рассчитывают результаты анализа. Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH).____________________________________________________________________________________________________
№10 (растворы электролитов, закон Оствальда) Электролиты - вещества, проводящие в расплавах или водных растворах электрический ток. Электролиты в расплавах или водных растворах диссоциируют на ионы.. Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
![]()
________________________________________________________________________________________________________№11 (свойства растворов сильных электролитов, характеристика слюны) принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
|
|
|
|
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов. СЛЮНА — прозрачный вязкий секрет слюнных желёз, выделяемый в ротовую полость. В состав слюны входит вода (98,5 99,5% ) и растворённые в ней неорганич. и органич. соединения. С. имеет слабокислую или слабощелочную реакцию (рН 5,6 7,6). ____________________________________________________________________________________________________
№12 (Буферные системы, уровнение Гендерсона – Гассельбаха) Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли(напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях. Уравнение Гендерсона-Гассельбаха (1908) - математическое (аналитическое) выражение, характеризующее возможностибуферной системы. Henderson, Lawrence Joseph, 1848-1942, биохимик, США. Hasselbalch («Hasselbach»), Karl Albert, 1874-1962, биохимик, Дания. Уравнение показывает как зависит кислотно-основное равновесие буферного раствора от свойств компонентовкислотно-основной буферной системы и от количественного соотношения этих компонентов в растворе. Показателем кислотно-основного равновесия в растворе является водородный показатель, pH. Свойство кислоты (её способность распадаться на ионы), как составляющей буферной системы, характеризуется значением константы равновесия, константы диссоциации кислоты, Ka. (или в логарифмической форме pKa = – lgK, в частности, если K = 10–11, то pK = 11). Количественая структура (состав) буферной системы может быть оценена в виде отношения соль/кислота (эквиваленты, эквивалентная масса). Учитывая сказанное, уравнение Гендерсона-Гассельбаха выглядит следующим образом: pH = pKa + lg (соль/кислота).________________________________________________________________________________________________________________________________________________________________________
№13 ( буферные емкости, фосфатный буфер, Алкалоз.) В химии буферная ёмкость раствора — определяет способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+) при условии, что в растворе протекают химические реакции, или при добавлении к раствору электролитов. Натрий-фосфатный буфер (англ. Phosphate buffered saline, PBS) — буферный раствор, используемый в биологических исследованиях. Представляет собой водный раствор солей, содержащий хлорид натрия, фосфат натрия, хлорид калия и фосфат калия. Алкало́з — увеличение pH крови (и других тканях организма) за счёт накопления щелочных веществ.
________________________________________________________________________________________________________№14
(Закон Рауля, Идеальные растворы, Осмос,
Закон Вант-Гоффа)
Первый
закон Рауля
Парциальное
давление насыщенного
пара компонента раствора прямо
пропорционально его мольной
доле в
растворе, причём коэффициент
пропорциональности равен давлению
насыщенного пара над чистым компонентом.
Идеальным раствором называют
раствор, для которого выполняется
первый закон
Рауля.
![]()
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя). Уравнение, которое описывает это правило следующее:
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
№15 (Изотонический коэффициент , осмотическое давлении плазмы крови) Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрациипри неизменных прочих параметрах системы. Минеральные вещества плазмы представлены катионами (Na+, К+, Са++, Mg+ + ) и анишамии (С1~, НСО~, Н2Р04-, НР04–, S04–). От содержания главным образом минеральных веществ зависит осмотическое давление крови, а последнее в свою очередь связано с осмотическим давлением тканевой жидкости. Осмотическое давление определяет переход воды из тканей в кровь и из крови в ткани. Поэтому резкие изменения осмотического давления в крови и в тканях могут вести либо к набуханию клеток, либо к потере ими воды.
№16 (Химическая термодинамика, термодинамическая система – открытая и закрытая, термодинамический процесс) Хими́ческая термодина́мика — раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики. а) Система открытая, если возможен обмен энергией и веществом. б) Система закрытая, если обмен энергией возможен, а обмен веществом невозможен. ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС- всякое изменение, происходящее в термодинамич. системе и связанное с изменением хотя бы одного из её параметров состояния.
№17 (Первый закон термодинамики, Энтальпия, Закон Гесса) 1-й закон — первое начало термодинамики. Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как δQ = δA + dU, где dU есть полный дифференциал внутренней энергии системы, а δQ и δA есть элементарное количество теплоты, переданное системе, и элементарная работа, совершенная системой соответственно. энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении. Закон Гесса -Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
№18
(Второй закон термодинамики. Энтропия,
энергия Гиббса)
2-й закон — второе
начало термодинамики: Второй
закон термодинамики исключает возможность
создания вечного
двигателя второго
рода. Термодинамическая
энтропия —
- термодинамическая функция, характеризующая
меры неупорядоченности системы, т.е.
неоднородности расположения движения
её частиц.термодинамической
системы.
Классическим
определением энергии Гиббса является
выражение![]() где U — внутренняя
энергия, P — давление, V — объем, T —
абсолютная температура, S — энтропия.
где U — внутренняя
энергия, P — давление, V — объем, T —
абсолютная температура, S — энтропия.
№19
(Химическая кинетика, Константа скорости)
Химическая
кинетика или
кинетика химических реакций —
раздел физической
химии,
изучающий закономерности протекания
химических реакций во времени, зависимости
этих закономерностей от внешних условий,
а также механизмы химических превращений
Важным
понятием химической кинетики
является скорость
химической реакции.
Эта величина определяет, как
изменяется концентрация компонентов
реакции с течениемвремени. Реакция
нулевого порядка
V0 = k0
Реакция
первого порядка
![]() Реакция
второго порядка
Реакция
второго порядка
![]() Константа
скорости реакции зависит от температуры,
от природы реагирующих веществ, но не
зависит от их концентрации.
Константа
скорости реакции зависит от температуры,
от природы реагирующих веществ, но не
зависит от их концентрации.
№20
( Правило Вант-Гоффа, энергия активации)
Правило
Вант-Гоффа —
эмпирическое правило, позволяющее в
первом приближении оценить влияние
температуры на скорость химической
реакции в небольшом температурном
интервале (обычно от 0 °C до 100 °C)
![]() Энергия активации в химии и биологии —
минимальное количество энергии,
которое требуется сообщить системе (в
химии выражается вджоулях на моль),
чтобы произошла реакция.
Термин введён Сванте
Августом Аррениусом в 1889.
Типичное обозначение энергии реакции.
Энергия активации в химии и биологии —
минимальное количество энергии,
которое требуется сообщить системе (в
химии выражается вджоулях на моль),
чтобы произошла реакция.
Термин введён Сванте
Августом Аррениусом в 1889.
Типичное обозначение энергии реакции.
________________________________________________________________________________________________________
№ 21 ( Кинетика сложных реакций, Антиоксиданты) СЛОЖНЫЕ РЕАКЦИИ. Хим. р-ция реализуется как совокупность множества дискретных актов хим. превращения, в каждом из к-рых участвует лишь одна или небольшое число частиц (молекул, атомов, ионов). Если среди актов р-ции имеются химически различающиеся, то р-ция наз. сложной. К сложным реакциям относят наиб. распространенные классы р-ций-каталитические (см.Катализ) и цепные реакции. Антиоксиданты (антиокислители) — ингибиторы окисления, природные или синтетические вещества, способные замедлять окисление (рассматриваются преимущественно в контексте окисления органических соединений).
№ 22 (Химическое равновесие , константа химического равновесия, Принцип Ле Шателье) Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 +
В2 ⇄
2AB
Конста́нта равнове́сия —
величина, определяющая для данной химической
реакции соотношение
между термодинамическими активностями (либо,
в зависимости от условий протекания
реакции, парциальными
давлениями, концентрациями или фугитивностями)
исходных веществ и продуктов в
состоянии химического
равновесия (в
соответствии с законом
действующих масс)
Принцип Ле Шателье — Брауна (1884 г.) —
если на систему, находящуюся в устойчивом
равновесии, воздействовать извне,
изменяя какое-либо из условий равновесия
(температура, давление, концентрация),
то в системе усиливаются процессы,
направленные на компенсацию внешнего
воздействия.
![]() Например,
в реакции синтеза аммиакаN2 +
3H2 ⇄
2NH3 +
Q
Например,
в реакции синтеза аммиакаN2 +
3H2 ⇄
2NH3 +
Q
№ 23 ( Реакции выпадения и растворения , производная растворимости ) Химические реакции разложения: огенная надпись
Эффектную химическую
реакция разложения можно
провести, имея калийную силитру.
Химические
реакции растворения стекла в плавиковой
кислотеДейстительно,
стекло легко растворяется. Стекло - это
очень вязкая жидкостьПроизведение
растворимости (ПР,
Ksp) —
произведение концентрации ионов
малорастворимого электролита в
его насыщенном
растворе при
постоянной температуре и давлении.
Произведение растворимости — величина
постоянная.При постоянной температуре
в насыщенных водных растворах
малорастворимых электролитов
устанавливается равновесие между
твердым веществом и ионами, образующими
это вещество. Например, в случае для
CaCO3 это
равновесие можно записать в виде:![]() Константа
этого равновесия рассчитывается по
уравнению:
Константа
этого равновесия рассчитывается по
уравнению:
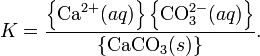 В
приближении идеального
раствора с
учетом того, что активность чистого
компонента равна единице, уравнение
упрощается до выражения:
В
приближении идеального
раствора с
учетом того, что активность чистого
компонента равна единице, уравнение
упрощается до выражения:
![]() Константа
равновесия такого
процесса называется произведением
растворимости.В
общем виде, произведение растворимости
для вещества с формулой AmBn,
которое диссоциирует на m ионов An+ и
n ионов Bm-,
рассчитывается по уравнению:
Константа
равновесия такого
процесса называется произведением
растворимости.В
общем виде, произведение растворимости
для вещества с формулой AmBn,
которое диссоциирует на m ионов An+ и
n ионов Bm-,
рассчитывается по уравнению:
![]() где
[An+]
и [Bm-] —
равновесные молярные концентрации
ионов, образующихся при электролитической
диссоциации.
где
[An+]
и [Bm-] —
равновесные молярные концентрации
ионов, образующихся при электролитической
диссоциации.
№ 24 (Катализ, гомогенный, гетерогенный, микрогетерогенный катализ)— избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.[ Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO; H2О2 + IO → H2О + О2 + I. При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
№ 25 ( ферменты, как биологические катализаторы, Механизм действия ферментов) Ферменты - это специфические белки, входящие в состав всех клеток и тканей живых организмов играющие роль биологических катализаторов. Механизм действия ферментов Различают три стадии в механизме ферментативного катализа: образование фермент-субстратного комплекса; образование комплекса «фермент-продукт реакции»; отщепление продуктов реакции от фермента.
№ 26
(Электродные потенциалы, уравнение
Нернста, измерение электродных потенциалов
)
Электро́дный потенциа́л —
разность электрических
потенциалов между электродом и
находящимся с ним в контакте электролитом (чаще
всего между металлом ираствором электролита).
Уравнение Нернста —
уравнение,
связывающее окислительно-восстановительный
потенциал системы
с активностями веществ,
входящих в электрохимическое
уравнение,
и стандартными
потенциалами окислительно-восстановительных
пар.
![]() Практическое
значение имеют относительные электродные
потенциалы, обычно называемые
просто электродные
потенциалы,
представляющие собой разность электродных
потенциалов рассматриваемого электрода
и электрода сравнения — чаще всего
нормального водородного
электрода,
электродный потенциал которого условно
принимается равным нулю (для водных
систем).
Практическое
значение имеют относительные электродные
потенциалы, обычно называемые
просто электродные
потенциалы,
представляющие собой разность электродных
потенциалов рассматриваемого электрода
и электрода сравнения — чаще всего
нормального водородного
электрода,
электродный потенциал которого условно
принимается равным нулю (для водных
систем).
№27 (Роль окислительно – восстановительных реакций, Уравнение Петерса) окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается Окислительно-восстановительные реакции часто протекают с участием протонов:
