
Воспаление
.docxКлеточные медиаторы воспаления
|
Вид медиатора |
Источник |
Эффекты |
|
Биогенные амины |
||
|
Гистамин |
Тучные клетки, базофилы, тромбоциты |
Боль, жжение, зуд, повышение проницаемости сосудистой стенки, адгезивности эндотелия, секреции слизи, образования кининов, расширение артериол, стимуляция фагоцитоза, бронхоспазм (Н1), бронходилатация (Н2) |
|
Серотонин |
Тромбоциты, эозинофилы |
Повышение проницаемости сосудистой стенки, агрегации тромбоцитов, бронхоспазм, боль, спазм повреждённых сосудов (особенно венул), расширение неповреждённых артериол (усиление образования NO) |
|
Адреналин, норадреналин |
Нейроны симпатической нервной системы, надпочечники |
Спазм сосудов, активация гликолиза, липолиза, перекисного окисления липидов, увеличение транспорта Са2+ в клетки, агрегация тромбоцитов |
|
Ацетилхолин |
Нейроны парасимпатической нервной системы |
Расширение микрососудов, стимуляция фагоцитоза, пролиферации и дифференцировки клеток |
|
Пептиды и белки |
||
|
Интерлейкины 1–4, 6, 8 |
Моноциты, макрофаги, лимфоциты, эндотелий |
Хемотаксис лейкоцитов, активация адгезивности эндотелия, пролиферации, лихорадка, лейкоцитоз, синтез белков острой фазы, пролиферация и дифференцировка лимфоцитов |
|
Интерфероны |
Моноциты, лимфоциты, макрофаги |
Активация макрофагов, NK-клеток, усиление экспрессии антигенов HLA, презентации антигенов, пролиферации, цитотоксичности, противовирусное действие, лихорадка |
|
Катионные белки |
Нейтрофилы, макрофаги |
Бактерицидный и цитоцидный эффект, увеличение проницаемости сосудов, миграции лейкоцитов |
|
Гидролитические ферменты лизосом |
Собственные повреждённые клетки, фагоциты, микроорганизмы |
Увеличение проницаемости клеточных мембран, стенок сосудов, бактерицидное действие, разрушение коллагена, эластина, межклеточного вещества |
|
Фактор некроза опухолей (ФНО) |
Макрофаги, лимфоциты, эндотелий |
Активация лейкоцитов, их адгезии, синтеза белков острой фазы, ангиогенеза, фиброгенеза, протеолиза, липолиза, лихорадка |
|
Производные арахидоновой кислоты |
||
|
Простагландины, фактор активации тромбоцитов |
Синтез в мембранах лейкоцитов, тромбоцитов, тучных клеток, базофилов, эндотелия |
Простагландин Е2 — увеличение проницаемости сосудистой стенки, миграции лейкоцитов, расширение микрососудов, боль, лихорадка, дегрануляция тучных клеток, бронходилатация. Простагландин I2 (простациклин) — расширение микрососудов, стимуляция фибринолиза, снижение агрегации тромбоцитов. Простагландин F2α — спазм сосудов, бронхов, кишечника, подавление миграции лейкоцитов. Простагландин D2 — повышение проницаемости сосудистой стенки, расширение микрососудов. Тромбоксан А2 — спазм сосудов, бронхов, усиление хемотаксиса, миграции лейкоцитов, проницаемости сосудистой стенки, адгезивности эндотелия, агрегации и адгезии тромбоцитов |
|
Лейкотриены |
Синтез под влиянием липоксигеназы |
В4 — усиление краевого стояния лейкоцитов, хемотаксиса, адгезии тромбоцитов. С4, D4, Е4 — повышение проницаемости сосудистой стенки, спазм сосудов, бронхов, кишечника |
|
Активные радикалы кислорода |
||
|
|
|
Прямое повреждающее действие на клетки, микроорганизмы, повышение проницаемости сосудистой стенки, изменение активности ферментов, модификация рецепторов |
|
Нуклеотиды, нуклеозиды |
||
|
АДФ |
|
Тромбообразование, сладж |
|
Аденозин |
|
Расширение артериол |
Плазменные медиаторы воспаления
|
Вид медиатора |
Источник |
Эффекты |
|
Кинины (каллидин, брадикинин) |
Все ткани и жидкости организма |
Увеличение проницаемости стенок сосудов, расширение артериол, стимуляция хемотаксиса фагоцитов, боль, спазм бронхов, кишечника, усиление пролиферации, коллагеногенеза, активация циклооксигеназы |
|
Система комплемента |
Печень, моноциты, лейкоциты |
Активация хемотаксиса, бактерицидность, цитолиз, опсонизация, повышение проницаемости сосудистой стенки, стимуляция липоксигеназы, циклооксигеназы, лейкоцитарной адгезии, расширение капилляров |
|
Система гемостаза |
Печень |
Образование тромбов, расщепление сгустка фибрина, усиление адгезии лейкоцитов, пролиферации фибробластов |


Интерлейкины (ИЛ) - цитокины, ответственные за межклеточные взаимодействия между лейкоцитами Описано ок. 20 интерлейкинов.
Ил-1 продуцируется гл. обр. макрофагами и в меньшей степени дендритными клетками, эндотелиоцитами, фибробластами, NK, кератиноцитами, некоторыми клонами Th2. Он стимулирует продукцию Т-хелперами ИЛ-2, способствует проявлению рецепторов к ИЛ-2 на Т-лимфоцитах, влияет на созревание В-лимфоцитов, стимулирует образование молекул МНС, а также оказывает провоспалительное и пирогенное действие. Стимулирует образование гепатоцитами белков острой фазы, усиливает функции нейтрофилов, NK, обеспечивает взаимосвязь иммунной, нервной и эндокринной систем. Оказывает провоспалительное и пирогенное действие, обеспечивает взаимосвязь иммунной, нервной и эндокринной систем.
Ил-2 вырабатывается Т-лимфоцитами, гл. обр. Thl, а также цитотоксическими лимфоцитами (CD8+) 1 порядка. Он активирует дифференцировку Thl и Т-киллеров, стимулирует NK и синтез иммуноглобулинов В-лимфоцитами.
Ил-3 продуцируется Т-лимфоцитами и стволовыми клетками. Является ростовым фактором стволовых и ранних предшественников гемопоэтических клеток.
Ил-4 продуцируется гл. обр. Th2. Он стимулирует дифференцировку Th0 в Th2, стимулирует синтез иммуноглобулинов В-лимфоцитами, подавляет генерацию цитотоксических лимфоцитов, NK, а также продукцию ИФН-g и противоопухолевую активность макрофагов.
Ил-5 синтезируется Th2. Способстует пролиферации и дифференцировке стимулированных В-лимфоцитов, усиливает продукцию IgA, активирует эозинофилы.
Ил-6 вырабатывается макрофагами, Т- и В-лимфоцитами. Стимулирует пролиферацию тимоцитов, В-лимфоцитов, активирует предшественников цитотоксических лимфоцитов, гранулоцитов и макрофагов, стимулирует образование гепатоцитами белков острой фазы, оказывает провоспалительное действие, обеспечивает взаимосвязь иммунной, нервной и эндокринной систем.
ИЛ-7 продуцируется стромальными клетками костного мозга. Является ростовым фактором пре-В- и пре-Т-лимфоцитов.
ИЛ-8 синтезируется моноцитами, макрофагами, фибробластами. Вызывает миграцию нейтрофилов и базофилов в очаг воспаления и их дегрануляцию, выделение супероксидного радикала. Стимулирует ангиогенез.
ИЛ-9 продуцируется гл. обр. Т-лимфоцитами. Стимулирует пролиферацию Т-лимфоцитов, активирует тучные клетки, усиливает эффекты эритропоэтина.
ИЛ-10 синтезируется Th2 а также цитотоксическими Т-лимфоцитами второго порядка и макрофагами. Стимулирует пролиферацию и дифференцировку В-лимфоцитов, подавляет синтез ИЛ-2 и ИФН-у клетками Thl, угнетает продукцию провоспалительных цитокинов.
ИЛ-11 продуцируется стромальными клетками костного мозга. Стимулирует деление и дифференцировку предшественников гемопоэза, колониеобразование мегакариоцитов, увеличивает количество тромбоцитов и эритроцитов в периферической крови. Угнетает продукцию провоспалительных цитокинов.
ИЛ-12 продуцируют моноциты, макрофаги и, в меньшей степени, В-лимфоциты и дендритные клетки. Стимулирует рост и дифференцировку Th (Th0 => Thl), Т-киллеров, NK. Индуцирует продукцию ИФН-g Т-лимфоцитами и NK, угнетает апоптоз Thl, синтез IgE. Вместе с ИЛ-4 регулирует баланс Thl и Th2.
ИЛ-13 синтезируется Th2. Стимулирует рост и дифференцировку В-лимфоцитов, подавляет функцию моноцитов/макрофагов, в частности секрецию провоспалительных цитокинов.
ИЛ-14 продуцируется в основном Т-лимфоцитами. Усиливает пролиферацию В-лимфоцитов и подавляет продукцию иммуноглобулинов.
ИЛ-15 вырабатывается моноцитами, эпителиоцитами и гладкомышечными клетками. По действию на Т-лимфоциты ИЛ-15 сходен с ИЛ-2, что объясняется способностью специфически связываться с ИЛ-2-рецепторами. Активирует NK и В-лимфоциты.
ИЛ-16 синтезируется эозинофилами и CD8+ Т-лимфоцитами. Является хемоаттрактантом для CD4+ лимфоцитов.
ИЛ-17 продуцируется активированными CD4 Т-лимфоцитами. Основными клетками-мишенями цитокина являются эпителиоциты, эндотелиоциты и фибробласты. Он усиливает выработку ИЛ-б, ИЛ-8, гранулоцитарного КСФ, простатландина Е2, увеличивает экспрессию ICAM-1, стимулирует активность фибробластов.
ИЛ-18 образуется активированными макрофагами, а также гепатоцитами. Стимулирует синтез Т-лимфоцитами ИФН-g, макрофагами - ИЛ-1, ИЛ 8 и ФНО. Кроме того, он активирует NK.

Альтерация. Определение Альтерация (дистрофия, некроз) - первая фаза тканевых изменений в зоне воспаления характеризуется избыточным освобождением биологически активных веществ, лизосомальных ферментов, а, соответственно, стойким нарушением структуры и функции ткани. В зоне любой альтерации происходит движение в клетку, калий из клетки, что приводит к деполяризации в центре некроза, реполяризация невозможна из-за резкого повышения проницаемости клеточных мембран. Клетки перестают функционировать, выпадает болевая (термическая) чувствительность.По периферии альтерации возникает частичная деполяризация. Клетки становятся возбудимыми, возрастает их функция, усиливается и болевая чувствительность, которая приводит к появлению боли (dolor). В зоне альтерации отмечаются набухания митохондрий, просветление их матрикса, дезорганизация юрист, дефицит АТФ и угнетение всех энергозависимых процессов в клетке. Всегда повышается проницаемость мембран лизосом, активируются их форматы, которые выходят в цитоплазму. Начинается аутолиз клеток, распад их соединительной ткани под действием коллагеназы, элластазы, разрушающих белковый остов соединительной ткани. Фосфолипаза А2 лизосом индуцирует образование эйкозалоидов: простагландинов, тромбоксана, лейкотриенов. Идет распад лецитина, который становится источником образования полиненасыщенных жирных кислот. Активируется фермент липоксигеназа, который приводит к трансформации незаменимых кислот в лейкотриены А, В, С, Д, Е., которые вызывают расширение сосудов, повышает их проницаемость, стимулирует процессы эмиграции лейкоцитов и экссудации. Активация арахидоновой кислоты провидит к активации простагландинсинтетазы. Архидоновая и ланолиновая кислота трансформируются в простагландин G2. В процессе метаболизма простагландинов образуется большое количество свободных радикалов, повреждающих мембраны клеток. Простагландин G2 метаболизируется при участии фермента простациклинсинтетазы в простациклин Y2. Этого фермента много в эндотелии сосудов. В норме простаципия препятствует спазму сосудов, вызывает умеренную дилятацию микроциркуляторного русла, препятствует агрегации и адгезии тромбоцитов, препятствует развитию тромбоза. Простагландины G2 при участии тромбоксансинтетазы тромбоцитов метаболизируются в тромбоксан. В зоне альтерации наступает набухание эндотелия сосудов, его десквамация, обнажение, что вызывает активацию фактора Хагемана, приводящего к активации прокоагулянтной системы и возникновению тромбоза, активации калликреиновой системы. Эти ферменты действуют на белок плазмы крови - гликоген, отщепляющий от него активные пептиды - брадикинин, каллидин, вызывающие вазодилатацию сосудов. Кинины образуются и в тканях. Активация их возникает при сдвиге рН в кислую сторону. Возникает адгезия и агрегация тромбоцитов и тромбообразование. Тромбоциты дегранулируют, вызывая выброс серотонина, АТФ в зону альтерации. В цитоплазме тучных клеток находятся гранулы с биологически активными веществами. На действие любого повреждающего фактора возникает неспецифическая реакция дегрануляции и освобождение в окружающую среду биологически активных веществ: гистамина, гепарина, фактора агрегации и активации тромбоцитов, фактора хемотаксиса эозинофилов, которые стимулируют эмиграцию лейкоцитов. Большая роль в развитии выполняется принадлежность фибробластам. Они обладают способностью размножаться в зоне альтерация и усиленно продуцируют основные компоненты соединительной ткани: проколлагены, эластин, ретикулин, хондроитинсульфаты, гиалуроновую кислоту. Начинается образование фибробластического барьера, который инкапсулирует зону альтерация. В зону альтерации проникают лимфоциты, эмигрируют монокины. Все медиаторы зоны воспаления делят на: а) медиаторы гуморального происхождения (кинины, медиаторы свертывания крови, система комплемента. С3а, С5а); б) медиаторы клеточного происхождения, готовые или предсуществующие (медиаторы тучных клеток, серотонин, гепарин, лизосомальные ферменты); в) медиаторы клеточного происхождения, вновь образующиеся (эйкозаноиды, лимфокины, монокины, свободные радикалы). Различают первичную альтерацию - повреждение в момент действия альтерирующего фактора ее границы соответствуют границам повреждающего фактора и вторичную альтерацию, обусловленную действием диффундирующих из зоны первичной альтерации в окружающие неповрежденные ткани биологически активных веществ, медиторов воспаления.
Кейлоны (англ. кеу — ключ, long — единственный) — низкомолекулярные белки и гликопротеиды, служащие медиаторами межклеточного взаимодействия в пределах отдельных тканей. Выделяемые делящимися клетками, кейлоны тормозят в окружающих (соседних) клетках реакции митоза, скорость синтеза нуклеиновых кислот и белков. Привоспалении они играют наибольшую роль в регуляции процесса пролиферации. Активность кейлонов регулируют (тормозят) антикейлоны.
Гидролазы различных повреждённых в очаге воспаления клеточно-тканевых структур организма представлены различными гидролитическими ферментами, участвующими в развитии альтерации, нарушений местного кровообращения (артериальной и венозной гиперемии, а также ишемии и стаза), экссудации, эмиграции лейкоцитов, фагоцитоза, очищения очага воспаления от повреждённых и погибших клеточно-тканевых структур и замещения их пролиферирующими клетками.
Оксида азот — важный медиатор воспаления, образующийся главным образом эндотелиоцитами кровеносных сосудов и оказывающий сильное вазодилататорное действие.
Плазменные медиаторы воспаления представлены кининами, компонентами системы комплемента, факторами системы гемостаза (изменяющими свёртывание, антисвёртывание и фибринолиз крови).
 http://vmede.org/index.php?topic=117.0
http://vmede.org/index.php?topic=117.0
ПРОДУКТИВНОЕВОСПАЛЕНИЕ
• Продуктивное, или пролиферативное,
воспаление характеризуется
преобладанием пролиферации клеточных
элементов. Главными признаками
продуктивного воспаления являются:
инфильтрация мононуклеарами, особенно
макрофагами, лимфоцитами и
плазматическими клетками, пролиферация
фибробластов, во многих случаях —
нарастающий фиброз и выраженная в той
или иной степени деструкция (альтерация)
ткани. При этом Процессы экссудации
также имеют место, но они отходят на
второй план.
Этиология.
Причины продуктивного воспаления
разнообразны — биологические факторы
(вирусы, риккетсии, бактерии, грибы,
паразиты), физические и химические
факторы (чаще имеет место пролонгированная
экспозиция неповреждающими, но
потенциально токсичными субстанциями
типа асбеста, оксида кремния (IV) и т.п.;
инородные тела и др.)» иммунные реакции,
в частности такие, которые возникают,
например, против собственных тканей
при аутоиммунных болезнях. Иногда
непосредственно этиологический фактор
вызывает продуктивную реакцию, что
особенно типично для вирусов и риккетсии.
Учитывая часто наблюдаемую персистенцию
этиологического фактора, основными
особенностями продуктивного воспаления
считают длительное воздействие
патогенного раздражителя и хроническое
течение (только в редких случаях оно
протекает остро). Длительная антигенная
стимуляция, развивающаяся зачастую
на фоне измененной реактивности
организма, приводит к развитию реакций
гиперчувствительности.
Для
продуктивного воспаления характерны
пролиферация клеток гематогенного и
гистиогенного происхождения,
дифференцировка их и клеточные
трансформации (схема 21). В очагах
продуктивного воспаления отмечается
выраженная пролиферация моноцитов.
Моноциты начинают эмигрировать
относительно рано и в пределах 48 ч
становятся преобладающими. Достигнув
экстраваскулярных тканей, моноциты
трансформируются в макрофаги. Появление
макрофагов осуществляется тремя
механизмами. Во-первых, из циркулирующей
крови. Это
наиболее важный источник. Стимулом
для появления моноцитов служат фибриноген,
пептиды, катионные белки нейтрофилов,
лимфокины, некоторые факторы роста
(трансформирующий фактор роста,
тромбоцитарный фактор роста), а также
фрагменты разрушающегося коллагена
и фибронектин. Каждый из них играет роль
при определенных обстоятельствах.
Например, лимфокины появляются во
время иммунных реакций типа ГЗТ.
Во-вторых,местная
пролиферация —
путем митотического деления макрофагов
после эмиграции их из крови.
В-третьих, пролонгированное
выживание ("бессмертные
клетки") ииммобилизация
макрофагов в зоне воспаления. Этот
вариант типичен для медленных вирусных
инфекций или в случаях отложения
малотоксичных веществ типа инертных
липидов, угольной пыли.
Макрофаг
является центральной фигурой при
продуктивном воспалении благодаря
большому количеству биологически
активных продуктов, которые он может
производить. Одни из этих продуктов
токсичны по отношению к тканям (например,
метаболиты кислорода, протеазы),
другие вызывают приток клеток иных
типов (лимфоцитов, нейтрофилов,
фибробластов), каждая из которых вносит
свою лепту в широкую палитру изменений
при хроническом воспалении, для которого
характерны прогрессирующее повреждение
тканей и последующие функциональные
Нарушения.
Макрофаг
— основной представитель системы
моноцитарных фагоцитов (СМФ), его нередко
называют профессиональным фагоцитом,
так как основной его функцией является
эндоцитоз, а еще точнее, фагоцитоз. Для
осуществления этой функции на поверхности
макрофага имеются десятки специфических
рецепторов, в частности развитая и
сложная система Fc-рецепторов к различным
иммуноглобулинам, лектиноподобные
рецепторы для захвата бактерий, грибов
и т.д.
Фагоцитоз
— характерная черта продуктивного
воспаления, однако он далеко не всегда
завершается полным перевариванием
чужеродного агента. Во многих случаях
живые агенты, обладая защитными
механизмами, выживают внутри макрофагов
(эндоцитобиоз), и процесс приобретает
хронический характер.
Являясь
самой распространенной клеткой среди
других клеток воспалительного
инфильтрата, макрофаг в
то же время занимает
ключевую позицию в клеточных кооперациях
при продуктивном воспалении (схема
22). Важнейшими продуктами секреции
макрофагов являются цитокины (ИЛ-1, ИЛ-2,
ИЛ-5, ИЛ-6, ИЛ-8, ФНО-а), с помощью которых
осуществляются прежде всего активация
лимфоцитов и межклеточные взаимоотношения,
и факторы роста (ФРФ, ТцФР, КСФ, ТФР),
стимулирующие клеточную пролиферацию,
в частности, Т- и В-лимфоцитов,
эндотелиоцитов, тромбоцитов и
клеток-предшественников миелоидного
ряда в костном мозге. Влияние на эндотелий
заключается в том, что, с одной стороны,
происходит его пролиферация, с другой
— усиливается адгезия тромбоцитов.
Кроме того, к секреторным продуктам
макрофага относится огромное количество
ферментов (кислые фосфатазы — гидролазы,
липазы; эстераза, нейтральные протеазы
— эластаза, коллагеназа и др.), реактивные
метаболиты кислорода (пероксид водорода,
супероксидный анион-радикал), биоактивные
л-и -п и д ы , например производные
арахидоновой кислоты (простаг-ландины,
лейкотриены, ФАТ), фибронектин, цАМФ,
оксид азота (II) и
др.
Схема 21. Пролиферация, дифференцировка, трансформация
клетоквочагевоспаления
 Схема 22. Взаимоотношениемакрофагасклеткамив
очагевоспаления
Схема 22. Взаимоотношениемакрофагасклеткамив
очагевоспаления
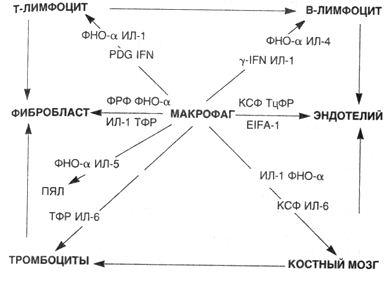 Клеточные
кооперации, т.е. взаимодействие макрофага
и других клеток воспалительного
инфильтрата между собой, с одной стороны,
и взаимодействие клеток с волокнистыми
структурами и различными компонентами
экстрацеллюлярного матрикса, с другой,
осуществляются с помощью комплекса
интегриновых рецепторов. Например,
кооперация макрофаг —■ лимфоцит
осуществляется с помощью интрацеллюлярных
адгезивных молекул (ICAM-1). При этом в
межклеточных кооперативных
взаимоотношениях важную роль играют
антигены гистосовместимости (система
HLA): они выступают в качестве маркеров,
осуществляющих антигенное считывание,
а также выполняют роль универсальных
рецепторов, представляющих чужеродные
антигены.
Другими
часто встречающимися клетками, помимо
макрофага, при продуктивном воспалении
являются лимфоциты, плазматические
клетки, эозинофилы и тучные
клетки.
Плазматические
клетки секретируют антитела, направленные
либо против персистирующих антигенов
в зоне воспаления, либо против поврежденных
компонентов ткани. В ряде случаев
плазматические клетки превращаются в
гомогенные шаровидные образования,
которые называют гиалиновыми шарами,
или тельцами Русселя.
Лимфоциты
мобилизуются как в антительных, так и
в клеточных иммунных реакциях. Однако
при неиммунном воспалении лимфоциты
встречаются также очень часто, и причина
этого явления до сих пор является
загадкой для морфологов. При иммунном
воспалении лимфоциты активируются,
контактируя с антигенами. Активированные
лимфоциты вырабатывают лимфокины —
главные стимуляторы моноцитов и
макрофагов, и 7-интерферон, который
способствует активации и дифференцировке
макрофагов. В то же время активированные
макрофаги выделяют монокины (ИЛ-1),
которые в свою очередь влияют на функцию
Т- и В-лимфоцитов.
Эозинофилы
преобладают в клеточных инфильтратах
прежде всего при паразитарных инфекциях,
т.е. в случаях иммунных реакций,
связанных с IgE. Эозинофилы относят к
хемотаксическим агентам, привлекающим
главным образом тучные клетки, гранулы
которых содержат главный базовый
протеин, очень токсичный для паразитов.
Эозинофилы, хотя и являются главными
при паразитарных инфекциях, вносят свой
вклад в повреждение тканей при состояниях
гиперчувствительности.
Нейтрофильные
лейкоциты обычно являются ключевым
признаком экссудативного воспаления,
однако в ряде случаев довольно четко
"уживаются"признаки хронического
продуктивного и острого (экссудативного)
воспаления. Это наблюдают, например,
при актиномикозе, при активном хроническом
гастрите.
Но
наиболее значимым для течения и исхода
продуктивного воспаления оказывается
влияние макрофага (ФРФ, ИЛ-1, ФНО-а) вместе
с тромбоцитами (ТцФР, ТФР-) и Т-лимфоцитами
ФНО-а) на фибробласты. Медиаторы этих
трех эффекторных клеток усиливают
пролиферацию и метаболизм фибробластов
и тем самым индуцируют синтез коллагена.
Таким образом, еще одной существенной
особенностью продуктивного воспаления
является развитие склероза в исходе
воспаления. Механизм, который приводит
к воспроизводству и распространенной
пролиферации фибробластов, к сосудистой
пролиферации, накоплению коллагена
и фиброзу при хроническом продуктивном
воспалении, аналогичен тому, который
возникает при заживлении ран (см.
лекцию 16 "Воспаление, регенерация и
дисрегенерация").
Выделяют
следующие виды продуктивного воспаления:
1) интерстициальное (межуточное); 2)
гранулематозное; 3) воспаление с
образованием полипов и остроконечных
кондилом.
Клеточные
кооперации, т.е. взаимодействие макрофага
и других клеток воспалительного
инфильтрата между собой, с одной стороны,
и взаимодействие клеток с волокнистыми
структурами и различными компонентами
экстрацеллюлярного матрикса, с другой,
осуществляются с помощью комплекса
интегриновых рецепторов. Например,
кооперация макрофаг —■ лимфоцит
осуществляется с помощью интрацеллюлярных
адгезивных молекул (ICAM-1). При этом в
межклеточных кооперативных
взаимоотношениях важную роль играют
антигены гистосовместимости (система
HLA): они выступают в качестве маркеров,
осуществляющих антигенное считывание,
а также выполняют роль универсальных
рецепторов, представляющих чужеродные
антигены.
Другими
часто встречающимися клетками, помимо
макрофага, при продуктивном воспалении
являются лимфоциты, плазматические
клетки, эозинофилы и тучные
клетки.
Плазматические
клетки секретируют антитела, направленные
либо против персистирующих антигенов
в зоне воспаления, либо против поврежденных
компонентов ткани. В ряде случаев
плазматические клетки превращаются в
гомогенные шаровидные образования,
которые называют гиалиновыми шарами,
или тельцами Русселя.
Лимфоциты
мобилизуются как в антительных, так и
в клеточных иммунных реакциях. Однако
при неиммунном воспалении лимфоциты
встречаются также очень часто, и причина
этого явления до сих пор является
загадкой для морфологов. При иммунном
воспалении лимфоциты активируются,
контактируя с антигенами. Активированные
лимфоциты вырабатывают лимфокины —
главные стимуляторы моноцитов и
макрофагов, и 7-интерферон, который
способствует активации и дифференцировке
макрофагов. В то же время активированные
макрофаги выделяют монокины (ИЛ-1),
которые в свою очередь влияют на функцию
Т- и В-лимфоцитов.
Эозинофилы
преобладают в клеточных инфильтратах
прежде всего при паразитарных инфекциях,
т.е. в случаях иммунных реакций,
связанных с IgE. Эозинофилы относят к
хемотаксическим агентам, привлекающим
главным образом тучные клетки, гранулы
которых содержат главный базовый
протеин, очень токсичный для паразитов.
Эозинофилы, хотя и являются главными
при паразитарных инфекциях, вносят свой
вклад в повреждение тканей при состояниях
гиперчувствительности.
Нейтрофильные
лейкоциты обычно являются ключевым
признаком экссудативного воспаления,
однако в ряде случаев довольно четко
"уживаются"признаки хронического
продуктивного и острого (экссудативного)
воспаления. Это наблюдают, например,
при актиномикозе, при активном хроническом
гастрите.
Но
наиболее значимым для течения и исхода
продуктивного воспаления оказывается
влияние макрофага (ФРФ, ИЛ-1, ФНО-а) вместе
с тромбоцитами (ТцФР, ТФР-) и Т-лимфоцитами
ФНО-а) на фибробласты. Медиаторы этих
трех эффекторных клеток усиливают
пролиферацию и метаболизм фибробластов
и тем самым индуцируют синтез коллагена.
Таким образом, еще одной существенной
особенностью продуктивного воспаления
является развитие склероза в исходе
воспаления. Механизм, который приводит
к воспроизводству и распространенной
пролиферации фибробластов, к сосудистой
пролиферации, накоплению коллагена
и фиброзу при хроническом продуктивном
воспалении, аналогичен тому, который
возникает при заживлении ран (см.
лекцию 16 "Воспаление, регенерация и
дисрегенерация").
Выделяют
следующие виды продуктивного воспаления:
1) интерстициальное (межуточное); 2)
гранулематозное; 3) воспаление с
образованием полипов и остроконечных
кондилом.
