
физиология растении готовый1
.docСОДЕРЖАНИЕ
«С-4» путь фотосинтеза (цикл Хетча-Слека)………………………………2
ВЛИЯНИЕ ВОДОЙ НА ИНТЕНСИВНОСТИ ФОТОСИНТЕЗА …………….3
ВЗАИМОСВЯЗЬ ДЫХАНИЯ И БРОЖЕНИЯ…………………………………7
ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ДЫХАТЕЛЬНОГО ОБМЕНА……………..12
ФИЗИОЛОГИЧЕСКИЙ РОЛЬ МИКРОЭЛЕМЕНТОВ……………………….16
ГОРМОНЫ РОСТА РАСТЕНИЙ……………………………………………….22
МОРОЗОУСТОЙЧИВОСТЬ РАСТЕНИЙ…………………………………….31
УСТОЙЧИВОСТЬ РАСТЕНИЙ К ЗАСОЛЕНИЮ,ЕЁ ФИЗИОЛОГИЧЕСКАЯ СУТЬ……………………………………………………………………………….41
СПИСОК ЛИТЕРАТУРЫ………………………………………………………..43
«С-4» путь фотосинтеза (цикл Хетча-Слека)
Путь углерода при фотосинтезе, установленный Кальвином, является основным. Однако существуют отклонения от этого пути. Так, австралийские ученые Хетч и Слек (1960) и советский ученый Ю.С. Карпилов (1960) показали, что у некоторых растений, по преимуществу тропических и субтропических( в том числе кукурузы, сахарного тросника), фотосинтез идет несколько по иному пути. На первом этапе происходит реакция карбоксилирования фосфоенолпировиноградной кислоты (ФЕП).
СН2СООН
¦ ¦
СО ~ (Р) + СО2+ Н2О > СН2+ Н3РО4
¦ ¦
СООН СО
¦
ФЕП СООН
ЩУК
Реакция катализируется ферментом фосфоенолпируваткарбоксилазой (ФЕП-карбоксилазой) с образованием ЩУК. Поскольку в этом случае первый продукт карбоксилирования - ЩУК содержит 4 атома углерода, его называют «С-4» путь, в отличии от цикла Кальвина, где образуется ФГК, содержащая 3 атома углерода («С-3» путь).ЩУК преобразуется в яблочную кислоту. В последующем происходит реакция транскарбоксилирования, при которой СО2снова отщепляется от органических кислот и вступает в цикл Кальвина - присоединяется к РДФ. Таким образом, сущность «С-4»пути заключается в том что реакция карбоксилирования происходит 2 раза. Это позволяет растению создавать запасы углерода в клетках. Как и во всяком биохимическом цикле, акцепторы (ФЕП и РДФ) регенерируют, что и создает возможность его непрерывного функционирования. Исследования показали, что в растениях, в которых процесс фотосинтеза протекает по «С-4» пути, имеются 2 типа хлоропластов: 1) крупные пластиды, часто лишенные гранул, в клетках обкладки, окружающие сосудистые пучки; 2) мелкие гранальные пластиды в клетках мезофила листа.
В клетках мезофила с мелкими хлоропластами осуществляется карбоксилирование фосфоенолпировиноградной кислоты с образованием 4-углеродногосоединения - ЩУК (и в некоторых случаях аспарагиновой кислоты.). Затем ЩУК передвигается в клетки обкладки, где происходит реакция транскарбоксилирования, в результате которой СО2отщепляется и вступает в цикл Кальвина. При этом фосфоенолпировиногрвдная кислота (ФЕП) регенерирует. Поскольку при таком механизме фотосинтеза принимает участие 2 типа клеток и 2 типа хлоропластов, этот путь называют кооперативным. Фиксация СО2 по «С-4» пути имеет ряд преимуществ. Показано, что некоторые представители растений, ведущие ассимиляцию по «С-4» пути, осуществляют первые этапы этого процесса (образование органических кислот) в ночной период суток. В последующий светлый период углекислота освобождается и реассимилируется в цикле Кальвина. Такая последовательность позволяет осуществлять фотосинтез днем при закрытых устьицах, что имеет большое значение, т.к. предохраняет растение от излишней потери воды. Возможно, именно с этим связано большая засухоустойчивость растений с таким типом фотосинтеза.
У растений, осуществляющих фотосинтез по «С-4» пути, отсутствует процесс фотодыхания. Это последнее обстоятельство уменьшает непроизводительную трату органического вещества и увеличивает продуктивность растений. Открытие «С-4» пути позволило расшифровать особенности фотосинтеза у суккулентов. Оказалось, что суккуленты в ночное время фиксируют углерод в органических кислотах, по преимуществу в яблочной. По-видимому это происходит под действием фермента пируваткарбоксилазы. Далее эта фиксированная углекислота с помощью транскарбоксилирования переносится на неидентифицированный акцептор и используется для образования триоз. Осуществление фотосинтеза по такому пути позволяет суккулентам в течении дня держать устьица закрытыми и таким образом сокращать транспирацию.
В литературе имеются указания о наличии других путей связывания СО2. Однако они еще недостаточно охарактеризованы. Важно также подчеркнуть, что на всех этапах фотосинтетического цикла промежуточные продукты могут претерпевать различные превращения в зависимости от условий среды. Именно это является основой для образования разнообразных продуктов фотосинтеза.
ВЛИЯНИЕ ВОДОЙ НА ИНТЕНСИВНОСТИ ФОТОСИНТЕЗА
Вода является непосредственным участником процесса фотосинтеза. Однако количество воды, необходимое для образования углеводов, ничтожно мало по сравнению с общим содержанием воды, необходимым для поддержания клетки в тургорном состоянии. Вместе с тем при полной насыщенности водой клеток листа фотосинтез снижается. Частично это может быть связано с тем, что при полном насыщении клеток мезофилла замыкающие устьичные клетки оказываются несколько сдавленными, устьичные щели не могут открыться (гидропассивные движения). Однако дело не только в этом. Небольшое обезвоживание листьев сказывается благоприятно на процессе фотосинтеза и вне зависимости от степени открытия устьиц. Так, погружение листьев в раствор маннита в концентрации 0,2—0,4 М вызывает водный дефицит, равный 15—20%, и некоторое возрастание интенсивности фотосинтеза. Таким образом, небольшой водный дефицит (5—15%) в клетках листьев оказывает благоприятное влияние на интенсивность фотосинтеза (В.А. Бриллиант). По-видимому, в процессе эволюции выработаны приспособления работы ферментов к небольшому водному дефициту. Действительно, небольшой водный дефицит активизирует ряд ферментов (Н.М. Сисакян).
Увеличение водного дефицита свыше 15—20% приводит к уже заметному снижению интенсивности фотосинтеза. Это связано в первую очередь с закрытием устьиц (гидроактивные движения), что резко уменьшает диффузию С02 в лист. Кроме того, это вызывает сокращение транспирации, и, как следствие, возрастает температура листьев. Между тем повышение температуры выше 30°С вызывает снижение фотосинтеза. Наконец, обезвоживание оказывает влияние на конформацию, а следовательно, и активность ферментов, принимающих участие в темновой фазе фотосинтеза, повреждает структуру тилакоидов. При обезвоживании также замедляется процесс фотофосфорилирования (И.А. Тарчевский). Длительное обезвоживание растений может привести к тому, что интенсивность фотосинтеза не восстанавливается после улучшения снабжения водой.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ИНТЕНСИВНОСТЬ ФОТОСИНТЕЗА
Влияние температуры на фотосинтез находится в зависимости от интенсивности освещения. При низкой освещенности фотосинтез от температуры не зависит (Q10=1). Следовательно, при низком уровне освещенности фотосинтез идет с одинаковой скоростью при 15° и 25°С. Это связано с тем, что при низкой освещенности интенсивность фотосинтеза лимитируется скоростью световых реакций. Напротив, при высокой освещенности скорость фотосинтеза определяется протеканием темновых реакций. В этом случае влияние температуры проявляется очень отчетливо и температурный коэффициент Q10 может быть около двух. Так, для подсолнечника повышение температуры в интервале от 9 до 19°С увеличивает интенсивность фотосинтеза в 2,5 раза.
Температурные пределы, в которых возможно осуществление процессов фотосинтеза, различны для разных растений. Понижение температуры влияет на фотосинтез прямо, уменьшая активность ферментов, участвующих в темновых реакциях, и косвенно, благодаря повреждению органелл. Минимальная температура для фотосинтеза растений средней полосы около 0°С, для тропических растений 5—10°С. Имеются данные, что ранневесенние и высокогорные растения могут осуществлять фотосинтез и при температуре ниже 0°С. Лишайники могут ассимилировать С02при температуре —25°С. Оптимальная температура фотосинтеза для большинства растений средней полосы составляет примерно 20—25°С. При этом для растений, ведущих фотосинтез по С4-пути, оптимальная температура более высокая (35—45°С и выше), для цианобактерий оптимум температуры фотосинтеза значительно выше. При температуре выше оптимальной интенсивность фотосинтеза резко падает. Это связано с тем, что зависимость процесса фотосинтеза от температуры представляет собой равнодействующую противоположных процессов. Так, повышение температуры увеличивает скорость темновых реакций фотосинтеза. Одновременно при температуре 25—30°С происходит процесс инактивации хлоропластов. Повышение температуры может вызвать также закрытие устьичных щелей. Наконец, как уже говорилось, повышение температуры увеличивает интенсивность дыхания, и в этой связи видимый фотосинтез (разность между фотосинтезом и дыханием) уменьшается. Понижение температуры также снижает фотосинтез, поскольку тормозится активность ферментов, уменьшается скорость диффузионных процессов, а также отток ассимилятов.
ВЛИЯНИЕ КИСЛОРОДА НА ИНТЕНСИВНОСТИ ФОТОСИНТЕЗА
Зависимость фотосинтеза от концентрации кислорода в среде довольно сложна. Как правило, процесс фотосинтеза высших растений осуществляется в аэробных условиях при концентрации кислорода около 21 %. Исследования показали, что как увеличение концентрации кислорода, так и отсутствие его неблагоприятны для фотосинтеза.Действие кислорода зависит от его концентрации, вида и физиологического состояния растения, других условий внешней среды. Обычная концентрация кислорода в атмосфере (21 %) не является оптимальной, а значительно превышает последнюю. Поэтому снижение парциального давления кислорода до 3 % практически не сказывается отрицательно на фотосинтезе, а в ряде случаев может даже активировать его. У растений различных видов снижение концентрации кислорода вызывает неодинаковый эффект. Так, по данным А.А Ничипоровича (1973), уменьшение концентрации кислорода от 21 до 3 % сказывалось благоприятно на растениях с активным фотодыханием (бобы). Для кукурузы, у которой фотодыхание почти отсутствует, не отмечено изменений в интенсивности фотосинтеза при переходе от 21 до 3% 02.Неоднозначное и часто противоположное влияние разных концентраций кислорода на фотосинтез обусловлено тем, что конечный эффект зависит от направленности действия нескольких механизмов. Известно, что присутствие кислорода необходимо для нормального функционирования электрон-транспортной цепи. Ряд компонентов ЭТЦ (ферредоксин, хиноны) могут взаимодействовать с 02, регулируя таким образом редокс-состояние цепи. При активном потоке электронов влияние кислорода положительно, так как «разгружает» цепь. Этот механизм имеет положительное значение также в том случае, когда нарушена регенерация НАДФ+. Возможность сброса электронов на 02 обеспечивает функционирование ЭТЦ и запасание энергии в реакциях псевдоциклического фотофосфорилирования. Вместе с тем сброс электронов ЭТЦ на кислород приводит к образованию активных форм кислорода (АФК), которые могут вызывать нарушения фотосинтезирующих структур и ингибировать фотосинтез. При слабом электронном потоке кислород, конкурируя за электроны, также снижает эффективность работы ЭТЦ.Другим достаточно хорошо изученным механизмом действия кислорода на фотосинтез является его влияние на ключевой фермент фотосинтеза — РуБФ-карбоксилазу. Хорошо установлено ингибирующее действие высоких концентраций 02 на карбоксилазную функцию фермента и активирующее действие на его оксигеназную функцию (на скорость фотодыхания). В зависимости от концентрации С02 в среде ингибирующее действие высоких концентраций кислорода на фотосинтез может проявиться в большей или меньшей степени. Этот механизм лежит в основе явления, известного как«эффект Варбурга».В 1920 г. Варбург впервые обнаружил ингибирующее действие высоких концентраций кислорода на фотосинтез водорослиChlorella.Эффект Варбурга отмечен для многих видов высших растений (O.Bjorkman, 1966), а также при исследовании фиксации С02 изолированными хлоропластами (R.Everson, M.Gibbs, 1967). Кислородное ингибирование фотосинтеза, по мнению многих исследователей, обусловлено двумя составляющими — прямым ингибированием РуБФ-карбоксилазы за счет высоких концентраций 02 и активацией процесса фотодыхания. При повышении концентрации С02 в атмосфере степень кислородного ингибирования фотосинтеза существенно снижается.Эффект Варбурга проявляется не у всех растений, у ряда растений аридных пустынь обнаружен «антиэффект Варбурга» — подавление фотосинтеза низкими концентрациями кислорода (1%О2) (А. Т. Мокроносов, 1981, 1983). Исследования показали, что положительное или отрицательное влияние 02 на фотосинтез зависит от соотношения в листе фототрофных и гетеротрофных тканей. У растений, где фототрофные ткани составляют большую часть объема листа, при низком содержании кислорода проявляется усиление фотосинтеза. У растений, содержащих большую долю гетеротрофных тканей, в этих условиях проявляется «антиэффект Варбурга» — подавление фотосинтеза в бескислородной среде. Это противоположное действие низких концентраций кислорода обусловлено сложным взаимодействием фотосинтеза, фотодыхания и темнового дыхания в клетках листа разного типа (фототрофных, гетеротрофных).
ВЗАИМОСВЯЗЬ ДЫХАНИЯ И БРОЖЕНИЯ.
Брожение— это внутренний окислительно-восстановительный процесс, при котором акцептором электронов служит органическая молекула и суммарная степень окисления образующихся продуктов, отличается от степени окисления сбраживаемого вещества. С.П. Костычев выдвинул положение о генетической связи процессов брожения и дыхания. При этом он опирался на следующие факты:
1. У высших растений был найден весь набор ферментов, который катализирует отдельные этапы процесса брожения.
2. При временном попадании в условия анаэробиоза высшие растения определенное время существуют за счет энергии, выделяющейся в процессе брожения. Правда, поскольку процесс брожения энергетически значительно менее эффективен, в анаэробных условиях рост растений приостанавливается. Кроме того, продукты брожения, в частности спирт, ядовиты, и их накопление приводит к гибели растения.
3. При добавлении к клеткам факультативных анаэробов (дрожжи) полусброженных Сахаров интенсивность дыхания у них резко возрастает, следовательно, полусброженные продукты являются лучшим субстратом дыхания по сравнению с неизмененными сахарами.
В настоящее время общепризнано, что первые этапы (гликолиз) протекают одинаково при процессах, как дыхания, так и брожения. Поворотным моментом является образование пировиноградной кислоты. В аэробных условиях пировиноградная кислота распадается до С02 и воды в результате декарбоксилирования и цикла Кребса (дыхание), тогда как в анаэробных она преобразуется в различные органические соединения (брожение). Организм обладает способностью при изменении условий переключать процессы, прекращая брожение и усиливая дыхание и наоборот. Впервые в опытах Пастера было показано, что в присутствии кислорода процесс брожения у дрожжей тормозится и заменяется процессом дыхания. Одновременно резко сокращается распад глюкозы. Это явление оказалось характерным для всех факультативных анаэробных организмов, включая высшие растения, и получило название эффекта Пастера. Сокращение расхода глюкозы в присутствии кислорода целесообразно, поскольку при дыхательном распаде выход энергии значительно выше, а следовательно, глюкоза используется более экономно. Однако осуществление разбираемого эффекта требует специальных механизмов, которые будут рассмотрены далее. В зависимости от получаемого продукта различают разные типы брожения. При спиртовом брожении пировиноградная кислота, образовавшаяся в процессе гликолиза, декарбоксилируется с образованием уксусного альдегида при участии фермента пируватдекарбоксилазы, а затем восстанавливается до этилового спирта ферментом алкогольдегидрогеназой:
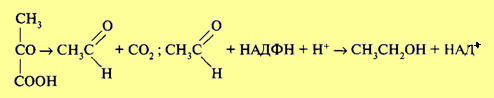
Обе эти реакции не сопровождаются образованием АТФ. В связи с этим выход АТФ при спиртовом брожении такой же, как при гликолизе (первой фазы брожения и дыхания), и составляет две молекулы при распаде 1 моль глюкозы. Восстановленные никотинамидные коферменты НАДН + Н+, образовавшиеся в процессе гликолиза, не поступают в дыхательную цепь (у анаэробных оргАнизмов ее и нет), а используются для восстановления уксусного альдегида до спирта. Следовательно, энергетический выход процессов брожения крайне низок. Разные микроорганизмы осуществляют и разные типы брожения. Так, молочнокислые бактерии накапливают молочную кислоту. При этом пировиноградная кислота восстанавливается до молочной кислоты:
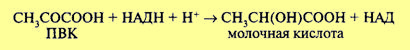
Для некоторых облигатных анаэробных микроорганизмов, например азотфиксирующей бактерии Clostridium pasteurianum, характерно образование в процессе брожения масляной кислоты, С02и N2. Процесс брожения служит источником энергии для облигатных (обязательных) или факультативных анаэробных организмов. Обе эти реакции не сопровождаются образованием АТФ. В связи с этим выход АТФ при спиртовом брожении такой же, как при гликолизе (первой фазы брожения и дыхания), и составляет две молекулы при распаде 1 моль глюкозы. Восстановленные никотинамидные коферменты НАДН + Н+, образовавшиеся в процессе гликолиза, не поступают в дыхательную цепь (у анаэробных организмов ее и нет), а используются для восстановления уксусного альдегида до спирта. Следовательно, энергетический выход процессов брожения крайне низок. Разные микроорганизмы осуществляют и разные типы брожения. Так, молочнокислые бактерии накапливают молочную кислоту. При этом пировиноградная кислота восстанавливается до молочной кислоты: Для некоторых облигатных анаэробных микроорганизмов, например азотфиксирующей бактерии Clostridium pasteurianum, характерно образование в процессе брожения масляной кислоты, С02 и N2. Процесс брожения служит источником энергии для облигатных (обязательных) или факультативных анаэробных организмов.
АНАЭРОБНЫЕ ПРЕВРАЩЕНИЯ ПРОДУКТОВ ГЛИКОЛИЗА
Гликолитический путь представляет собой 10 последовательных реакций, каждая из которых катализируется отдельным ферментом.
Процесс гликолиза условно можно разделить на два этапа. Первый этап, протекающий с расходом энергии 2-х молекул АТФ, заключается в расщеплении молекулы глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое окисление глицеральдегид-3-фосфата, сопровождающееся синтезом АТФ. Сам по себе гликолиз является полностью анаэробным процессом, то есть не требует для протекания реакций присутствия кислорода.
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецифичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы—глюкозо-6-фосфат(Г-6-Ф):
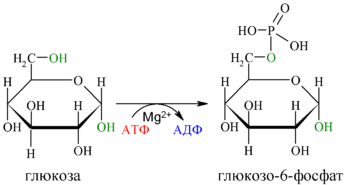
Для протекания реакции необходимо наличие в среде ионовMg2+, с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза.
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы.
Печёночный изофермент гексокиназы—глюкокиназа— имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат(Ф-6-Ф):
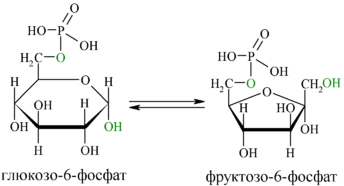
Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
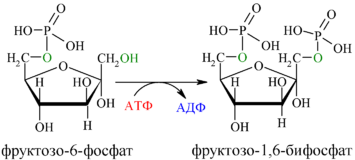
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ) на две триозы (4).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:
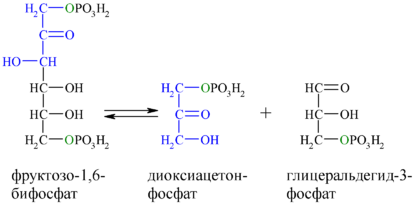
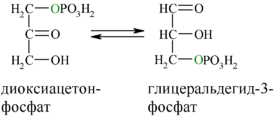
В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат, причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5), который и участвует в дальнейших превращениях:
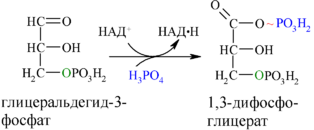
Каждая молекула глицеральдегидфосфата окисляется НАД+ в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглицерата(6):
Далее с 1,3-дифосфоглицерата, содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция7)— образуется молекулаАТФ:
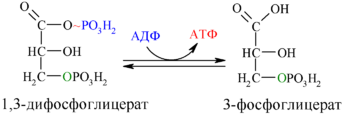
Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3. Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
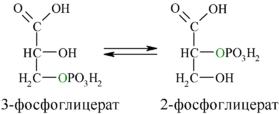
Затем последовательно:фосфоглицеролмутаза образует 2-фосфоглицерат(8):
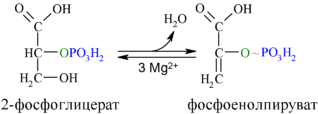
Енолаза образует фосфоенолпируват (9):
И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10):
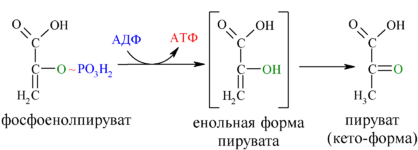
Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции7 и 10, в которых и происходит к субстратное фосфорилирование АДФ.
ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ДЫХАТЕЛЬНОГО ОБМЕНА
Наряду
с разложением глюкозы в процессе
гликолиза существует другой, не менее
распространенный путь — пентозофосфатный,
или апотомический. В этом случае глюкоза
также подвергается первоначальному
фосфорилированию с образованием
глюкозо-6-фосфата, затем пути расходятся.
Монофосфорный эфир глюкозы подвергается
окислению при участии фермента
глюкозо-6-фосфатде-гидрогеназы. Коферментом
является НАДФ, при этом образуется
фосфоглюконовая кислота. Процесс
происходит следующим образо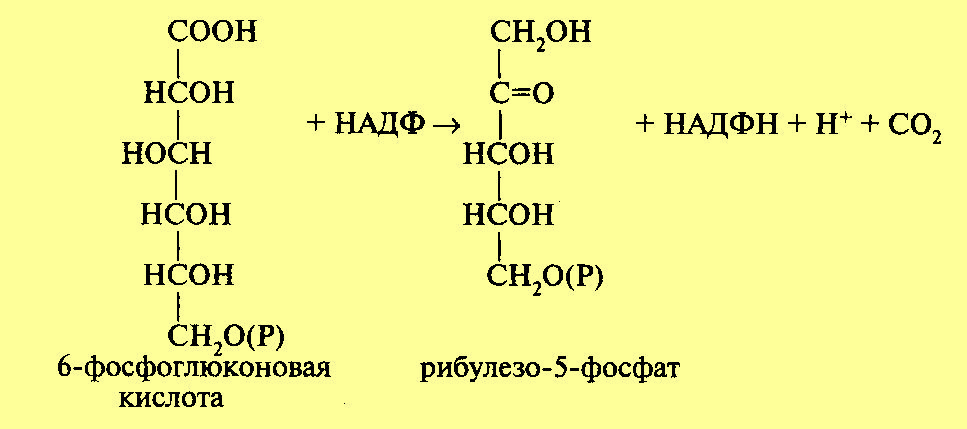
На следующем этапе происходит процесс окислительного декарбоксилирования фосфоглюконовой кислоты. В результате этой реакции отщепляется одна молекула углекислого газа и образуется пятиуглеродный сахар рибулезо-5-фосфат. Отсюда и название — пентозофосфатный цикл или апотомический путь (апотомия — усекновение). Реакция катализируется ферментом фосфоглюконатдегидрогеназой с коферментом НАДФ:
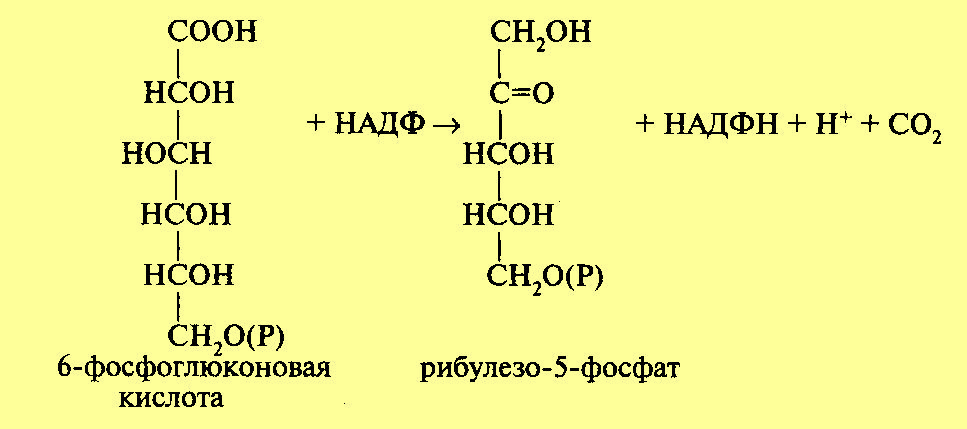
Обе рассмотренные реакции необратимы. Последующие реакции представляют цикл. Для прохождения полного цикла реакций необходимы три молекулы гексозомонофосфата, которые превращаются в три молекулы рибулезо-5-фос-фата по уравнению:
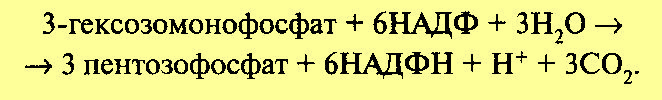
Три образовавшиеся молекулы пентозы (рибулезо-5-фосфат) претерпевают превращения. Первая молекула рибулезо-5-фосфата под влиянием фермента эпимеразы превращается в ксилулозо-5-фосфат. Вторая молекула рибулезо-5-фосфата превращается в рибозо-5-фосфат под влиянием фермента фосфопентоизомеразы. Ксилулозо-5-фосфат реагирует с рибозо-5-фосфатом, в результате получается семиуглеродный сахар — седогептулозо-7-фосфат и фосфоглицериновый альдегид. Эта последняя реакция идет под влиянием фермента транскетолазы:
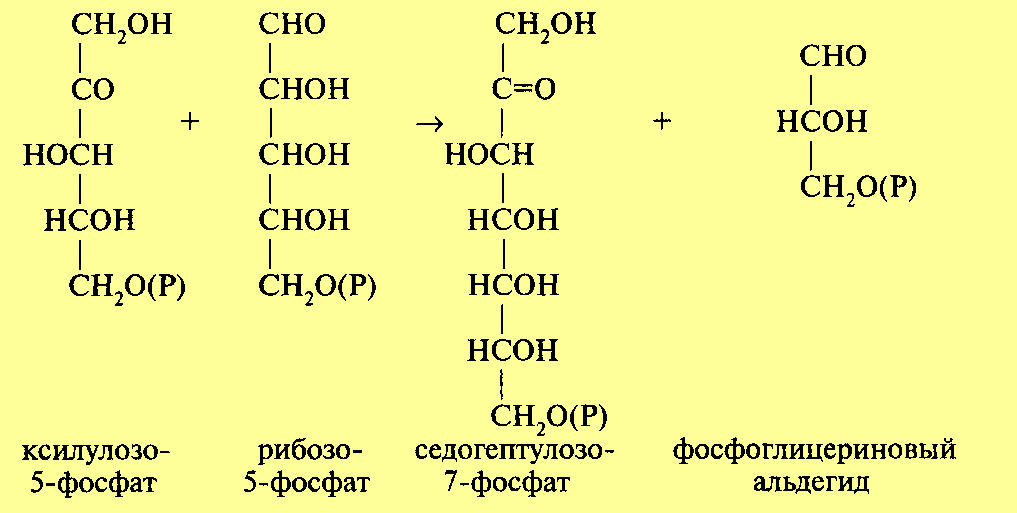
Семиуглеродный сахар реагирует с ФГА, при этом образуется фруктозо-6-фос-фат и эритрозофосфат. Фруктозо-6-фосфат изомеризуется до глюкозо-6-фосфа-та. Эритрозофосфат вместе с третьей молекулой рибулезо-5-фосфата также дает глюкозо-6-фосфат и ФГА. В целом процесс может быть суммирован в следующем виде:
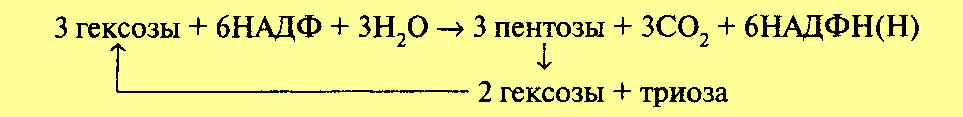
Триоза (ФГА) может претерпевать превращения по гликолитическому пути до пировиноградной кислоты и далее вступать в цикл Кребса. Как видно из уравнения, в пентозофосфатном цикле из каждых трех молекул глюкозы распадается одна, при этом выделяются 3 молекулы С02 и образуются 6 молекул НАДФН и ФГА. Окисление НАДФН идет через дыхательную цепь, при этом первоначально НАДФН взаимодействует с НАД. При включении 6 молекул НАДФН в дыхательную цепь образуется 18 молекул АТФ. Если считать, что 1 молекула АТФ используется на предварительное фосфорилирование гексозы, то накапливается 17 молекул АТФ. Вместе с тем при превращении фосфоглицеринового альдегида в пировиноградную кислоту и ее окислении через цикл Кребса образуется еще 20 молекул АТФ. Таким образом, при окислении по пентозофосфатному пути одной молекулы глюкозы выделяется 37 молекул АТФ. Следовательно, с энергетической стороны апотомический путь почти не отличается от гликолитического. Однако они сильно различаются по промежуточным продуктам. В процессе апотомического распада глюкозы образуется восстановленный НАДФ, который может быть использован на различные синтетические процессы, в том числе и в темновых реакциях фотосинтеза. Важное значение имеет образование пентоз. Пентозы входят в состав нуклеиновых кислот. Нельзя не отметить, что образующийся в этом процессе эритрозофосфат является предшественником лигнина и ряда других соединений.
